






化学人教版 (2019)第一节 原子结构与元素周期表备课课件ppt
展开具有相同核电荷数(质子数)的同一类原子的总称。
三、核素、元素和同位素P90
→(元素由质子数决定)
原子既讲种类又讲个数。
①元素只论种类, 不讲个数。
如:水由氧元素和氢元素组成
一个水分子由1个O原子和2个H原子构成
问题:同种元素的原子质子数相同,中子数是否一定相同?
水分子由O原子和H原子构成
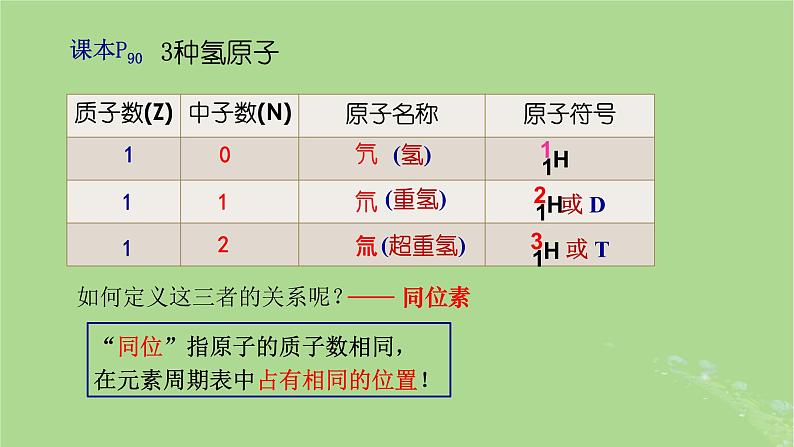
如何定义这三者的关系呢?
“同位”指原子的质子数相同,在元素周期表中占有相同的位置!
质子数相同而中子数不同
的同一元素不同原子间的互称
(类比:同学关系,同桌关系等)
大多数元素都有同位素。
(元素只有118种,原子却多得多)
同素异形体:由同种元素形成的不同单质,互称为同素异形体。
如:氧气和臭氧、石墨和金刚石、红磷和白磷。
①同位素的化学性质基本相同,物理性质有的相近,有的差异很大。
④天然存在的同位素,相互间保持一定的原子个数百分比不变。
②由同位素形成的“单质”混合在一起是纯净物
③同位素之间的转化既不是物理变化也不是化学变化,是核反应
如:H2、D2、T2、HD等混合在一起,都是氢气,属纯净物
例如:氯元素天然存在两种同位素
(4)利用放射性同位素释放的射线育种、治疗恶性肿瘤。
具有一定数目的质子和一定数目的中子的一种原子。
简单理解:核素即一种原子
元素、核素、同位素之间的关系
→同种元素,可以有若干种不同的核素。
→同位素是同一元素的不同核素之间的互相称谓, 不指具体的原子。
讨论2:若两种粒子的质子数和电子数相等,下列说法中不正确的是( )A.它们可能是同位素 B.它们可能是不同的分子C.它们可能是一种分子和一种离子D.它们可能是一种分子和一种原子
讨论1:下列符号代表几种元素?几种核素? 4018Ar 4019K 4220Ca 4119K 4020Ca 4019K+
1.原子的相对原子质量
2.原子的近似相对原子质量
已知:一个16O原子的质量为2.657×10-26 kg
1.993×10-26 kg
2.657×10-26 kg
是该元素各种天然、稳定的核素的相对原子质量与其所占原子个数百分比(也称“丰度”)乘积之和。即: Ar =Ar1·a%+Ar2·b%+Ar3·c%+……
即: Ar =A1·a%+A2·b%+A3·c%+……
3. 元素的平均相对原子质量:
4. 元素的近似相对原子质量:
(A1、A2、A3……为质量数)
是按各种天然同位素原子所占百分比算出的平均值。
是该元素各种天然、稳定的核素的相对原子质量与其所占原子个数百分比(也称“丰度”)乘积之和。即: Ar =Ar1·a%+Ar2·b%+Ar3·c%+……
34.969×75.77% + 36.966 × 24.23%
35×75.77% + 37× 24.23%
氯元素的相对原子质量=
原子的近似相对原子质量:
原子的相对原子质量Ar:
是该元素各种天然、稳定的核素的相对原子质量与其所占原子个数百分比(也称“丰度”)乘积之和。
某原子真实质量与12C原子真实质量的1/12的比值。
③元素的平均相对原子质量:
④元素的近似相对原子质量:
记住:元素无质量数,原子才有质量数。
(1)一种元素有几种同位素,就有几种核素的相对原子质量。
(2)元素周期表中所列相对原子质量为元素的平均相对原子质量。
(3)在计算中常用质量数代替原子的相对原子质量近似计算。
(4)元素无质量数,原子才有质量数。
写出下列各物质的相对分子质量:
2.下述各对物质, 互为同位素的是 ,互为同素异形体的是 。(A)金刚石和石墨 (B)H2O和D2O (C)11H2和21H2 (D)126C和136C (E) NO2和NO (F) 235U 和 238U (G) O 2 和 O 3 (H)Na和Na+
同素异形体:指同种元素形成的性质不同的单质。
3.氯的原子序数为17,35Cl是氯元素的一种核素,下列说法正确的是 A.35Cl原子所含质子数为18B.1/18ml的1H35Cl分子所含中子数约为6.02×1023C.3.5 g的35Cl2气体的体积为2.24 LD.35Cl2气体的摩尔质量为70 g / ml
4.重水(D2O)是重要的核工业原料,下列说法错误的是( )A.氘(D)原子核外有1个电子B.1H与D互称同位素C.H2O与D2O互称同素异形体
5.若某元素某原子核内的质子数为m,中子数为n,则下列叙述中正确的是( )A.这种元素的质量数是m+nB.不能由此确定该元素的相对原子质量C.若碳原子的质量为wg,则此原子的质量为(m+n)wgD.该原子核内中子的总质量小于质子的总质量
元素无质量数,原子才有质量数。
6. 铜有两种天然同位素63Cu和65Cu,已知铜的相对原子质量是63.5,则63Cu的原子个数百分数是( )A.75% B.25% C.50% D.45%
Cu元素近似相对原子质量= A1×a1 + A2×a2 = 63×a1+ 65×a2 = 63.5
也可以用“十字交叉法”计算
7、硼元素的平均相对原子质量为10.8,则硼在自然界中的两种同位素10B和11B的原子个数比( )A、1:1 B、1:2 C、1:3 D、1:4
8、相同温度下,等体积的两个集气瓶分别盛12C、14N、18O三种原子构成的CO和N2,下列说法正确的是( )A、质量和分子数相同B、质量和分子数都不同C、若压强相同,则含有相同的质子数,但质量不同D、若压强相同,则含有相同的原子、质子、中子和电子
9.氯元素中有3517Cl和3717Cl两种天然、稳定的核素,3517Cl和3717Cl的原子个数比为3∶1。由3517Cl和3717Cl构成的、相对分子质量分别为70、72、74的三种分子的个数比为( )A.6∶6∶1 B.3∶3∶1 C.6∶3∶1 D.9∶3∶1
相对分子质量为70、72、74的三种分子分别是:3517Cl2、3517Cl3717Cl、3717Cl2,
假设其分子个数为x、y、z
则(2x+y)∶(y+2z)=3∶1
阳离子: Na+、 Mg2+ 、Al3+
阴离子: F-、 O2-、 N3-
二核10e-的分子____;二核10e-的离子______;三核10e-的分子____;四核10e-的分子______;四核10e-的离子____;五核10e-的分子______。五核10e-的离子____;
归纳1—20号元素粒子的电子数特点
2e-的粒子:10e-的粒子:18e-的粒子:
H He Li Be
Li+ Be2+
Na Mg Al
C N O F
CH4 NH3 H2O HF
Na+ Mg2+ Al3+
CH3 NH2 OH F9电子的粒子
Si P S Cl
SiH4 PH3 H2S HCl
P3- S2- Cl-
F2 H2O2 N2H4 C2H6 CH3OH CH3F等
N3- O2- F-
H原子:1个电子H+离子:0电子
Na+ Mg2+ Al3+
P3- S2- Cl-
高中化学人教版 (2019)必修 第一册第一节 原子结构与元素周期表教学课件ppt: 这是一份高中化学人教版 (2019)必修 第一册第一节 原子结构与元素周期表教学课件ppt,共36页。PPT课件主要包含了素养要求,元素周期表,典例剖析,同位素,当堂练习等内容,欢迎下载使用。
人教版 (2019)必修 第一册第一节 原子结构与元素周期表教学ppt课件: 这是一份人教版 (2019)必修 第一册第一节 原子结构与元素周期表教学ppt课件,共20页。PPT课件主要包含了学习目标等内容,欢迎下载使用。
化学必修 第一册第四章 物质结构 元素周期律第一节 原子结构与元素周期表说课ppt课件: 这是一份化学必修 第一册第四章 物质结构 元素周期律第一节 原子结构与元素周期表说课ppt课件,共36页。PPT课件主要包含了▶思路一,▶思路二,周期七个横行,短周期,长周期,个主族A,个副族B,族的别称,第ⅣA族碳族元素,第ⅤA称氮族元素等内容,欢迎下载使用。













