






还剩22页未读,
继续阅读
成套系列资料,整套一键下载
- 【同步课件】1.1.2 分散系及其分类高一化学同步备课(人教版2019必修第一册) 课件 9 次下载
- 【分层练习】1.1.2 分散系及其分类高一化学同步备课(人教版2019必修第一册)(原卷版+解析版) 试卷 5 次下载
- 【分层练习】1.1.3 物质的转化高一化学同步备课(人教版2019必修第一册)(原卷版+解析版) 试卷 5 次下载
- 人教部编版八年级道德与法治下册 第一单元 坚持宪法至上第二课 保障宪法实施 / 坚持依宪治国坚持依宪治国(PPT课件+素材) 课件 0 次下载
- 【分层练习】1.2 .1 电解质的电离高一化学同步备课(人教版2019必修第一册)(原卷版+解析版) 试卷 5 次下载
【同步课件】1.1.3 物质的转化高一化学同步备课(人教版2019必修第一册)
展开
这是一份第一章第一节 第三课时 物质的转化(同步课件)-2024-2025学年高一化学同步备课(人教版2019必修第一册),共30页。
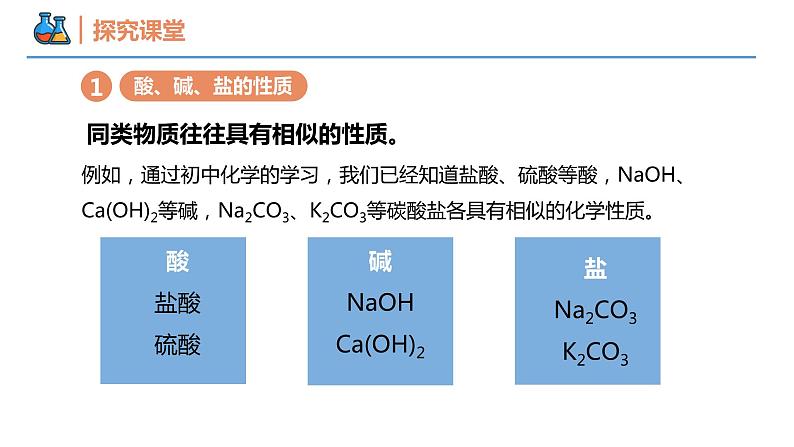
第一章 物质及其变化 第一节 物质的分类及转化 课时3 物质的转化 壹贰各种物质的性质物质的转化及应用本节重点本节难点如何对化学物质进行分类?建立科学的分类标准分类的优点是什么?便于对未知物质的研究分析通过对物质的分类,我们可以更好地认识某类物质的性质,以及不同类别物质之间的转化关系,进而利用物质的性质和物质之间的转化关系,制备人类生活和生产所需要的新物质。美丽的溶洞——自然界中物质的转化自然界中的溶洞景观,千奇百怪,引人入胜,在惊叹自然界美丽之余,你是否想过,如此坚硬的石头怎么会溶成一个大洞呢?石灰石的主要成分与溶有CO2的水发生了化学反应而被溶解:CaCO3+CO2+H2O=Ca(HCO3)2生成的Ca(HCO3)2在受热时又分解,Ca(HCO3)2 = CaCO3↓+CO2↑+H2O又沉降出CaCO3,如此一来就形成了溶洞景观美丽的化学——化学实验中物质的转化物理变化和化学变化的判断方法从宏观上判断有新物质生成是化学变化,反之为物理变化。从微观上判断有旧化学键断裂,同时有新化学键形成的是化学变化;只有化学键断裂的不一定是化学变化,如NaCl晶体的熔化。同类物质往往具有相似的性质。例如,通过初中化学的学习,我们已经知道盐酸、硫酸等酸,NaOH、Ca(OH)2等碱,Na2CO3、K2CO3等碳酸盐各具有相似的化学性质。酸盐酸硫酸碱NaOHCa(OH)2盐Na2CO3K2CO3(1)酸与指示剂的作用无色酚酞溶液遇酸不变色紫色石蕊试液遇酸变红(2)酸+金属→盐+氢气(3)酸+金属氧化物→盐+水Fe2O3+6HCl=2FeCl3+3H2OFe2O3+3H2SO4=Fe2(SO4)3+3H2O注:含有Fe3+的溶液显黄色除铁锈(4)酸+碱→盐+水中和酸性废液NaOH+HCl=NaCl+H2O2NaOH+H2SO4=Na2SO4+2H2O(5)酸+盐→新酸+新盐CaCO3+2HCl=CaCl2+H2O+CO2↑Na2CO3+2HCl=2NaCl+H2O+CO2↑Ba(NO3)2+H2SO4=BaSO4↓+2HNO3石灰石与盐酸的反应盐酸腐蚀含碳酸钙的建筑材料酸具有相似化学性质的原因:溶液中都含有H+与活泼金属反应与碱性氧化物反应与碱反应与某些盐反应使指示剂显色H2SO4 + Zn=ZnSO4+H2↑6HCl + Fe2O3 =2FeCl3+3H2OHCl + NaOH=NaCl+H2O2HCl+CaCO3=CaCl2+CO2↑+H2O使紫色石蕊变红色,无色酚酞不变色置换反应复分解反应复分解反应复分解反应碱具有相似化学性质的原因:溶液中都含有OH-与酸性氧化物反应与酸反应与某些盐反应使指示剂显色CO2 + 2NaOH=Na2CO3+H2OHCl + NaOH=NaCl + H2OCuSO4+2NaOH=Cu(OH)2↓+Na2SO4使紫色石蕊变蓝色,无色酚酞变红色复分解反应复分解反应复分解反应 酸 碱铵 盐钠 盐钙 盐铝 盐 硝 酸 盐 氯化物(盐酸盐) 硫 酸 盐 碳 酸 盐与较活泼金属反应与酸反应与碱反应与某些盐反应CuSO4+Fe=FeSO4+CuCaCO3+2HCl=CaCl2+H2O+CO2↑2NaOH+CuSO4=Cu(OH)2↓+Na2SO4BaCl2+CuSO4=CuCl2+BaSO4 ↓置换反应复分解反应复分解反应复分解反应(1)Fe与O2反应生成金属氧化物,方程式为 ,反应类型为 。(2)Fe与酸的反应生成盐和氢气,方程式为 ,反应类型为 。(3)Fe与盐的反应生成盐和金属,方程式为 ,反应类型为 。化合反应置换反应置换反应Fe+H2SO4 =FeSO4 + H2↑Fe+CuCl2 =FeCl2 + Cu金属O2酸(如H2SO4)盐(如CuCl2)Fe3O4FeSO4+H2FeCl2+CuCaO+H2O=Ca(OH)2(1) CO2与H2O反应生成含氧酸,方程式为 ,反应类型为 。(2) CO2与碱的反应生成盐和水,方程式为 ,反应类型为 。(3) CaO与水的反应生成碱,方程式为 ,反应类型为 。(4) CaO与酸的反应生成盐和水,方程式为 ,反应类型为 。CO2+H2O=H2CO3化合反应CO2+2NaOH=Na2CO3+H2O复分解反应化合反应CaO+2HCl=CaCl2+H2O复分解反应根据物质的组成和性质,通过化学变化可以实现物质之间的转化。C CO2 H2CO3 CaCO3非金属单质 酸性氧化物 酸 盐 Ca CaO Ca(OH)2 CaSO4金属单质 碱性氧化物 碱 盐① 2Ca+O2 = 2CaO② CaO+H2O = Ca(OH)2③ Ca(OH)2+SO3 =CaSO4↓+H2O④C+O2 = CO2⑤CO2+H2O = H2CO3⑥Ca(OH)2+H2CO3 = CaCO3↓+2H2O以Na元素与S元素尝试构建物质的转化关系。Na金属单质碱性氧化物碱盐O2H2O酸或 酸性氧化物Na2ONaOHNa2CO3S非金属单质酸性氧化物酸盐O2H2O SO2H2SO4MgSO4 SO3Na2O + H2O = 2NaOH2NaOH+CO2 = Na2CO3+H2OSO3 + H2O = H2SO4碱或 碱性氧化物4Na +O2 = 2Na2O2NaOH+MgSO4 = Na2SO4+ Mg(OH)2 ↓ Na2O + SO2 = Na2SO3Na2O + SO3 = Na2SO4Na2O +H2SO4 = Na2SO4 + H2O2NaOH+SO2 = Na2SO3+H2O2NaOH+H2SO4 = Na2SO4+2H2ONa2CO3+H2SO4 = Na2SO4+CO2 ↑+H2O2NaOH+MgSO4 = Na2SO4+ Mg(OH)2 ↓ 要制取氢氧化钠可以采用哪些方法?1.碱性氧化物与水反应Na2O + H2O ═ 2NaOH2.盐与另一种碱反应3.工业上制取氢氧化钠:Na2CO3 + Ca(OH)2 ═ CaCO3↓+ 2NaOHNa2O作为原料,来源少、成本高 电解饱和食盐水在工业生产中要制取某种物质,除了要考虑反应进行的可能性,还要考虑:①原料来源、②成本高低、③设备要求等因素,以选取最适当的方法。物质的转化酸的性质物质的转化及其应用物理变化和化学变化的判断方法有无新物质产生碱的性质盐的性质指示剂、金属、金属氧化物、碱、盐指示剂、酸性氧化物、酸、盐金属、酸、碱、盐金属单质、氧化物的性质物质的制备【例1】下列我国科技成果所涉及物质的应用中,发生的不是化学变化的是( )B【例2】下列变化中,属于物理变化的是________________________;属于化学变化的是______________________________________。①钠的焰色反应 ②碘的升华 ③氯化铵分解 ④CaCl2的潮解 ⑤冰的熔化 ⑥食物的缓慢氧化 ⑦同素异形体间的转化①②④⑤③⑥⑦【例3】某同学在奥运五连环中填入了5种物质(如图所示),相连环的物质间所发生的反应中,没有涉及的基本反应类型是( )A.分解反应 B.复分解反应C.化合反应 D.置换反应A【例4】能实现下列物质间直接转化的元素是( )单质 氧化物 酸或碱 盐 A.Fe B.Si C.Na D.CuC【变式训练4】在给定条件下,下列所示物质间转化合理的是( )A.Mg(OH)2 MgCl2(aq) MgCO3B.Cu CuSO4 Cu(NO3)2C.Na Na2O Na2CO3D.FeO FeCl3(aq) 无水FeCl3C【例5】图中“—”表示相连的物质间在一定条件下可以反应,“→”表示丁在一定条件下可以转化为乙。下面四组选项中,符合图示要求的是( )D【例6】氯化钙(CaCl2)的用途十分广泛。在工业生产中,氯化钙常被用作干燥剂,因其溶解放热可用于制作自加热罐头,它还是制作豆腐等美食的食品添加剂。请你设计尽可能多的方案制得氯化钙。并写出化学方程式。 方案1:盐+酸→另一种盐+另一种酸CaCO3+2HCl = CaCl2+CO2↑+H2O;方案2:碱性氧化物+酸→盐+水:CaCO3 CaO+CO2↑,CaO+2HCl = CaCl2+H2O;方案3:酸碱中和:Ca(OH)2+2HCl===CaCl2+2H2O谢谢观看THANKS
第一章 物质及其变化 第一节 物质的分类及转化 课时3 物质的转化 壹贰各种物质的性质物质的转化及应用本节重点本节难点如何对化学物质进行分类?建立科学的分类标准分类的优点是什么?便于对未知物质的研究分析通过对物质的分类,我们可以更好地认识某类物质的性质,以及不同类别物质之间的转化关系,进而利用物质的性质和物质之间的转化关系,制备人类生活和生产所需要的新物质。美丽的溶洞——自然界中物质的转化自然界中的溶洞景观,千奇百怪,引人入胜,在惊叹自然界美丽之余,你是否想过,如此坚硬的石头怎么会溶成一个大洞呢?石灰石的主要成分与溶有CO2的水发生了化学反应而被溶解:CaCO3+CO2+H2O=Ca(HCO3)2生成的Ca(HCO3)2在受热时又分解,Ca(HCO3)2 = CaCO3↓+CO2↑+H2O又沉降出CaCO3,如此一来就形成了溶洞景观美丽的化学——化学实验中物质的转化物理变化和化学变化的判断方法从宏观上判断有新物质生成是化学变化,反之为物理变化。从微观上判断有旧化学键断裂,同时有新化学键形成的是化学变化;只有化学键断裂的不一定是化学变化,如NaCl晶体的熔化。同类物质往往具有相似的性质。例如,通过初中化学的学习,我们已经知道盐酸、硫酸等酸,NaOH、Ca(OH)2等碱,Na2CO3、K2CO3等碳酸盐各具有相似的化学性质。酸盐酸硫酸碱NaOHCa(OH)2盐Na2CO3K2CO3(1)酸与指示剂的作用无色酚酞溶液遇酸不变色紫色石蕊试液遇酸变红(2)酸+金属→盐+氢气(3)酸+金属氧化物→盐+水Fe2O3+6HCl=2FeCl3+3H2OFe2O3+3H2SO4=Fe2(SO4)3+3H2O注:含有Fe3+的溶液显黄色除铁锈(4)酸+碱→盐+水中和酸性废液NaOH+HCl=NaCl+H2O2NaOH+H2SO4=Na2SO4+2H2O(5)酸+盐→新酸+新盐CaCO3+2HCl=CaCl2+H2O+CO2↑Na2CO3+2HCl=2NaCl+H2O+CO2↑Ba(NO3)2+H2SO4=BaSO4↓+2HNO3石灰石与盐酸的反应盐酸腐蚀含碳酸钙的建筑材料酸具有相似化学性质的原因:溶液中都含有H+与活泼金属反应与碱性氧化物反应与碱反应与某些盐反应使指示剂显色H2SO4 + Zn=ZnSO4+H2↑6HCl + Fe2O3 =2FeCl3+3H2OHCl + NaOH=NaCl+H2O2HCl+CaCO3=CaCl2+CO2↑+H2O使紫色石蕊变红色,无色酚酞不变色置换反应复分解反应复分解反应复分解反应碱具有相似化学性质的原因:溶液中都含有OH-与酸性氧化物反应与酸反应与某些盐反应使指示剂显色CO2 + 2NaOH=Na2CO3+H2OHCl + NaOH=NaCl + H2OCuSO4+2NaOH=Cu(OH)2↓+Na2SO4使紫色石蕊变蓝色,无色酚酞变红色复分解反应复分解反应复分解反应 酸 碱铵 盐钠 盐钙 盐铝 盐 硝 酸 盐 氯化物(盐酸盐) 硫 酸 盐 碳 酸 盐与较活泼金属反应与酸反应与碱反应与某些盐反应CuSO4+Fe=FeSO4+CuCaCO3+2HCl=CaCl2+H2O+CO2↑2NaOH+CuSO4=Cu(OH)2↓+Na2SO4BaCl2+CuSO4=CuCl2+BaSO4 ↓置换反应复分解反应复分解反应复分解反应(1)Fe与O2反应生成金属氧化物,方程式为 ,反应类型为 。(2)Fe与酸的反应生成盐和氢气,方程式为 ,反应类型为 。(3)Fe与盐的反应生成盐和金属,方程式为 ,反应类型为 。化合反应置换反应置换反应Fe+H2SO4 =FeSO4 + H2↑Fe+CuCl2 =FeCl2 + Cu金属O2酸(如H2SO4)盐(如CuCl2)Fe3O4FeSO4+H2FeCl2+CuCaO+H2O=Ca(OH)2(1) CO2与H2O反应生成含氧酸,方程式为 ,反应类型为 。(2) CO2与碱的反应生成盐和水,方程式为 ,反应类型为 。(3) CaO与水的反应生成碱,方程式为 ,反应类型为 。(4) CaO与酸的反应生成盐和水,方程式为 ,反应类型为 。CO2+H2O=H2CO3化合反应CO2+2NaOH=Na2CO3+H2O复分解反应化合反应CaO+2HCl=CaCl2+H2O复分解反应根据物质的组成和性质,通过化学变化可以实现物质之间的转化。C CO2 H2CO3 CaCO3非金属单质 酸性氧化物 酸 盐 Ca CaO Ca(OH)2 CaSO4金属单质 碱性氧化物 碱 盐① 2Ca+O2 = 2CaO② CaO+H2O = Ca(OH)2③ Ca(OH)2+SO3 =CaSO4↓+H2O④C+O2 = CO2⑤CO2+H2O = H2CO3⑥Ca(OH)2+H2CO3 = CaCO3↓+2H2O以Na元素与S元素尝试构建物质的转化关系。Na金属单质碱性氧化物碱盐O2H2O酸或 酸性氧化物Na2ONaOHNa2CO3S非金属单质酸性氧化物酸盐O2H2O SO2H2SO4MgSO4 SO3Na2O + H2O = 2NaOH2NaOH+CO2 = Na2CO3+H2OSO3 + H2O = H2SO4碱或 碱性氧化物4Na +O2 = 2Na2O2NaOH+MgSO4 = Na2SO4+ Mg(OH)2 ↓ Na2O + SO2 = Na2SO3Na2O + SO3 = Na2SO4Na2O +H2SO4 = Na2SO4 + H2O2NaOH+SO2 = Na2SO3+H2O2NaOH+H2SO4 = Na2SO4+2H2ONa2CO3+H2SO4 = Na2SO4+CO2 ↑+H2O2NaOH+MgSO4 = Na2SO4+ Mg(OH)2 ↓ 要制取氢氧化钠可以采用哪些方法?1.碱性氧化物与水反应Na2O + H2O ═ 2NaOH2.盐与另一种碱反应3.工业上制取氢氧化钠:Na2CO3 + Ca(OH)2 ═ CaCO3↓+ 2NaOHNa2O作为原料,来源少、成本高 电解饱和食盐水在工业生产中要制取某种物质,除了要考虑反应进行的可能性,还要考虑:①原料来源、②成本高低、③设备要求等因素,以选取最适当的方法。物质的转化酸的性质物质的转化及其应用物理变化和化学变化的判断方法有无新物质产生碱的性质盐的性质指示剂、金属、金属氧化物、碱、盐指示剂、酸性氧化物、酸、盐金属、酸、碱、盐金属单质、氧化物的性质物质的制备【例1】下列我国科技成果所涉及物质的应用中,发生的不是化学变化的是( )B【例2】下列变化中,属于物理变化的是________________________;属于化学变化的是______________________________________。①钠的焰色反应 ②碘的升华 ③氯化铵分解 ④CaCl2的潮解 ⑤冰的熔化 ⑥食物的缓慢氧化 ⑦同素异形体间的转化①②④⑤③⑥⑦【例3】某同学在奥运五连环中填入了5种物质(如图所示),相连环的物质间所发生的反应中,没有涉及的基本反应类型是( )A.分解反应 B.复分解反应C.化合反应 D.置换反应A【例4】能实现下列物质间直接转化的元素是( )单质 氧化物 酸或碱 盐 A.Fe B.Si C.Na D.CuC【变式训练4】在给定条件下,下列所示物质间转化合理的是( )A.Mg(OH)2 MgCl2(aq) MgCO3B.Cu CuSO4 Cu(NO3)2C.Na Na2O Na2CO3D.FeO FeCl3(aq) 无水FeCl3C【例5】图中“—”表示相连的物质间在一定条件下可以反应,“→”表示丁在一定条件下可以转化为乙。下面四组选项中,符合图示要求的是( )D【例6】氯化钙(CaCl2)的用途十分广泛。在工业生产中,氯化钙常被用作干燥剂,因其溶解放热可用于制作自加热罐头,它还是制作豆腐等美食的食品添加剂。请你设计尽可能多的方案制得氯化钙。并写出化学方程式。 方案1:盐+酸→另一种盐+另一种酸CaCO3+2HCl = CaCl2+CO2↑+H2O;方案2:碱性氧化物+酸→盐+水:CaCO3 CaO+CO2↑,CaO+2HCl = CaCl2+H2O;方案3:酸碱中和:Ca(OH)2+2HCl===CaCl2+2H2O谢谢观看THANKS
相关资料
更多









