



- 【同步课件】2.2 .2 氯气的实验室制法和氯离子的检验 高一化学同步备课(人教版2019必修第一册) 课件 6 次下载
- 【分层练习】2.2 .2 氯气的实验室制法和氯离子的检验高一化学同步备课(人教版2019必修第一册)(原卷版+解析版) 试卷 4 次下载
- 【分层练习】2.2 .4物质的量在化学方程式计算中的应用高一化学同步备课(人教版2019必修第一册)(原卷版+解析版) 试卷 5 次下载
- 【分层练习】2.3 .1 物质的量的单位——摩尔高一化学同步备课(人教版2019必修第一册)(原卷版+解析版) 试卷 7 次下载
- 【同步课件】2.3 .2 气体摩尔体积高一化学同步备课(人教版2019必修第一册) 课件 6 次下载
化学必修 第一册第三节 物质的量评优课备课课件ppt
展开化学方程式中化学计量数与相关物理量的关系
物质的量应用于化学方程式计算的基本步骤
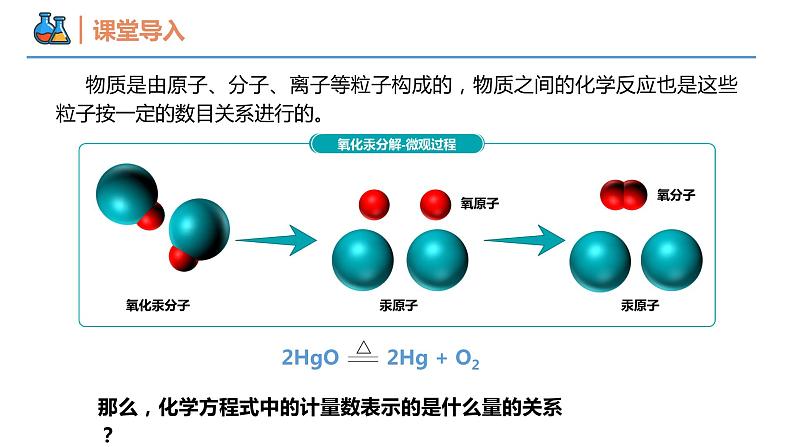
物质是由原子、分子、离子等粒子构成的,物质之间的化学反应也是这些粒子按一定的数目关系进行的。
那么,化学方程式中的计量数表示的是什么量的关系?
2HgO 2Hg + O2
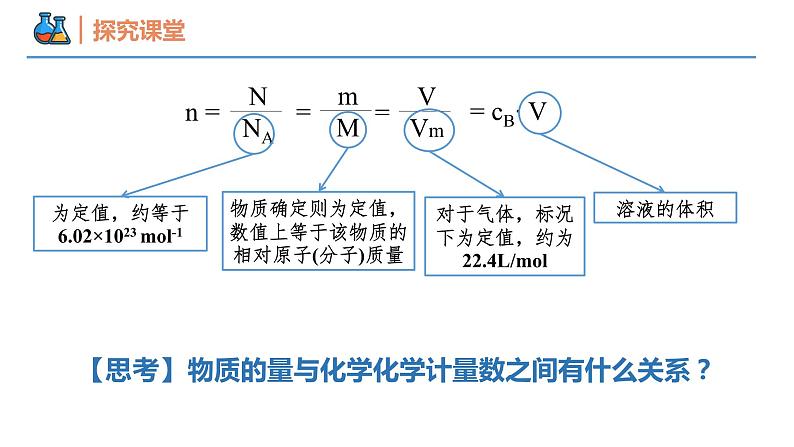
【思考】物质的量与化学化学计量数之间有什么关系?
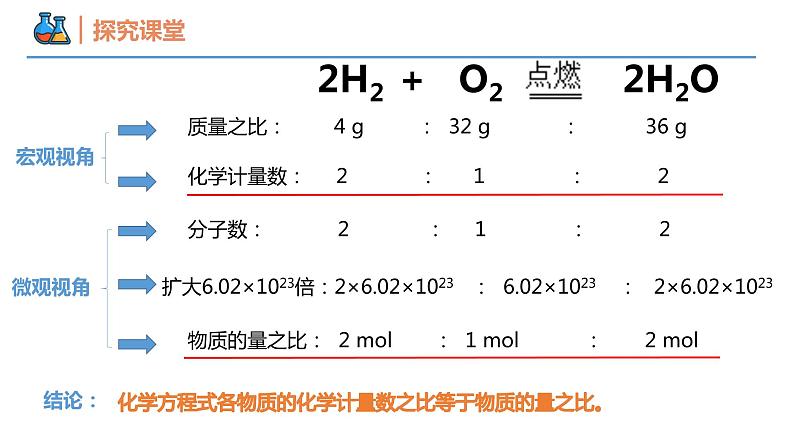
化学计量数: 2 : 1 : 2
分子数: 2 : 1 : 2
物质的量之比: 2 ml : 1 ml : 2 ml
扩大6.02×1023倍:2×6.02×1023 : 6.02×1023 : 2×6.02×1023
化学方程式各物质的化学计量数之比等于物质的量之比。
质量之比: 4 g : 32 g : 36 g
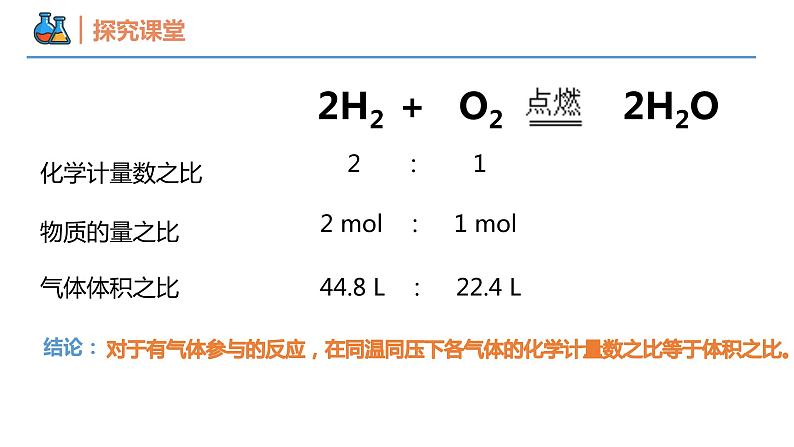
2H2 + O2 2H2O
2 : 1
2 ml : 1 ml
44.8 L : 22.4 L
对于有气体参与的反应,在同温同压下各气体的化学计量数之比等于体积之比。
1 1
n(Fe) 0.5 ml
n(H2SO4)=cV液 =2 ml/L×0.25 L = 0.5 ml
答:参与反应铁屑的物质的量为0.5 ml
反应方程式:Fe + H2SO4 =FeSO4 + H2↑
1 n(Fe)1 0.5 ml
【例题】250 mL 2 ml/L的硫酸与足量的铁屑完全反应。计算:(1)参加反应的铁屑的物质的量;(2)生成H2的体积(标准状况)。
计算出参加反应的H2SO4的物质的量:
n(Fe)=0.5 ml
【例1】250 mL 2 ml/L的硫酸与足量的铁屑完全反应。计算:(1)参加反应的铁屑的物质的量;(2)生成H2的体积(标准状况)。
1 1
n(H2)= 0.5 ml
0.5 ml n(H2)
1 0.5 ml 1 n(H2)
= 0.5 ml×22.4 L/ml
答:生成H2的体积在标准状况下是11.2 L。
【例2】医疗上颇为流行的“理疗特效热”,就是利用铁粉缓慢氧化成Fe2O3,并放出均匀、稳定的热,使患处保持温热状态。若56 g铁粉完全氧化成Fe2O3,则需要消耗标况下氧气的体积为多少?(相对原子质量 Fe:56)
答:需要消耗标况下氧气的体积为16.8 L。
4Fe + 3O2 = 2Fe2O3
4 3
1 ml
根据题意可得:n(Fe)=56 g÷56 g/ml = 1 ml
根据比例可得n(O2)=0.75 ml
标况下:V(O2)=0.75 ml×22.4 L/ml=16.8 L
方法一:守恒法——质量守恒、电荷守恒、电子守恒
反应前后元素种类、质量、原子个数不变
还原剂失电子总数=氧化剂得电子总数
【练1】4.6 g钠在空气中久置,最终得到Na2CO3的质量是 g。
解:钠在空气中最终转化为Na2CO3的过程中钠的原子个数不变,可得关系式: 2Na ~ Na2CO3 2×23 106 4.6 g m(Na2CO3)
方法二:差量法——质量差值法、体积差值法
根据化学反应前后物质的有关物理量发生的变化,找出所谓的“理论差量”,
如反应前后的质量差、物质的量差、气体体积差等,该差量与反应物的有关量成正比。
差量法就是借助这种比例关系求解的方法。
【练2】把铁棒插入CuSO4溶液,一段时间后取出,铁棒质量增加了4 g,参加反应的Fe的质量为 。
解:Fe+CuSO4=FeSO4+Cu 56 g 64 g
64 g-56 g=8 g
方法三:关系式法——解答连续反应类型计算题的捷径
当已知量和未知量之间是靠多个反应来联系时,只需直接确定已知量和未知量之间的比例关系,即“关系式”。
【练3】用足量的CO还原Fe2O3,将所生成的气体通入足量澄清石灰水中,得到的沉淀为60 g,则Fe2O3的质量是( )A.16 g B.32 g C.64 g D.80 g
参考:相对原子质量Fe:56 O:16 C:12 Ca:40
3CO2+3Ca(OH)2=3CaCO3↓+3H2O
则关系式为:3CO~3CO2~3CaCO3
n(CaCO3)=60 g÷100 g/ml=0.6 ml
根据比例式可得:n(CO) =0.6 ml
3 3
n(CO) n(CaCO3)
根据方程式得到关系式:3CO ~ Fe2O3
3 1
根据比例式可得:n(Fe2O3)=0.2 ml
m(Fe2O3)=0.2 ml×160 g/ml=32 g
方法四:方程组法——两个已知量求解混合物中两种物质的未知量
一般方程组法用于解决两种物质的混合物计算,一般读题时能找到两个已知量时,均可以利用二元一次方程组进行求算未知量。
【练4】把5.1g 镁铝合金的粉末放入过量的盐酸中,得到5.6LH2(标准状况)。试计算:(1)该合金中铝和镁的物质的量之比;(2)该合金中铝的质量分数。
设合金中镁的物质的量为x,铝的物质的量为y。
M(Mg)= 24 g/ml
M(Al)= 27g/ml
x·24 g/ml +y·24g/ml= 5.1g
Mg +2HCl=MgCl 2 + H2↑
2Al +6HCl=2AlCl 3 +3H2↑
n(H2)=5.6L÷22.4L/ml=0.25ml
解得:x=y=0.1ml
m(Mg)= 0.1ml×24 g/ml=2.4g
m(Al)= 0.1ml×27 g/ml=2.7g
n(Al):n(Mg)=1:1
1、实验室中所用少量氯气是用MnO2和浓盐酸制取的,用浓盐酸200ml,其密度为1.19g·cm-3,HCl的质量分数为36.5%,跟MnO2恰好完全反应,产生了11.2L(标况)的氯气。试计算:① 浓盐酸的物质的量浓度?______________② 求参加反应的HCl的物质的量?____________③ 被氧化的HCl的质量?___________
2、向500 mL NaOH溶液中投入10.8 g Al,二者恰好完全反应,试计算:(1) Al的物质的量;
答:Al的摩尔质量是27 g·ml-1,
2、向500 mL NaOH溶液中投入10.8 g Al,二者恰好完全反应,试计算:
(2) 参加反应的NaOH的物质的量和溶液中NaOH的物质的量浓度;
答:设参加反应的NaOH物质的量是n。 2Al + 2NaOH+2H2O=2NaAlO2+3H2↑ 2 2 0.4 ml n
(3) 在标准状况下生成H2的体积;
答:设在标准状况下生成H2的体积是V。2Al+2NaOH+2H2O=2NaAlO2+3H2↑2 ml 3×22.4 L0.4 ml V
高中化学人教版 (2019)必修 第一册第三节 物质的量课堂教学ppt课件: 这是一份高中化学人教版 (2019)必修 第一册<a href="/hx/tb_c161983_t3/?tag_id=26" target="_blank">第三节 物质的量课堂教学ppt课件</a>,共24页。PPT课件主要包含了cB∙V,化学计量数之比,物质的量之比,气体体积之比,mFe,9molL,mol等内容,欢迎下载使用。
人教版 (2019)必修 第一册第二章 海水中的重要元素——钠和氯第三节 物质的量精品备课课件ppt: 这是一份人教版 (2019)必修 第一册<a href="/hx/tb_c161983_t3/?tag_id=26" target="_blank">第二章 海水中的重要元素——钠和氯第三节 物质的量精品备课课件ppt</a>,共28页。PPT课件主要包含了溶解固体法,稀释浓溶液法,误差分析,本节重点,本节难点,1mol,85g,容量瓶使用注意事项,托盘天平,玻璃棒等内容,欢迎下载使用。
高中化学人教版 (2019)必修 第一册第三节 物质的量精品ppt课件: 这是一份高中化学人教版 (2019)必修 第一册<a href="/hx/tb_c161983_t3/?tag_id=26" target="_blank">第三节 物质的量精品ppt课件</a>,共20页。PPT课件主要包含了考纲要求等内容,欢迎下载使用。














