




还剩21页未读,
继续阅读
成套系列资料,整套一键下载
【同步课件】2.1 .1 活泼的金属单质——钠高一化学同步备课(人教版2019必修第一册)
展开
这是一份第二章第一节 第一课时 活泼的金属单质——钠(同步课件)-2024-2025学年高一化学同步备课(人教版2019必修第一册),共29页。
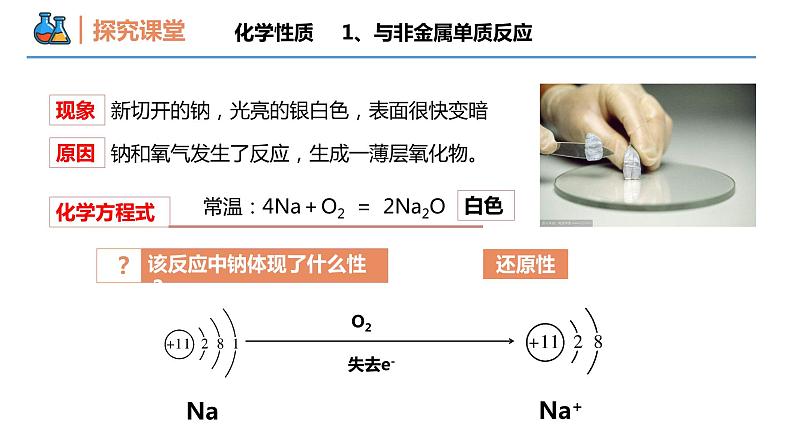
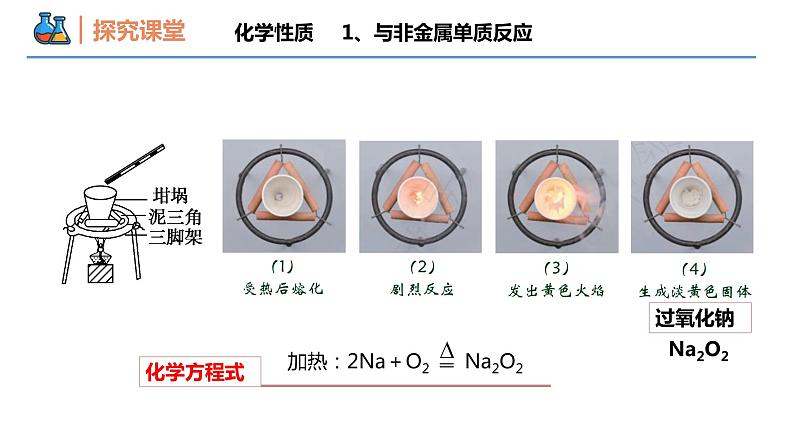
第二章 海水中的重要元素——钠和氯 第一节 钠及其化合物 课时1 活泼的金属单质——钠 壹贰叁钠的物理性质钠的化学性质钠的用途本节重难点思考:钠元素在自然界中都以 的形式存在(游离态?化合态?)化合态钠单质是什么样子呢?有什么性质??为什么钠遇水易爆炸 ??物理性质① 颜色: 、有 光泽。② 密度:钠 煤油;钠 水;③ 硬度:质地 ,可以用小刀切割。④ 熔点: (填“大于”“小于”或“等于”)100 ℃。大于银白色金属较软化学性质1、与非金属单质反应NaNa+O2失去e-还原性钠和氧气发生了反应,生成一薄层氧化物。新切开的钠,光亮的银白色,表面很快变暗现象原因化学方程式常温:4Na+O2 = 2Na2O 白色该反应中钠体现了什么性??如果在空气中加热,钠又会发生什么变化呢?化学性质1、与非金属单质反应化学性质(2)剧烈反应(1)受热后熔化(4)生成淡黄色固体(3)发出黄色火焰化学方程式过氧化钠Na2O2 1、与非金属单质反应化学性质【对比分析】钠与氧气在不同条件下的反应:银白色小球变暗淡黄色黄色4Na+O2=2Na2O钠与O2反应,条件不同,现象不同,产物也不同2Na+O2 Na2O2 1、与非金属单质反应钠作为一种还原性物质,除O2外,还能和其他非金属单质反应吗?已知:钠在氯气中剧烈燃烧,产生白色的烟;钠与硫粉混合研磨时燃烧,火星四射,发生爆炸。【练习】钠与氯气、单质硫的化学方程式2Na+S = Na2S化学性质1、与非金属单质反应【例1】钠与氧气反应的特点 等质量的两块钠,第一块在加热条件下与足量氧气充分反应,第二块在常温下与足量氧气充分反应。则下列说法正确的是( ) A. 第一块钠失去电子数多 B. 两块钠失去电子数相同 C. 两块钠的反应产物的颜色相同 D. 两块钠所得反应产物的质量相等B1、与非金属单质反应化学性质化学性质2、与水反应【问题解决】为什么钠遇水易爆炸?钠与水发生了什么样的反应?【预测】从物质组成及氧化还原反应的角度,预测钠与水反应的生成物。Na+H2水中只有H化合价能降低NaH2OH+在反应中,钠失去电子,化合价升高,还原剂被氧化。OH−化学性质2、与水反应浮在水面上熔化成小球在水面四处游动发出嘶嘶的响声溶液成红色密度比水小熔点低反应剧烈有气体生成有碱性物质生成 浮 熔 游 响 红H2NaOH物理性质2Na+2H2O =2NaOH+H2↑化学方程式化学性质2、与水反应【思考2】钠能否保存在水里面?不能,钠常常保存在石蜡油或煤油中。【思考3】上述反应用后剩余的钠应该怎么处理呢?丢到垃圾桶?放回原试剂瓶?放到废弃药品试剂瓶?√【思考1】取钠时能否不用镊子,直接用手?不能化学性质2、与水反应【思考4】钠着火时能否用水灭火?假如你是事故现场工作人员,你会怎么灭火?化学性质2、与水反应不能用水,钠与H2O反应生成可燃性气体H2,易燃烧和爆炸。需用干燥的沙土或干粉灭火器灭火。化学性质2、与水反应【例2】钠的密度 将一块钠投入盛有煤油和水的烧杯中,观察到的现象可能是( ) A.钠在水层中反应并四处游动B.钠停留在煤油层中不发生反应C.钠在煤油中反应并四处游动D.钠在煤油与水的界面处反应并可能上下跳动D化学性质2、与水反应【例3】钠与水的反应 将一小块金属钠投入滴有紫色石蕊溶液的盛冷水的烧杯中,甲同学认为可以观察到下列实验现象,其中正确的有( )① 钠投入水中,先沉入水底,后浮出水面 ② 钠立即与水反应,并有气体产生 ③ 反应后溶液变红色 ④ 钠熔化成光亮的小球 ⑤ 小球在水面上迅速游动 ⑥ 有“嘶嘶”的响声发出 A. ①②③④ B. ②③④⑤ C. ②④⑤⑥ D. ③④⑥C【变式3】某化学研究性学习小组设计了如图所示的实验装置,目的是做钠与水反应的实验并验证钠的物理性质。请回答下列问题:(1)实验开始时,欲使钠与水接触发生反应,应如何操作?__________________________。(2)反应开始后,试管中能观察到的实验现象是_________(填标号)。A.钠在水层中反应,熔成小球并四处游动B.钠在两液体界面处反应,熔成小球并上下跳动C.钠块不断减小直至消失D.钠停留在煤油层中不反应E.煤油中有气泡产生(3)通过上述现象,能够验证钠的哪些物理性质?__________________________________。化学性质2、与水反应拔出大头针,使大头针下端的钠落入试管内的水中BCE钠的熔点低,钠的密度比水小,但比煤油大化学性质3、与盐溶液反应金属+盐溶液可以反应,钠和盐溶液(CuSO4)反应会生成Cu单质吗?化学性质3、与盐溶液反应钠与盐溶液反应的实质是钠先与水反应,生成H2和NaOH,NaOH 再与盐溶液中的盐发生复分解反应离子方程式:2Na + CuSO4 = Cu +Na2SO4① 2Na+2H2O = 2Na++2OH-+H2↑② Cu2++2OH-= Cu(OH)2↓?描述现象浮、熔、游、蓝色絮状沉淀化学性质3、与盐溶液反应【例4】钠与盐溶液的反应 将少量金属钠分别投人下列物质的水溶液中,既有气体又有沉淀产生的是( ) A. BaCl2溶液 B. K2SO4溶液 C. FeCl3溶液 D. NH4NO3溶液 C【例5】下列反应的离子方程式书写正确的是( )A.氧化钠与盐酸反应 O2-+2H+=H2OB.钠与CuSO4溶液反应 2Na+Cu2+=2Na++CuC.钠与水反应 2Na+2H2O = 2Na++ 2OH-+H2↑D.碳酸氢钠与稀硫酸反应:CO32- +2H+=CO2↑+H2OC4Na+O2 = 2Na2ONa2O+H2O = 2NaOHNa2CO3·10H2O = Na2CO3+10H2O2NaOH+CO2+9H2O = Na2CO3·10H2O钠在空气中的变化过程【例6】将一小块金属钠久置于空气中,有下列现象,这些现象的先后顺序是__________________________ ①生成白色粉末 ②变暗 ③生成白色固体 ④发生潮解②③④①【变式6】将一块银白色的金属钠放在空气中会发生一系列的变化:表面迅速变暗→ “出汗” → 变成白色固体(粉末),下列有关叙述错误的是( )A.表面迅速变暗是因为钠与空气中的氧气反应生成了氧化钠B.“出汗”是因为生成的氢氧化钠吸收空气中的水蒸气在表面形成了溶液C.最后变成碳酸钠粉末D.该过程中的所有化学反应均为氧化还原反应D钠的用途(1)作还原剂来制取活泼金属; (2)制作高压钠灯;(3)制钠钾合金,用于原子反应堆导热剂。钠在高温下能将TiCl4中的Ti置换出来钠具有强还原性易与O2反应—Na2ONa2O2与冷水反应剧烈浮、熔、游、响、红2Na+2H2O=2NaOH+H2↑—不能置换出盐溶液中的金属2Na+2H2O+Cu2+= 2Na++H2↑+Cu(OH)2↓—谢谢观看THANKS
第二章 海水中的重要元素——钠和氯 第一节 钠及其化合物 课时1 活泼的金属单质——钠 壹贰叁钠的物理性质钠的化学性质钠的用途本节重难点思考:钠元素在自然界中都以 的形式存在(游离态?化合态?)化合态钠单质是什么样子呢?有什么性质??为什么钠遇水易爆炸 ??物理性质① 颜色: 、有 光泽。② 密度:钠 煤油;钠 水;③ 硬度:质地 ,可以用小刀切割。④ 熔点: (填“大于”“小于”或“等于”)100 ℃。大于银白色金属较软化学性质1、与非金属单质反应NaNa+O2失去e-还原性钠和氧气发生了反应,生成一薄层氧化物。新切开的钠,光亮的银白色,表面很快变暗现象原因化学方程式常温:4Na+O2 = 2Na2O 白色该反应中钠体现了什么性??如果在空气中加热,钠又会发生什么变化呢?化学性质1、与非金属单质反应化学性质(2)剧烈反应(1)受热后熔化(4)生成淡黄色固体(3)发出黄色火焰化学方程式过氧化钠Na2O2 1、与非金属单质反应化学性质【对比分析】钠与氧气在不同条件下的反应:银白色小球变暗淡黄色黄色4Na+O2=2Na2O钠与O2反应,条件不同,现象不同,产物也不同2Na+O2 Na2O2 1、与非金属单质反应钠作为一种还原性物质,除O2外,还能和其他非金属单质反应吗?已知:钠在氯气中剧烈燃烧,产生白色的烟;钠与硫粉混合研磨时燃烧,火星四射,发生爆炸。【练习】钠与氯气、单质硫的化学方程式2Na+S = Na2S化学性质1、与非金属单质反应【例1】钠与氧气反应的特点 等质量的两块钠,第一块在加热条件下与足量氧气充分反应,第二块在常温下与足量氧气充分反应。则下列说法正确的是( ) A. 第一块钠失去电子数多 B. 两块钠失去电子数相同 C. 两块钠的反应产物的颜色相同 D. 两块钠所得反应产物的质量相等B1、与非金属单质反应化学性质化学性质2、与水反应【问题解决】为什么钠遇水易爆炸?钠与水发生了什么样的反应?【预测】从物质组成及氧化还原反应的角度,预测钠与水反应的生成物。Na+H2水中只有H化合价能降低NaH2OH+在反应中,钠失去电子,化合价升高,还原剂被氧化。OH−化学性质2、与水反应浮在水面上熔化成小球在水面四处游动发出嘶嘶的响声溶液成红色密度比水小熔点低反应剧烈有气体生成有碱性物质生成 浮 熔 游 响 红H2NaOH物理性质2Na+2H2O =2NaOH+H2↑化学方程式化学性质2、与水反应【思考2】钠能否保存在水里面?不能,钠常常保存在石蜡油或煤油中。【思考3】上述反应用后剩余的钠应该怎么处理呢?丢到垃圾桶?放回原试剂瓶?放到废弃药品试剂瓶?√【思考1】取钠时能否不用镊子,直接用手?不能化学性质2、与水反应【思考4】钠着火时能否用水灭火?假如你是事故现场工作人员,你会怎么灭火?化学性质2、与水反应不能用水,钠与H2O反应生成可燃性气体H2,易燃烧和爆炸。需用干燥的沙土或干粉灭火器灭火。化学性质2、与水反应【例2】钠的密度 将一块钠投入盛有煤油和水的烧杯中,观察到的现象可能是( ) A.钠在水层中反应并四处游动B.钠停留在煤油层中不发生反应C.钠在煤油中反应并四处游动D.钠在煤油与水的界面处反应并可能上下跳动D化学性质2、与水反应【例3】钠与水的反应 将一小块金属钠投入滴有紫色石蕊溶液的盛冷水的烧杯中,甲同学认为可以观察到下列实验现象,其中正确的有( )① 钠投入水中,先沉入水底,后浮出水面 ② 钠立即与水反应,并有气体产生 ③ 反应后溶液变红色 ④ 钠熔化成光亮的小球 ⑤ 小球在水面上迅速游动 ⑥ 有“嘶嘶”的响声发出 A. ①②③④ B. ②③④⑤ C. ②④⑤⑥ D. ③④⑥C【变式3】某化学研究性学习小组设计了如图所示的实验装置,目的是做钠与水反应的实验并验证钠的物理性质。请回答下列问题:(1)实验开始时,欲使钠与水接触发生反应,应如何操作?__________________________。(2)反应开始后,试管中能观察到的实验现象是_________(填标号)。A.钠在水层中反应,熔成小球并四处游动B.钠在两液体界面处反应,熔成小球并上下跳动C.钠块不断减小直至消失D.钠停留在煤油层中不反应E.煤油中有气泡产生(3)通过上述现象,能够验证钠的哪些物理性质?__________________________________。化学性质2、与水反应拔出大头针,使大头针下端的钠落入试管内的水中BCE钠的熔点低,钠的密度比水小,但比煤油大化学性质3、与盐溶液反应金属+盐溶液可以反应,钠和盐溶液(CuSO4)反应会生成Cu单质吗?化学性质3、与盐溶液反应钠与盐溶液反应的实质是钠先与水反应,生成H2和NaOH,NaOH 再与盐溶液中的盐发生复分解反应离子方程式:2Na + CuSO4 = Cu +Na2SO4① 2Na+2H2O = 2Na++2OH-+H2↑② Cu2++2OH-= Cu(OH)2↓?描述现象浮、熔、游、蓝色絮状沉淀化学性质3、与盐溶液反应【例4】钠与盐溶液的反应 将少量金属钠分别投人下列物质的水溶液中,既有气体又有沉淀产生的是( ) A. BaCl2溶液 B. K2SO4溶液 C. FeCl3溶液 D. NH4NO3溶液 C【例5】下列反应的离子方程式书写正确的是( )A.氧化钠与盐酸反应 O2-+2H+=H2OB.钠与CuSO4溶液反应 2Na+Cu2+=2Na++CuC.钠与水反应 2Na+2H2O = 2Na++ 2OH-+H2↑D.碳酸氢钠与稀硫酸反应:CO32- +2H+=CO2↑+H2OC4Na+O2 = 2Na2ONa2O+H2O = 2NaOHNa2CO3·10H2O = Na2CO3+10H2O2NaOH+CO2+9H2O = Na2CO3·10H2O钠在空气中的变化过程【例6】将一小块金属钠久置于空气中,有下列现象,这些现象的先后顺序是__________________________ ①生成白色粉末 ②变暗 ③生成白色固体 ④发生潮解②③④①【变式6】将一块银白色的金属钠放在空气中会发生一系列的变化:表面迅速变暗→ “出汗” → 变成白色固体(粉末),下列有关叙述错误的是( )A.表面迅速变暗是因为钠与空气中的氧气反应生成了氧化钠B.“出汗”是因为生成的氢氧化钠吸收空气中的水蒸气在表面形成了溶液C.最后变成碳酸钠粉末D.该过程中的所有化学反应均为氧化还原反应D钠的用途(1)作还原剂来制取活泼金属; (2)制作高压钠灯;(3)制钠钾合金,用于原子反应堆导热剂。钠在高温下能将TiCl4中的Ti置换出来钠具有强还原性易与O2反应—Na2ONa2O2与冷水反应剧烈浮、熔、游、响、红2Na+2H2O=2NaOH+H2↑—不能置换出盐溶液中的金属2Na+2H2O+Cu2+= 2Na++H2↑+Cu(OH)2↓—谢谢观看THANKS
相关资料
更多










