





还剩26页未读,
继续阅读
成套系列资料,整套一键下载
- 【同步课件】2.1 .3+钠盐、焰色试验高一化学同步备课(人教版2019必修第一册) 课件 7 次下载
- 【分层练习】2.1 .3 钠盐、焰色试验高一化学同步备课(人教版2019必修第一册)(原卷版+解析版) 试卷 4 次下载
- 【分层练习】2.2 .1 氯气的性质高一化学同步备课(人教版2019必修第一册)(原卷版+解析版) 试卷 4 次下载
- 【同步课件】2.2 .2 氯气的实验室制法和氯离子的检验 高一化学同步备课(人教版2019必修第一册) 课件 6 次下载
- 【分层练习】2.2 .2 氯气的实验室制法和氯离子的检验高一化学同步备课(人教版2019必修第一册)(原卷版+解析版) 试卷 4 次下载
【同步课件】2.2 .1+氯气的性质+高一化学同步备课(人教版2019必修第一册)
展开
这是一份第二章第二节 第一课时+氯气的性质+(同步课件)-2024-2025学年高一化学同步备课(人教版2019必修第一册),共34页。
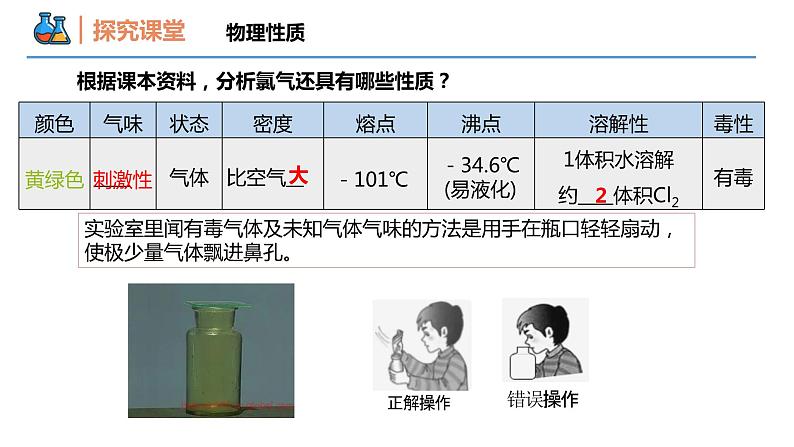
第二节 氯及其化合物 课时1 氯气的性质 第二章 海水中的重要元素——钠和氯 壹贰氯气的物理性质氯气的化学性质本节重难点 一战期间,德军在比利时的伊普尔战役中首次大规模使用氯气。面对扑面而来的黄绿色刺鼻气体,英法守军迅速崩溃,部分士兵用湿毛巾捂住嘴巴,甚至有的士兵用自己尿液浸湿的毛巾捂住嘴巴,他们逃往地势更高的地方,幸免遇难。 思考? 1. 为什么氯气可以作为化学武器?2. 为什么士兵要逃往地势更高的地方?3. 为什么湿毛巾在一定程度上可以防止氯气中毒?物理性质黄绿色刺激性大2根据课本资料,分析氯气还具有哪些性质?-101℃-34.6℃(易液化)实验室里闻有毒气体及未知气体气味的方法是用手在瓶口轻轻扇动,使极少量气体飘进鼻孔。从氯气的发现到氯被确认为一种新的元素,时间长达三十多年,其间经历了数位科学家的不懈探索。你从这一史实中得到什么启示?原子结构和存在1. Cl原子结构示意图为______________,容易__________1个电子而形成Cl-,表现出较强的__________。2. 氯在自然界中均以__________态存在。得到氧化性化合化学性质1. 与金属单质Na的反应:Cl2能与绝大多数金属反应,并且能将变价金属氧化到最高价。现象:剧烈燃烧,火焰黄色,产生大量白烟。化学方程式:2Na+Cl2 2NaCl1. 与金属单质Fe的反应:Cl2能与绝大多数金属反应,并且能将变价金属氧化到最高价。化学性质现象:红热的铁与氯气剧烈反应,产生大量棕红色烟,加水溶解后,溶液呈棕黄色化学方程式:2Fe+3Cl2 2FeCl3化学性质氯气易液化,工业上常保存于钢瓶。化学性质1. 与金属单质Cu的反应:Cl2能与绝大多数金属反应,并且能将变价金属氧化到最高价。现象:红热的铜与氯气剧烈反应, 产生大量棕黄色烟,加少量水溶解后,溶液呈绿色;加大量水溶液呈蓝色化学方程式:Cu+Cl2 CuCl2化学性质2. 与非金属单质H2的反应现象:纯净的H2在Cl2中安静地燃烧,发出苍白色火焰,瓶口有白雾产生。化学方程式:H2+Cl2 2HCl盐酸小液滴化学性质2. 与非金属单质H2的反应现象:H2、Cl2的混合气体强光照射,发生爆炸化学方程式:燃烧一定要有氧气参加吗?燃烧不一定要有氧气参加,物质并不是只有在氧气中才可以燃烧。燃烧的本质是氧化还原反应,所有发光发热的剧烈的化学反应都称为燃烧。【例1】下列各化合物不能由单质直接化合制取的是( ) A. FeCl3 B. CuCl2 C. AlCl3 D. FeCl2D【变式1】下列说法正确的是( )A. 燃烧是发光发热的剧烈的化学反应,必须有氧气参与B. 铁丝在少量的Cl2中燃烧可生成FeCl2C. 纯净的H2在Cl2中安静地燃烧,发出苍白色火焰D. Cu在Cl2中燃烧产生棕黄色的烟,若反应后,向集气瓶中加少量水振荡,可得到棕黄色溶液C化学性质3. 与水的反应真实情景:生活中,有时我们打开自来水龙头时,能闻到刺鼻的气味。是因为水中溶有氯气,用于杀菌消毒。Cl2+H2O=HCl+HClO次氯酸具有强氧化性,能杀菌、消毒。次氯酸氯气溶于水为何有杀菌、消毒作用?新制氯水能杀菌、消毒,是因为氯气与H2O反应,反应的化学方程式是: , 氯气对自来水消毒时,氯气会与水中的有机物反应,生成的有机氯化物可能对人体有害。 因此,人们已开始研究新的自来水消毒剂,如二氧化氯(ClO2)、臭氧等。你能得到什么启示?使用氯气对自来水消毒,对人体有危害吗?化学性质干燥的氯气是否具有漂白性化学性质氯水的漂白性Cl2可使湿润的有色布条褪色,不能使干燥的有色布条褪色。说明Cl2没有漂白性,而是HClO起漂白作用。结论化学性质 (次氯酸)① 不稳定(光照易分解产生气体):次氯酸分解反应的化学方程式为__________________________________ ② 强氧化性:ⅰ. 能将有色物质氧化为无色物质,作 ________________ ⅱ. 杀菌、消毒。③ 弱酸性:和氢氧化钠反应的化学方程式为____________________________________漂白剂HClO + NaOH = NaClO + H2O2HClO 2HCl+O2↑氯水的成分和性质1. 氯水的成分Cl2+H2O=HCl+HClOHCl是强电解质,H2O和HClO都是弱电解质H2O H++OH- HClO H++ClO-HCl = H++ Cl-氯水的成分和性质2. 氯水的性质新制氯水的多种成分决定了它具有多重性质,在不同的化学反应中,氯水中参与反应的微粒不同。浅黄绿色3. 液氯、新制氯水、久置氯水的比较氯水的成分和性质【例2】下列关于氯水的叙述中,正确的是( ) A、新制氯水中既有分子,又有离子 B、新制氯水在光照的条件下,可以产生气体,该气体是氯气 C、新制氯水中滴加硝酸银溶液,没有任何现象 D、新制氯水不可以使干燥的布条褪色A【变式2-1】下列说法中错误的是 ( ) A. 无论新制还是久置的氯水,滴加AgNO3溶液均生成白色沉淀 B. 氯水呈黄绿色,说明氯水中含有Cl2 C. 向氯水中加入NaHCO3粉末,有气泡产生,说明氯水中含有H+ D. 向新制氯水中滴加少量紫色石蕊溶液,充分振荡后溶液呈红色D【变式2-2】某同学在一pH试纸上滴几滴新制的氯水,现象如图所示,下列有关该实验的说法正确的是( )A. 该实验说明Cl2分子具有漂白性B. 该实验说明H+扩散速度比HClO分子快C. 将实验后的pH试纸在酒精灯上微热,试纸又恢复为原来的颜色D. 若用久置的氯水进行实验,现象相同B化学性质4. 与碱的反应(1) 与氢氧化钠溶液反应——制取漂白液①制取反应的化学方程式: 。②离子方程式: 。③漂白液的有效成分是 。Cl2+2NaOH=NaCl+NaClO+H2OCl2+2OH-=Cl-+ClO-+H2O次氯酸钠 人们直接用氯水作漂白剂,但因氯气的溶解度不大,而且生成的HClO不稳定,难以保存,使用起来不方便。化学性质4. 与碱的反应 人们直接用氯水作漂白剂,但因氯气的溶解度不大,而且生成的HClO不稳定,难以保存,使用起来不方便。(2) 与冷的石灰乳反应——制取漂白粉① 制取反应的化学方程式:_____________________________________________② 漂白粉的主要成分是_______________________,有效成分是___________,漂粉精的主要成分是_____________(3) 漂白液、漂白粉和漂粉精既可作 又可作 。2Ca(OH)2+2Cl2=CaCl2+Ca(ClO)2+2H2OCaCl2、Ca(ClO)2Ca(ClO)2Ca(ClO)2漂白剂消毒剂次氯酸盐的漂白及变质原理NaClO+H2O+CO2= NaHCO3 +HClONaClO + HCl= NaCl + HClO (反应原理:较强酸制取弱酸)工业 Ca(ClO)2+2HCl = CaCl2+2HClO日常 Ca(ClO)2+CO2+H2O = CaCO3↓+2HClO你能写出漂白液、漂白粉的生效原理吗? Ca(ClO)2在空气中与CO2和H2O反应生成HClO和CaCO3,HClO不稳定,见光或受热易分解。 因此,漂白粉放置久了易变质失效,应密封保存。变质原因及保存方法次氯酸盐的漂白及变质原理【例3】为预防“新冠肺炎”,可用“84”消毒液(NaClO溶液)消毒,下列说法中正确的是( ) A. NaClO溶液的消毒原理是HClO具有强氧化性 B. 1 molCl2 与足量NaOH溶液反应转移2 mol电子 C. NaClO溶液的漂白原理与Na2O2、活性炭相同 D.“84”消毒液与“洁厕灵”(盐酸)共同使用,可达到既清洁又消毒的双重效果A【变式3】在抗震救灾中要用大量漂白粉和漂白液杀菌消毒,下列说法中正确的是( ) A.漂白粉是纯净物,漂白液是混合物 B.漂白粉的有效成分是Ca(ClO)2、CaCl2 C.工业上将氯气通入澄清石灰水中制取漂白粉 D.使用漂白粉漂白衣物时让衣物在漂白粉溶液中浸泡一段时间是 为了让漂白粉与水及空气中的二氧化碳充分反应生成次氯酸D谢谢观看THANKS
第二节 氯及其化合物 课时1 氯气的性质 第二章 海水中的重要元素——钠和氯 壹贰氯气的物理性质氯气的化学性质本节重难点 一战期间,德军在比利时的伊普尔战役中首次大规模使用氯气。面对扑面而来的黄绿色刺鼻气体,英法守军迅速崩溃,部分士兵用湿毛巾捂住嘴巴,甚至有的士兵用自己尿液浸湿的毛巾捂住嘴巴,他们逃往地势更高的地方,幸免遇难。 思考? 1. 为什么氯气可以作为化学武器?2. 为什么士兵要逃往地势更高的地方?3. 为什么湿毛巾在一定程度上可以防止氯气中毒?物理性质黄绿色刺激性大2根据课本资料,分析氯气还具有哪些性质?-101℃-34.6℃(易液化)实验室里闻有毒气体及未知气体气味的方法是用手在瓶口轻轻扇动,使极少量气体飘进鼻孔。从氯气的发现到氯被确认为一种新的元素,时间长达三十多年,其间经历了数位科学家的不懈探索。你从这一史实中得到什么启示?原子结构和存在1. Cl原子结构示意图为______________,容易__________1个电子而形成Cl-,表现出较强的__________。2. 氯在自然界中均以__________态存在。得到氧化性化合化学性质1. 与金属单质Na的反应:Cl2能与绝大多数金属反应,并且能将变价金属氧化到最高价。现象:剧烈燃烧,火焰黄色,产生大量白烟。化学方程式:2Na+Cl2 2NaCl1. 与金属单质Fe的反应:Cl2能与绝大多数金属反应,并且能将变价金属氧化到最高价。化学性质现象:红热的铁与氯气剧烈反应,产生大量棕红色烟,加水溶解后,溶液呈棕黄色化学方程式:2Fe+3Cl2 2FeCl3化学性质氯气易液化,工业上常保存于钢瓶。化学性质1. 与金属单质Cu的反应:Cl2能与绝大多数金属反应,并且能将变价金属氧化到最高价。现象:红热的铜与氯气剧烈反应, 产生大量棕黄色烟,加少量水溶解后,溶液呈绿色;加大量水溶液呈蓝色化学方程式:Cu+Cl2 CuCl2化学性质2. 与非金属单质H2的反应现象:纯净的H2在Cl2中安静地燃烧,发出苍白色火焰,瓶口有白雾产生。化学方程式:H2+Cl2 2HCl盐酸小液滴化学性质2. 与非金属单质H2的反应现象:H2、Cl2的混合气体强光照射,发生爆炸化学方程式:燃烧一定要有氧气参加吗?燃烧不一定要有氧气参加,物质并不是只有在氧气中才可以燃烧。燃烧的本质是氧化还原反应,所有发光发热的剧烈的化学反应都称为燃烧。【例1】下列各化合物不能由单质直接化合制取的是( ) A. FeCl3 B. CuCl2 C. AlCl3 D. FeCl2D【变式1】下列说法正确的是( )A. 燃烧是发光发热的剧烈的化学反应,必须有氧气参与B. 铁丝在少量的Cl2中燃烧可生成FeCl2C. 纯净的H2在Cl2中安静地燃烧,发出苍白色火焰D. Cu在Cl2中燃烧产生棕黄色的烟,若反应后,向集气瓶中加少量水振荡,可得到棕黄色溶液C化学性质3. 与水的反应真实情景:生活中,有时我们打开自来水龙头时,能闻到刺鼻的气味。是因为水中溶有氯气,用于杀菌消毒。Cl2+H2O=HCl+HClO次氯酸具有强氧化性,能杀菌、消毒。次氯酸氯气溶于水为何有杀菌、消毒作用?新制氯水能杀菌、消毒,是因为氯气与H2O反应,反应的化学方程式是: , 氯气对自来水消毒时,氯气会与水中的有机物反应,生成的有机氯化物可能对人体有害。 因此,人们已开始研究新的自来水消毒剂,如二氧化氯(ClO2)、臭氧等。你能得到什么启示?使用氯气对自来水消毒,对人体有危害吗?化学性质干燥的氯气是否具有漂白性化学性质氯水的漂白性Cl2可使湿润的有色布条褪色,不能使干燥的有色布条褪色。说明Cl2没有漂白性,而是HClO起漂白作用。结论化学性质 (次氯酸)① 不稳定(光照易分解产生气体):次氯酸分解反应的化学方程式为__________________________________ ② 强氧化性:ⅰ. 能将有色物质氧化为无色物质,作 ________________ ⅱ. 杀菌、消毒。③ 弱酸性:和氢氧化钠反应的化学方程式为____________________________________漂白剂HClO + NaOH = NaClO + H2O2HClO 2HCl+O2↑氯水的成分和性质1. 氯水的成分Cl2+H2O=HCl+HClOHCl是强电解质,H2O和HClO都是弱电解质H2O H++OH- HClO H++ClO-HCl = H++ Cl-氯水的成分和性质2. 氯水的性质新制氯水的多种成分决定了它具有多重性质,在不同的化学反应中,氯水中参与反应的微粒不同。浅黄绿色3. 液氯、新制氯水、久置氯水的比较氯水的成分和性质【例2】下列关于氯水的叙述中,正确的是( ) A、新制氯水中既有分子,又有离子 B、新制氯水在光照的条件下,可以产生气体,该气体是氯气 C、新制氯水中滴加硝酸银溶液,没有任何现象 D、新制氯水不可以使干燥的布条褪色A【变式2-1】下列说法中错误的是 ( ) A. 无论新制还是久置的氯水,滴加AgNO3溶液均生成白色沉淀 B. 氯水呈黄绿色,说明氯水中含有Cl2 C. 向氯水中加入NaHCO3粉末,有气泡产生,说明氯水中含有H+ D. 向新制氯水中滴加少量紫色石蕊溶液,充分振荡后溶液呈红色D【变式2-2】某同学在一pH试纸上滴几滴新制的氯水,现象如图所示,下列有关该实验的说法正确的是( )A. 该实验说明Cl2分子具有漂白性B. 该实验说明H+扩散速度比HClO分子快C. 将实验后的pH试纸在酒精灯上微热,试纸又恢复为原来的颜色D. 若用久置的氯水进行实验,现象相同B化学性质4. 与碱的反应(1) 与氢氧化钠溶液反应——制取漂白液①制取反应的化学方程式: 。②离子方程式: 。③漂白液的有效成分是 。Cl2+2NaOH=NaCl+NaClO+H2OCl2+2OH-=Cl-+ClO-+H2O次氯酸钠 人们直接用氯水作漂白剂,但因氯气的溶解度不大,而且生成的HClO不稳定,难以保存,使用起来不方便。化学性质4. 与碱的反应 人们直接用氯水作漂白剂,但因氯气的溶解度不大,而且生成的HClO不稳定,难以保存,使用起来不方便。(2) 与冷的石灰乳反应——制取漂白粉① 制取反应的化学方程式:_____________________________________________② 漂白粉的主要成分是_______________________,有效成分是___________,漂粉精的主要成分是_____________(3) 漂白液、漂白粉和漂粉精既可作 又可作 。2Ca(OH)2+2Cl2=CaCl2+Ca(ClO)2+2H2OCaCl2、Ca(ClO)2Ca(ClO)2Ca(ClO)2漂白剂消毒剂次氯酸盐的漂白及变质原理NaClO+H2O+CO2= NaHCO3 +HClONaClO + HCl= NaCl + HClO (反应原理:较强酸制取弱酸)工业 Ca(ClO)2+2HCl = CaCl2+2HClO日常 Ca(ClO)2+CO2+H2O = CaCO3↓+2HClO你能写出漂白液、漂白粉的生效原理吗? Ca(ClO)2在空气中与CO2和H2O反应生成HClO和CaCO3,HClO不稳定,见光或受热易分解。 因此,漂白粉放置久了易变质失效,应密封保存。变质原因及保存方法次氯酸盐的漂白及变质原理【例3】为预防“新冠肺炎”,可用“84”消毒液(NaClO溶液)消毒,下列说法中正确的是( ) A. NaClO溶液的消毒原理是HClO具有强氧化性 B. 1 molCl2 与足量NaOH溶液反应转移2 mol电子 C. NaClO溶液的漂白原理与Na2O2、活性炭相同 D.“84”消毒液与“洁厕灵”(盐酸)共同使用,可达到既清洁又消毒的双重效果A【变式3】在抗震救灾中要用大量漂白粉和漂白液杀菌消毒,下列说法中正确的是( ) A.漂白粉是纯净物,漂白液是混合物 B.漂白粉的有效成分是Ca(ClO)2、CaCl2 C.工业上将氯气通入澄清石灰水中制取漂白粉 D.使用漂白粉漂白衣物时让衣物在漂白粉溶液中浸泡一段时间是 为了让漂白粉与水及空气中的二氧化碳充分反应生成次氯酸D谢谢观看THANKS
相关资料
更多










