



所属成套资源:2024-2025学年人教版2019高中化学必修一同步课堂(课件+分层练习+知识梳理+单元测试)
高中第二节 元素周期律精品巩固练习
展开
这是一份高中第二节 元素周期律精品巩固练习,文件包含第四章物质结构元素周期律知识梳理-2024-2025学年高一化学同步备课人教版2019必修第一册原卷版docx、第四章物质结构元素周期律知识梳理-2024-2025学年高一化学同步备课人教版2019必修第一册解析版docx等2份试卷配套教学资源,其中试卷共18页, 欢迎下载使用。
原子结构与元素周期表
第1节
一、原子结构
1.构成微粒及作用:
质子(Z):决定_________种类
中子(A-Z):决定_________种类
核外电子:_________决定决定元素的化学性质
2.微粒间的数量关系:
质量数= _________+_________
质子数=_________=_________=_________
(1)阳离子的核外电子数=质子数_________所带电荷数。
(2)阴离子的核外电子数=质子数_________所带电荷数。
3.微粒符号周围数字代表的信息:
4.核外电子排布规律:
5.电子排布表示方法:
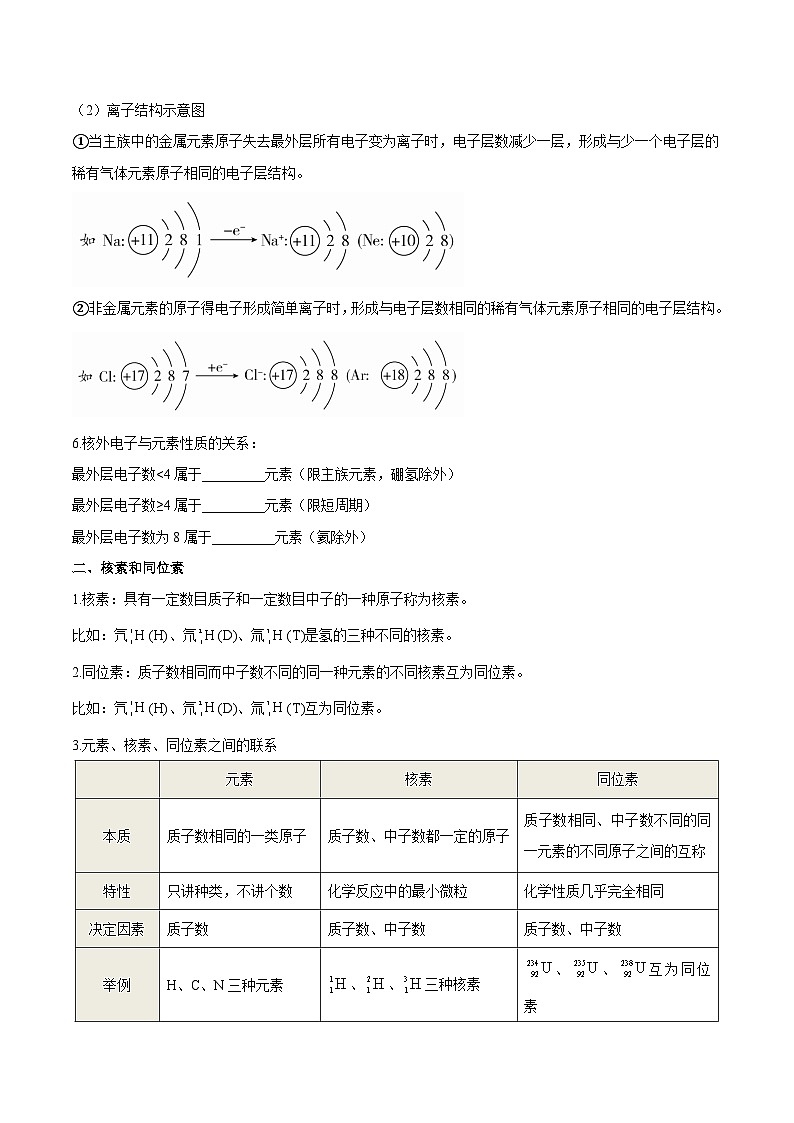
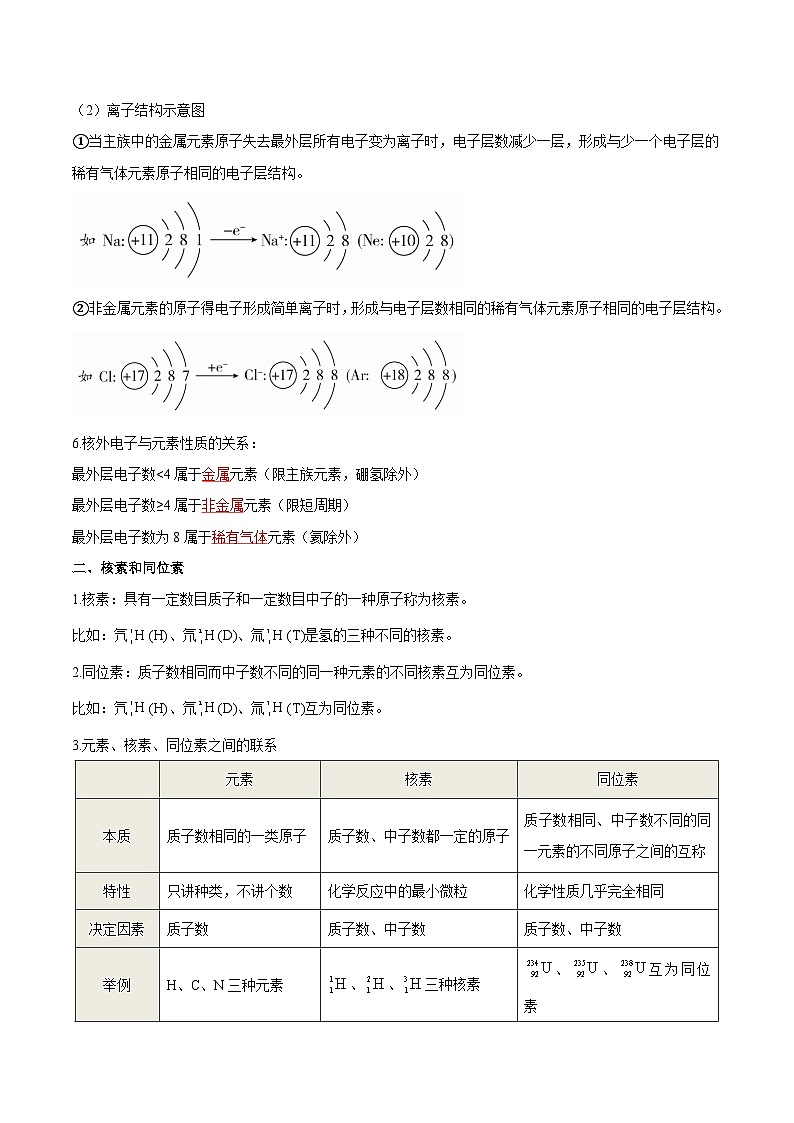
(1)原子结构示意图是核外电子排布规律的具体体现,其构成图示如下:
(2)离子结构示意图
①当主族中的金属元素原子失去最外层所有电子变为离子时,电子层数减少一层,形成与少一个电子层的稀有气体元素原子相同的电子层结构。
②非金属元素的原子得电子形成简单离子时,形成与电子层数相同的稀有气体元素原子相同的电子层结构。
6.核外电子与元素性质的关系:
最外层电子数Y>X
B.最高价氧化物对应水化物的酸性:X>W>Z
C.最简单气态氢化物的热稳定性:Y>X>W>Z
D.元素X、Z、W的最高化合价分别与其主族序数相等
【典例4】下表为元素周期表的一部分,其中X、Y、Z、W为短周期元素,W元素的核电荷数为X元素的2倍。下列说法正确的是( )
A.X、W、Z元素的原子半径及它们的气态氢化物的热稳定性均依次递增
B.Y、Z、W元素在自然界中均不能以游离态存在,它们的最高价氧化物的水化物的酸性依次递增
C.YX2晶体熔化、液态WX3气化均需克服分子间作用力
D.根据元素周期律,可以推测T元素的单质具有半导体特性,T2X3具有氧化性和还原性
元素
核素
同位素
本质
质子数相同的一类原子
质子数、中子数都一定的原子
质子数相同、中子数不同的同一元素的不同原子之间的互称
特性
只讲种类,不讲个数
化学反应中的最小微粒
化学性质几乎完全相同
决定因素
质子数
质子数、中子数
质子数、中子数
举例
H、C、N三种元素
、、三种核素
、、互为同位素
项目
同周期(从左到右)
同主族(从上到下)
原子
结构
电子层数
相同
依次增加
最外层电子数
依次增加1个
相同
原子半径
逐渐减小
逐渐增大
元素
性质
金属性
逐渐减弱
逐渐增强
非金属性
逐渐增强
逐渐减弱
主要化合价
最高正价:+1→+7(O、F除外)
负化合价:主族序数-8(H为-1价)
相同,最高正价数=主族序数(O、F除外)
化合物性质
最高价氧化物对应水化物
酸性逐渐增强
碱性逐渐减弱
酸性逐渐减弱
碱性逐渐增强
氢化物稳定性
逐渐增强
逐渐减弱
本质
原子越易失电子,金属性越强(与原子失电子数目无关)
判断方法
①在金属活动性顺序表中越靠前,金属性越强
②单质与水或非氧化性酸反应制取氢气越容易,金属性越强
③单质还原性越强或阳离子氧化性越弱,金属性越强
④最高价氧化物对应水化物的碱性越强,金属性越强
⑤若Xn++Y―→X+Ym+,则Y比X的金属性强
⑥元素在周期表中的位置,左边或下方元素的金属性强
本质
原子越易得电子,非金属性越强(与原子得电子数目无关)
判断方法
①与H2化合越容易,气态氢化物越稳定,非金属性越强
②单质氧化性越强或阴离子还原性越弱,非金属性越强
③最高价氧化物对应水化物的酸性越强,非金属性越强
④元素在周期表中的位置,右边或上方元素的非金属性强
键型
离子键
共价键
非极性键
极性键
概念
使阴、阳离子结合成化合物的静电作用
原子之间通过共用电子对所形成的相互作用
特点
阴、阳离子间的相互作用
共用电子对不发生偏移
共用电子对偏向吸引电子能力强的原子
成键粒子
阴、阳离子
原子
成键条件
活泼金属和活泼非金属
同种非金属元素原子
不同种非金属元素的原子
存在
强碱、大多数盐、典型的金属氧化物、所有铵盐中
非金属单质、某些化合物(如Na2O2)中
非金属元素的气态氢化物、酸类、非金属氧化物、碱、极少数盐(如AlCl3)、多数有机化合物中
化学键
分子间作用力
氢键
概念
相邻原子间强烈的相互作用
分子间存在的微弱的相互作用
存在于分子间或分子内的一种比分子间作用力稍强的相互作用
存在范围
分子内或某些晶体内
分子间
分子间或分子内
作用力大小
大
小
强于分子间作用力弱于化学键
性质影响
主要影响物质的化学性质
主要影响物质的物理性质
影响物质的熔沸点、密度、溶解性等
X
Y
Z
W
T
相关试卷
这是一份人教版 (2019)必修 第一册第二节 元素周期律优秀单元测试同步训练题,文件包含第四章物质结构元素周期律单元测试-2024-2025学年高一化学同步备课人教版2019必修第一册原卷版docx、第四章物质结构元素周期律单元测试-2024-2025学年高一化学同步备课人教版2019必修第一册解析版docx等2份试卷配套教学资源,其中试卷共21页, 欢迎下载使用。
这是一份高中化学第二节 金属材料精品当堂达标检测题,文件包含第三章第三章铁金属材料知识梳理-2024-2025学年高一化学同步备课人教版2019必修第一册原卷版docx、第三章第三章铁金属材料知识梳理-2024-2025学年高一化学同步备课人教版2019必修第一册解析版docx等2份试卷配套教学资源,其中试卷共19页, 欢迎下载使用。
这是一份人教版 (2019)必修 第一册第二节 离子反应精品第三课时复习练习题,文件包含第一章第2节第3课时离子反应的应用分层练习-2024-2025学年高一化学同步备课人教版2019必修第一册原卷版docx、第一章第2节第3课时离子反应的应用分层练习-2024-2025学年高一化学同步备课人教版2019必修第一册解析版docx等2份试卷配套教学资源,其中试卷共17页, 欢迎下载使用。











