



还剩17页未读,
继续阅读
成套系列资料,整套一键下载
- 【同步课件】4.1.3 原子结构与元素的性质高一化学同步备课(人教版2019必修第一册) 课件 6 次下载
- 【分层练习】4.1.3 原子结构与元素的性质高一化学同步备课(人教版2019必修第一册)(原卷版+解析版) 试卷 3 次下载
- 【分层练习】4.2.1 元素性质的周期性变化规律高一化学同步备课(人教版2019必修第一册)(原卷版+解析版) 试卷 3 次下载
- 【同步课件】4.2.2 元素周期表和周期律的应用高一化学同步备课(人教版2019必修第一册) 课件 6 次下载
- 【分层练习】4.2.2 元素周期表和周期律的应用高一化学同步备课(人教版2019必修第一册)(原卷版+析版) 试卷 3 次下载
【同步课件】4.2.1 元素性质的周期性变化规律高一化学同步备课(人教版2019必修第一册)
展开
这是一份第四章第二节 第一课时 元素性质的周期性变化规律(同步课件)-2024-2025学年高一化学同步备课(人教版2019必修第一册),共25页。
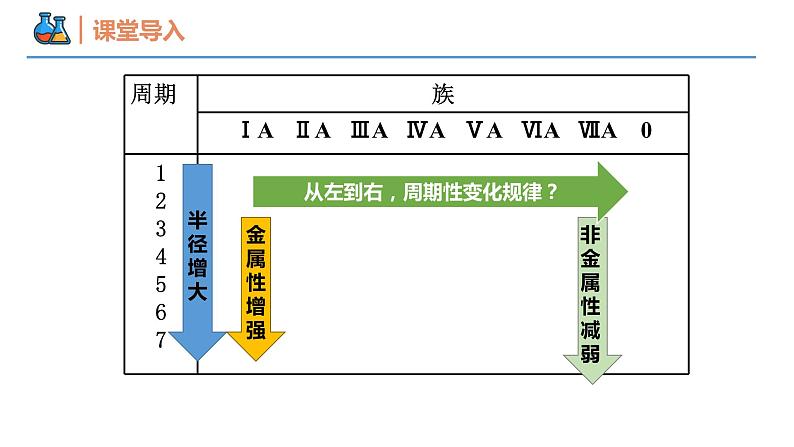
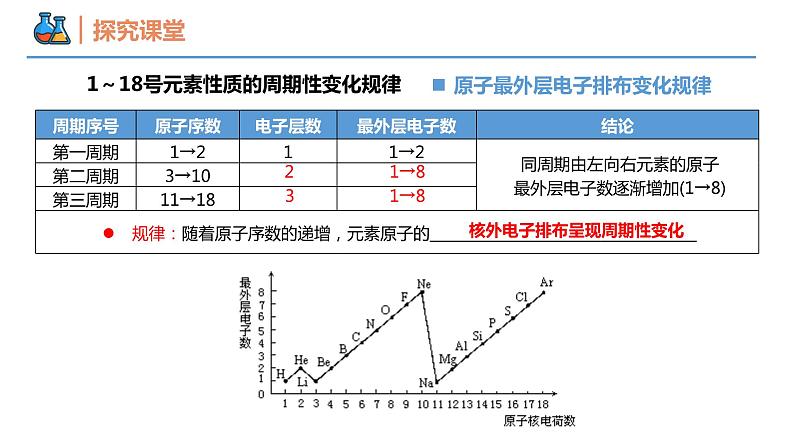
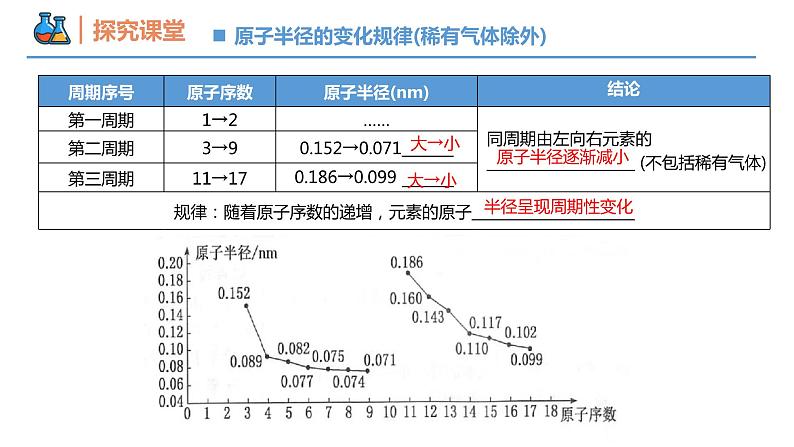
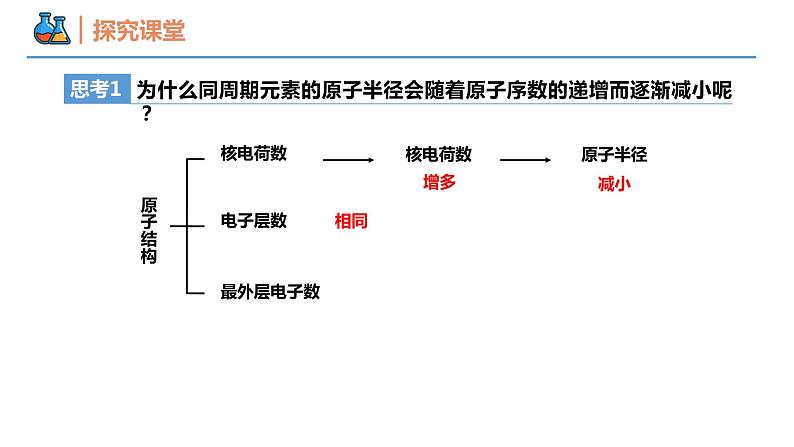
第四章 物质结构 元素周期律 第二节 元素周期律 课时1 元素性质的周期性变化规律 壹贰1~18号元素性质的周期性变化规律同周期元素金属性和非金属性的递变规律本节重点本节难点半径增大金属性增强从左到右,周期性变化规律?1~18号元素性质的周期性变化规律1→81→8核外电子排布呈现周期性变化23原子最外层电子排布变化规律大→小大→小原子半径逐渐减小半径呈现周期性变化0.186→0.099原子半径的变化规律(稀有气体除外)为什么同周期元素的原子半径会随着原子序数的递增而逐渐减小呢?思考1原子结构核电荷数电子层数最外层电子数核电荷数增多原子半径减小相同电子层数多的元素原子半径一定大于电子层数少的元素吗?思考2不一定,如第二周期的Li比第三周期的S、Cl等原子半径大。“一看”:电子层数“二看”:核电荷数“三看”:最外层电子数比较 Na 、Mg、Al、Si的原子半径大小?Na >Mg>Al>Si 比较Cs、Rb、K、Na、Li、H原子半径?Cs>Rb>K>Na>Li>H 比较O2-、F-、Na+、Mg2+原子半径?O2->F->Na+>Mg2+ Cl->Cl 比较Cl-、Cl 原子半径?【例1】下列各组粒子按半径由大到小的顺序排列正确的是( )。 A.Mg、Ca、K、Na B.S2-、Cl-、K+、Na+ C.Br-、Br、Cl、S D.Na+、Al3+、Cl-、F-B+1→+5-4→-1主要化合价呈现周期性变化+1→+7-4→-1主族元素的主要化合价② 元素最高正价、最低负价的数值与原子最外层电子数之间有何关系?① 随着元素核电荷数的递增,同一周期元素的最高正价、最低负价呈现怎样的变化趋势?③ 主族序数与原子最外层电子数之间有何关系?② 非金属元素:最外层电子数=最高正价;最高正价+|最低负价|=8③ 主族元素:主族序数=最高正价=最外层电子数(O、F除外)(H、O、F除外)注意:金属无负价;H最高价为+1,最低价为-1;O无最高正价,最低价为-2;F无正化合价,最低价为-1① 元素的最高正价呈现由+1到+7、最低负价呈现由-4到-1的周期性变化主族元素的主要化合价【例2】X元素最高价氧化物对应水化物的化学式为H2XO4,该元素的气态氢化物的化学式是( ) A.HX B.H2X C.XH3 D.XH4B根据第三周期元素原子的核外电子排布规律,你能推测出该周期元素金属性和非金属性的变化规律吗?电子层数相同,核电荷数增大, 失电子能力减弱,得电子能力增强 原子半径逐渐减小原子核对最外层电子的引力逐渐增强结构性质决定性质预测同周期元素金属性和非金属性的递变规律Na Mg Al Si P S Cl金属性逐渐减弱,非金属性逐渐增强同一周期从左到右,元素金属性逐渐_____,非金属性逐渐_____。减弱增强比较钠、镁单质与水反应的难易程度比较镁、铝单质与盐酸反应置换出氢气的难易程度金属性:Na>Mg>Al金属性:Na>Mg金属性:Mg>Al实验验证金属性:Na>Mg>Al碱性强弱:NaOH>Mg(OH)2>Al(OH)3实验验证元素金属性强弱的判断依据(3)置换反应(1)单质与水或酸反应置换出氢气的难易程度。 置换出氢气越容易,则元素金属性越强(2)元素最高价氧化物对应水化物碱性强弱。 碱性越强,则原金属元素的金属性越强。验证方法强Cl>S>P>Si(4)置换反应(1)非金属单质与氢气化合的难易程度。 越容易化合,则非金属性越强(2)形成气态氢化物的稳定性。 稳定性:HF>HCl ,非金属性: F > Cl(3)元素最高价氧化物对应水化物酸性强弱。 酸性:H2SO4>H2CO3 ,非金属性: S > C元素非金属性强弱的判断依据验证方法原子结构的周期性变化元素性质的周期性变化元素周期律原子核外电子排布原子半径主要化合价元素性质的周期性变化是 呈周期性变化的必然结果。元素金属性和非金属性内容 随着原子序数的递增而呈周期性的变化,这一规律叫做元素周期律。归纳决定实质随着原子序数的递增呈周期性变化元素的性质内容【例3】下列不能说明氯的非金属性比硫强的事实是( )① HCl比H2S稳定② HCl和H2S的水溶液前者的酸性强③ HClO4酸性比H2SO4强④ Cl2能与H2S反应生成S⑤ 氯原子能得1个电子变成稳定离子,而硫原子能得两个电子⑥ Cl2与Fe反应生成FeCl3,S与Fe反应生成FeS A.①②④ B.①③⑥ C.②⑤ D.③⑤C【例4】已知短周期元素的四种离子A2+、B+、C3-、D-具有相同的电子层结构,则下列叙述中正确的是( ) A. 原子序数:D>C>B>A B. 原子半径:B>A>C>D C. 离子半径:C3->D->A2+>B+ D. 氧化性:A2+>B+,还原性:C3-<D-BMg2+Na+N3-F-【例5】短周期元素X、Y、Z、W在周期表中位置如图,其中W原子的次外层电子数是最内层电子数与最外层电子数之和。下列说法不正确的是 ( ) A. 最简单的氢化物的还原性:XW>Y C. 简单离子的半径大小:Y>W>Z D. 氧化物对应水化物的酸性:Y
第四章 物质结构 元素周期律 第二节 元素周期律 课时1 元素性质的周期性变化规律 壹贰1~18号元素性质的周期性变化规律同周期元素金属性和非金属性的递变规律本节重点本节难点半径增大金属性增强从左到右,周期性变化规律?1~18号元素性质的周期性变化规律1→81→8核外电子排布呈现周期性变化23原子最外层电子排布变化规律大→小大→小原子半径逐渐减小半径呈现周期性变化0.186→0.099原子半径的变化规律(稀有气体除外)为什么同周期元素的原子半径会随着原子序数的递增而逐渐减小呢?思考1原子结构核电荷数电子层数最外层电子数核电荷数增多原子半径减小相同电子层数多的元素原子半径一定大于电子层数少的元素吗?思考2不一定,如第二周期的Li比第三周期的S、Cl等原子半径大。“一看”:电子层数“二看”:核电荷数“三看”:最外层电子数比较 Na 、Mg、Al、Si的原子半径大小?Na >Mg>Al>Si 比较Cs、Rb、K、Na、Li、H原子半径?Cs>Rb>K>Na>Li>H 比较O2-、F-、Na+、Mg2+原子半径?O2->F->Na+>Mg2+ Cl->Cl 比较Cl-、Cl 原子半径?【例1】下列各组粒子按半径由大到小的顺序排列正确的是( )。 A.Mg、Ca、K、Na B.S2-、Cl-、K+、Na+ C.Br-、Br、Cl、S D.Na+、Al3+、Cl-、F-B+1→+5-4→-1主要化合价呈现周期性变化+1→+7-4→-1主族元素的主要化合价② 元素最高正价、最低负价的数值与原子最外层电子数之间有何关系?① 随着元素核电荷数的递增,同一周期元素的最高正价、最低负价呈现怎样的变化趋势?③ 主族序数与原子最外层电子数之间有何关系?② 非金属元素:最外层电子数=最高正价;最高正价+|最低负价|=8③ 主族元素:主族序数=最高正价=最外层电子数(O、F除外)(H、O、F除外)注意:金属无负价;H最高价为+1,最低价为-1;O无最高正价,最低价为-2;F无正化合价,最低价为-1① 元素的最高正价呈现由+1到+7、最低负价呈现由-4到-1的周期性变化主族元素的主要化合价【例2】X元素最高价氧化物对应水化物的化学式为H2XO4,该元素的气态氢化物的化学式是( ) A.HX B.H2X C.XH3 D.XH4B根据第三周期元素原子的核外电子排布规律,你能推测出该周期元素金属性和非金属性的变化规律吗?电子层数相同,核电荷数增大, 失电子能力减弱,得电子能力增强 原子半径逐渐减小原子核对最外层电子的引力逐渐增强结构性质决定性质预测同周期元素金属性和非金属性的递变规律Na Mg Al Si P S Cl金属性逐渐减弱,非金属性逐渐增强同一周期从左到右,元素金属性逐渐_____,非金属性逐渐_____。减弱增强比较钠、镁单质与水反应的难易程度比较镁、铝单质与盐酸反应置换出氢气的难易程度金属性:Na>Mg>Al金属性:Na>Mg金属性:Mg>Al实验验证金属性:Na>Mg>Al碱性强弱:NaOH>Mg(OH)2>Al(OH)3实验验证元素金属性强弱的判断依据(3)置换反应(1)单质与水或酸反应置换出氢气的难易程度。 置换出氢气越容易,则元素金属性越强(2)元素最高价氧化物对应水化物碱性强弱。 碱性越强,则原金属元素的金属性越强。验证方法强Cl>S>P>Si(4)置换反应(1)非金属单质与氢气化合的难易程度。 越容易化合,则非金属性越强(2)形成气态氢化物的稳定性。 稳定性:HF>HCl ,非金属性: F > Cl(3)元素最高价氧化物对应水化物酸性强弱。 酸性:H2SO4>H2CO3 ,非金属性: S > C元素非金属性强弱的判断依据验证方法原子结构的周期性变化元素性质的周期性变化元素周期律原子核外电子排布原子半径主要化合价元素性质的周期性变化是 呈周期性变化的必然结果。元素金属性和非金属性内容 随着原子序数的递增而呈周期性的变化,这一规律叫做元素周期律。归纳决定实质随着原子序数的递增呈周期性变化元素的性质内容【例3】下列不能说明氯的非金属性比硫强的事实是( )① HCl比H2S稳定② HCl和H2S的水溶液前者的酸性强③ HClO4酸性比H2SO4强④ Cl2能与H2S反应生成S⑤ 氯原子能得1个电子变成稳定离子,而硫原子能得两个电子⑥ Cl2与Fe反应生成FeCl3,S与Fe反应生成FeS A.①②④ B.①③⑥ C.②⑤ D.③⑤C【例4】已知短周期元素的四种离子A2+、B+、C3-、D-具有相同的电子层结构,则下列叙述中正确的是( ) A. 原子序数:D>C>B>A B. 原子半径:B>A>C>D C. 离子半径:C3->D->A2+>B+ D. 氧化性:A2+>B+,还原性:C3-<D-BMg2+Na+N3-F-【例5】短周期元素X、Y、Z、W在周期表中位置如图,其中W原子的次外层电子数是最内层电子数与最外层电子数之和。下列说法不正确的是 ( ) A. 最简单的氢化物的还原性:X
相关资料
更多










