



还剩24页未读,
继续阅读
成套系列资料,整套一键下载
【同步课件】4.3.2 共价键高一化学同步备课(人教版2019必修第一册)
展开
这是一份第四章第三节 第二课时 共价键(同步课件)-2024-2025学年高一化学同步备课(人教版2019必修第一册),共32页。
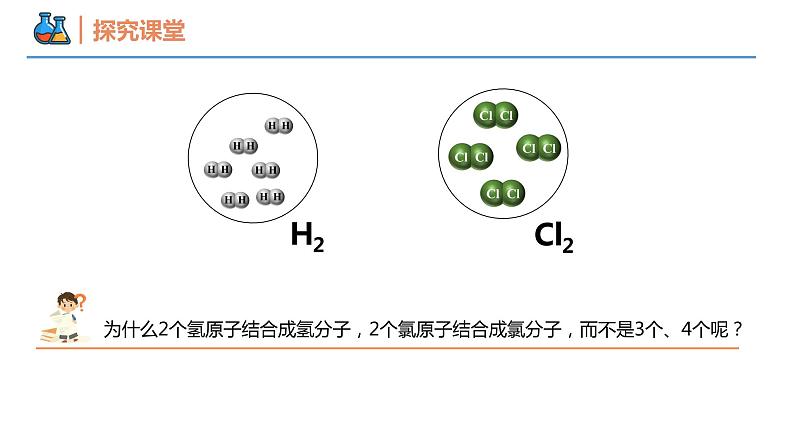
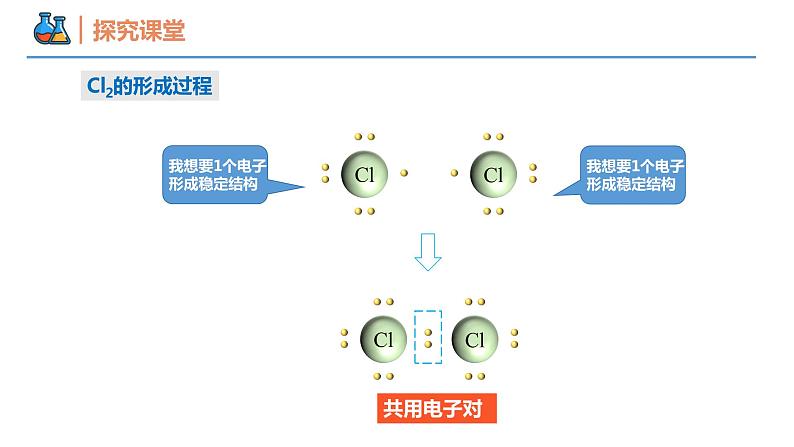
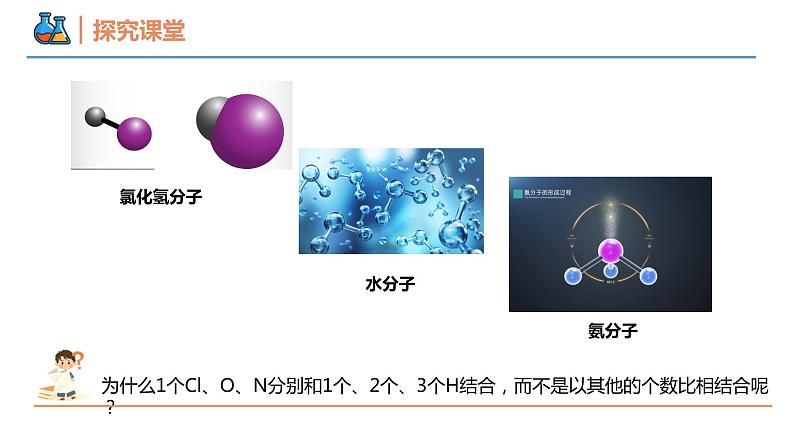
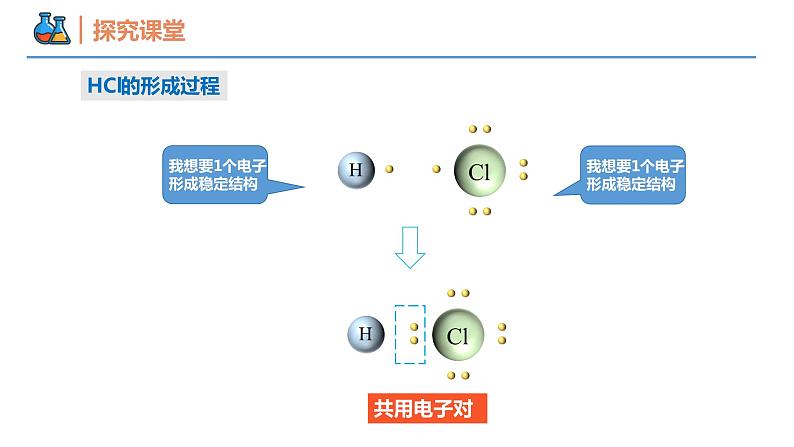
第四章 物质结构 元素周期律 第三节 化学键 课时2 共价键 壹贰叁共价键电子式本节重点本节难点分子间作用力元素的原子之间除了通过静电作用形成离子键,还有没有其他的相互作用呢?H2Cl2Cl2的形成过程共用电子对氯化氢分子水分子氨分子为什么1个Cl、O、N分别和1个、2个、3个H结合,而不是以其他的个数比相结合呢?HCl的形成过程共用电子对原子间通过共用电子对所形成的化学键。1、概念:一般是非金属元素之间,且成键的原子最外层未达到饱和状态。2、形成条件:共价键共价化合物非金属氧化物。如:SO2、CO、CO2等 非金属氢化物。如: H2S、HCl、 NH3等大多数有机化合物。如:CH4、CH3COOH等酸。如: H2SO4、 HNO3等共价化合物常见类型:只含有共价键的化合物共价化合物导电性:熔融状态时不导电(即熔融无法破坏共价键)溶于水后可能导电(如HCl、H2SO4等酸)溶于水后也可能不导电(如乙醇)【例1】下列物质中,既含有离子键又含有共价键的是( )A.H2O B.NaOH C.Na2O D.MgCl2B【例2】下列物质溶于水没有化学键断裂的是( )A.HCl B.NaOH C.乙醇 D.Na2OC【例3】下列说法中正确的是( )A.所有物质中一定都含有化学键B.含有共价键的化合物一定是共价化合物C.含有离子键的化合物一定是离子化合物D.非极性键只存在于非金属单质分子中C共价化合物共价化合物________不含有离子键,含共价键的化合物________是共价化合物。关系:一定不一定电子式① 共用电子对数=8-最外层电子数(K层除外);(1) 共价分子电子式:② 不加中括号[ ],不标正负电荷数 1 4 3 2 1H2N2电子式(1) 共价分子电子式:CO2H2O2NH3H2OCH4电子式(2) 含共价键复杂离子的电子式:O22-OH-NH4+电子式(3) 用电子式表示共价键形成过程:如:★ 注意事项:① 不用箭头表示电子的偏移;② 相同原子不能合并在一起;③ 没有形成离子。 HClH2O结构式几种常见的以共价键形成的分子及其结构H—O—HO=C=O在化学上,常用一根短线“—”表示一对共用电子,其余电子一律省去,这样的式子叫做结构式。V型直线型正四面体型电子式【例4】下列关于电子式的相关描述正确的是( )A. CCl4的电子式为B. CaCl2的电子式为Ca2+C.由NH3的电子式 可知每个NH3分子中含8个电子D.用电子式表示HCl的形成过程为 + →2 A电子式② NH3① CO2【例5】用电子式表示下列分子的形成过程。共价键类型由同种元素原子形成的共价键和不同种元素形成的共价键有什么区别?H:H思考:【例6】下列反应过程中,同时有离子键、极性共价键和非极性共价键的断裂和形成的反应是( )A.NH4Cl NH3↑+HCl↑B.NH3+CO2+H2O = NH4HCO3C.2NaOH+Cl2 = NaCl+NaClO+H2OD.2Na2O2+2CO2 = 2Na2CO3+O2D使离子相结合或原子相结合的作用力1、定义:2、分类:化学键离子键:阴阳离子间的静电作用共价键:原子间通过共同电子对所形成的相互作用电子对偏移电子对不偏移极性键非极性键化学反应的的过程,本质上就是旧化学键断裂和新化学键形成的过程。如:(NH4)2SO4 + BaCl2 = BaSO4↓ + 2NH4ClSO4 2-中的共价键没有断裂注意:化学反应中反应物的化学键不一定全部被破坏化学键3、化学反应的本质:【例7】关于化学键的叙述正确的是( )A.离子化合物中只存在离子键B.非金属元素组成的化合物中可能存在离子键C.由不同种元素组成的多原子分子里,一定只存在极性共价键D.含金属元素的化合物中一定存在离子键B【生活体验之“擦棉球”】 将蘸有水和酒精的棉花球分别擦拭在手背上,感受有何变化?手背擦过酒精凉凉的为什么会变凉?液体挥发吸热的本质原因是什么? 挥发后,液态水分子变成气态水分子,内部的氢氧键没有断裂,挥发过程中破坏的是不同水分子间的作用力。分子间存在的将分子聚集在一起的作用力称为分子间作用力,又称为范德华力。(2)影响: 对于组成和结构相似的物质,相对分子质量越大,分子间作用力越大,物质的溶沸点越高。如:I2>Br2> Cl2> F2比化学键弱得多,它主要影响物质的熔点、沸点、溶解性等物理性质分子间作用力分子之间存在着一种比范德华力稍强的相互作用,这种相互作用叫氢键。X—H···Y—(X、Y为N、O、F)氢键的影响:分子间作用力一种特殊的分子间作用力①氢键会使物质的熔点和沸点升高。②水结成冰,体积增大,跟氢键有关。③DNA的结构和生理活性都与氢键的作用有关。【例8】在“冰→水→水蒸气→H2”的变化过程中,被破坏的作用力依次是( )A.分子间作用力、分子间作用力、分子间作用力B.分子间作用力、分子间作用力、共价键C.分子间作用力、共价键、共价键D.共价键、共价键、共价键B谢谢观看THANKS
第四章 物质结构 元素周期律 第三节 化学键 课时2 共价键 壹贰叁共价键电子式本节重点本节难点分子间作用力元素的原子之间除了通过静电作用形成离子键,还有没有其他的相互作用呢?H2Cl2Cl2的形成过程共用电子对氯化氢分子水分子氨分子为什么1个Cl、O、N分别和1个、2个、3个H结合,而不是以其他的个数比相结合呢?HCl的形成过程共用电子对原子间通过共用电子对所形成的化学键。1、概念:一般是非金属元素之间,且成键的原子最外层未达到饱和状态。2、形成条件:共价键共价化合物非金属氧化物。如:SO2、CO、CO2等 非金属氢化物。如: H2S、HCl、 NH3等大多数有机化合物。如:CH4、CH3COOH等酸。如: H2SO4、 HNO3等共价化合物常见类型:只含有共价键的化合物共价化合物导电性:熔融状态时不导电(即熔融无法破坏共价键)溶于水后可能导电(如HCl、H2SO4等酸)溶于水后也可能不导电(如乙醇)【例1】下列物质中,既含有离子键又含有共价键的是( )A.H2O B.NaOH C.Na2O D.MgCl2B【例2】下列物质溶于水没有化学键断裂的是( )A.HCl B.NaOH C.乙醇 D.Na2OC【例3】下列说法中正确的是( )A.所有物质中一定都含有化学键B.含有共价键的化合物一定是共价化合物C.含有离子键的化合物一定是离子化合物D.非极性键只存在于非金属单质分子中C共价化合物共价化合物________不含有离子键,含共价键的化合物________是共价化合物。关系:一定不一定电子式① 共用电子对数=8-最外层电子数(K层除外);(1) 共价分子电子式:② 不加中括号[ ],不标正负电荷数 1 4 3 2 1H2N2电子式(1) 共价分子电子式:CO2H2O2NH3H2OCH4电子式(2) 含共价键复杂离子的电子式:O22-OH-NH4+电子式(3) 用电子式表示共价键形成过程:如:★ 注意事项:① 不用箭头表示电子的偏移;② 相同原子不能合并在一起;③ 没有形成离子。 HClH2O结构式几种常见的以共价键形成的分子及其结构H—O—HO=C=O在化学上,常用一根短线“—”表示一对共用电子,其余电子一律省去,这样的式子叫做结构式。V型直线型正四面体型电子式【例4】下列关于电子式的相关描述正确的是( )A. CCl4的电子式为B. CaCl2的电子式为Ca2+C.由NH3的电子式 可知每个NH3分子中含8个电子D.用电子式表示HCl的形成过程为 + →2 A电子式② NH3① CO2【例5】用电子式表示下列分子的形成过程。共价键类型由同种元素原子形成的共价键和不同种元素形成的共价键有什么区别?H:H思考:【例6】下列反应过程中,同时有离子键、极性共价键和非极性共价键的断裂和形成的反应是( )A.NH4Cl NH3↑+HCl↑B.NH3+CO2+H2O = NH4HCO3C.2NaOH+Cl2 = NaCl+NaClO+H2OD.2Na2O2+2CO2 = 2Na2CO3+O2D使离子相结合或原子相结合的作用力1、定义:2、分类:化学键离子键:阴阳离子间的静电作用共价键:原子间通过共同电子对所形成的相互作用电子对偏移电子对不偏移极性键非极性键化学反应的的过程,本质上就是旧化学键断裂和新化学键形成的过程。如:(NH4)2SO4 + BaCl2 = BaSO4↓ + 2NH4ClSO4 2-中的共价键没有断裂注意:化学反应中反应物的化学键不一定全部被破坏化学键3、化学反应的本质:【例7】关于化学键的叙述正确的是( )A.离子化合物中只存在离子键B.非金属元素组成的化合物中可能存在离子键C.由不同种元素组成的多原子分子里,一定只存在极性共价键D.含金属元素的化合物中一定存在离子键B【生活体验之“擦棉球”】 将蘸有水和酒精的棉花球分别擦拭在手背上,感受有何变化?手背擦过酒精凉凉的为什么会变凉?液体挥发吸热的本质原因是什么? 挥发后,液态水分子变成气态水分子,内部的氢氧键没有断裂,挥发过程中破坏的是不同水分子间的作用力。分子间存在的将分子聚集在一起的作用力称为分子间作用力,又称为范德华力。(2)影响: 对于组成和结构相似的物质,相对分子质量越大,分子间作用力越大,物质的溶沸点越高。如:I2>Br2> Cl2> F2比化学键弱得多,它主要影响物质的熔点、沸点、溶解性等物理性质分子间作用力分子之间存在着一种比范德华力稍强的相互作用,这种相互作用叫氢键。X—H···Y—(X、Y为N、O、F)氢键的影响:分子间作用力一种特殊的分子间作用力①氢键会使物质的熔点和沸点升高。②水结成冰,体积增大,跟氢键有关。③DNA的结构和生理活性都与氢键的作用有关。【例8】在“冰→水→水蒸气→H2”的变化过程中,被破坏的作用力依次是( )A.分子间作用力、分子间作用力、分子间作用力B.分子间作用力、分子间作用力、共价键C.分子间作用力、共价键、共价键D.共价键、共价键、共价键B谢谢观看THANKS
相关资料
更多










