



江苏省盐城市三校联考2023-2024学年高二下学期4月期中考试化学试题(原卷版+解析版)
展开本试卷分试题卷和答题卷两部分。试题卷包括1至7页;答题卷1至2页。满分100分。考试时间75分钟。
可能用到的相对原子质量:H:1 C:12 N:14 O:16 I:127
一、单项选择题:共13题,每题3分,共39分。每题只有一个选项符合题意。
1. 化学与社会、科学、技术、生活等密切相关,下列说法正确的是
A. 载人飞船采用了刚性太阳能电池阵,将化学能转化为电能供飞船使用
B. “天宫一号”使用的碳纤维,是一种新型有机高分子材料
C. 苯酚有毒,对皮肤有腐蚀性,使用时不慎沾到皮肤上,应立即用水冲洗
D. “天和”核心舱腔体使用的氮化硼陶瓷基复合材料,氮化硼陶瓷属于新型无机非金属材料
【答案】D
【解析】
【详解】A.太阳能电池,是将太阳能转化为电能,不涉及化学反应,也就不存在化学能的转化,A不正确;
B.碳纤维的主要成分是碳单质,是一种新型无机非金属材料,B不正确;
C.苯酚微溶于水,易溶于酒精,苯酚有毒,对皮肤有腐蚀性,使用时不慎沾到皮肤上,应立即用酒精冲洗,C不正确;
D.氮化硼陶瓷基复合材料中,基体材料氮化硼陶瓷属于新型无机非金属材料,D正确;
故选D。
2. 下列说法错误的是
A. 是由极性键构成的极性分子
B. 键角:
C. 乙醇中杂化的原子数为
D. 基态原子中,两种自旋状态的电子数之比为
【答案】C
【解析】
【详解】A.分子是角形,正负电荷的重心不重合,所以是由极性键构成的极性分子,A正确;
B.硝酸根离子的空间构型为平面三角形,键角为120°,铵根离子的空间构型为正四面体角形,键角为109°28',氨分子的空间构型为三角锥形,键角为107°18',白磷分子的空间构型为正四面体形键角为60°,则键角大小顺序为键角:,B正确;
C.乙醇中,碳原子和氧原子均为杂化,乙醇,即1ml,则杂化的原子数为,C错误;
D.基态原子电子排布图为,两种自旋状态的电子数之比为,D正确;
故选C。
3. 下列物质结构与性质或物质性质与用途具有对应关系的是
A. 乙二醇易溶于水,可用作汽车防冻液
B. 氟电负性大于氯的电负性,的酸性强于
C. 甲苯易挥发,可用于制备2,4,6-三硝基甲苯
D. 分子间存在氢键,的热稳定性强于
【答案】B
【解析】
【详解】A.乙二醇沸点高,熔点低,降低水的凝固点,可用作汽车防冻液,A错误;
B.由于氟的电负性大于氯的电负性,F-C的极性大于Cl-C的极性,使F3C-的极性大于Cl3C-的极性,导致三氟乙酸的羧基中的羟基的极性更大,更容易电离出氢离子,的酸性强于,B正确;
C.由于甲基对苯环的影响,甲苯可用于制备2,4,6-三硝基甲苯,与易挥发无关,C错误;
D.非金属简单氢化物的稳定性与分子内的化学键的键能有关,与分子间氢键无关,D错误;
故选B。
4. X、Y、Z、W、R为原子序数依次增大的元素。X、Z原子中分别有1、7个运动状态完全不同的电子,Y原子中各能级电子数相等,W原子最外层电子数是内层的3倍,R为第4周期金属元素,基态原子无未成对电子且内层电子全满。下列说法正确的是
A. 最高价氧化物对应的水化物的酸性:Z<Y
B. 第一电离能:
C. Z原子基态核外电子排布式为1s22s22p3
D. 一个离子中键数为12
【答案】C
【解析】
【分析】X、Y、Z、W、R为原子序数依次增大的元素。X、Z原子中分别有1、7个运动状态完全不同的电子,则X为H元素、Z为N元素;Y原子中各能级电子数相等,Y的电子排布式可能为1s22s2、1s22s22p2,则Y可能为Be或C;W原子最外层电子数是内层的3倍,则W的电子排布为2、6,W为O元素;R为第4周期金属元素,基态原子无未成对电子且内层电子全满,则R为Zn元素。从而得出X、Y、Z、W、R分别为H、Be(或C)、N、O、Zn。
【详解】A.Y、Z分别为Be(或C)、N,N的非金属性大于Be(或C),则最高价氧化物对应的水化物的酸性:HNO3>Be(OH)2(或H2CO3),A不正确;
B.Y、Z、W分别为Be(或C)、N、O,三者属于同周期元素,N的2p轨道半充满,第一电离能反常,则第一电离能:,B不正确;
C.Z为7号元素N,其基态原子核外电子排布式为1s22s22p3,C正确;
D.一个离子中,N-H共价键、N→Zn2+配位键都属于键,则键数为4×4=16,D不正确;
故选C。
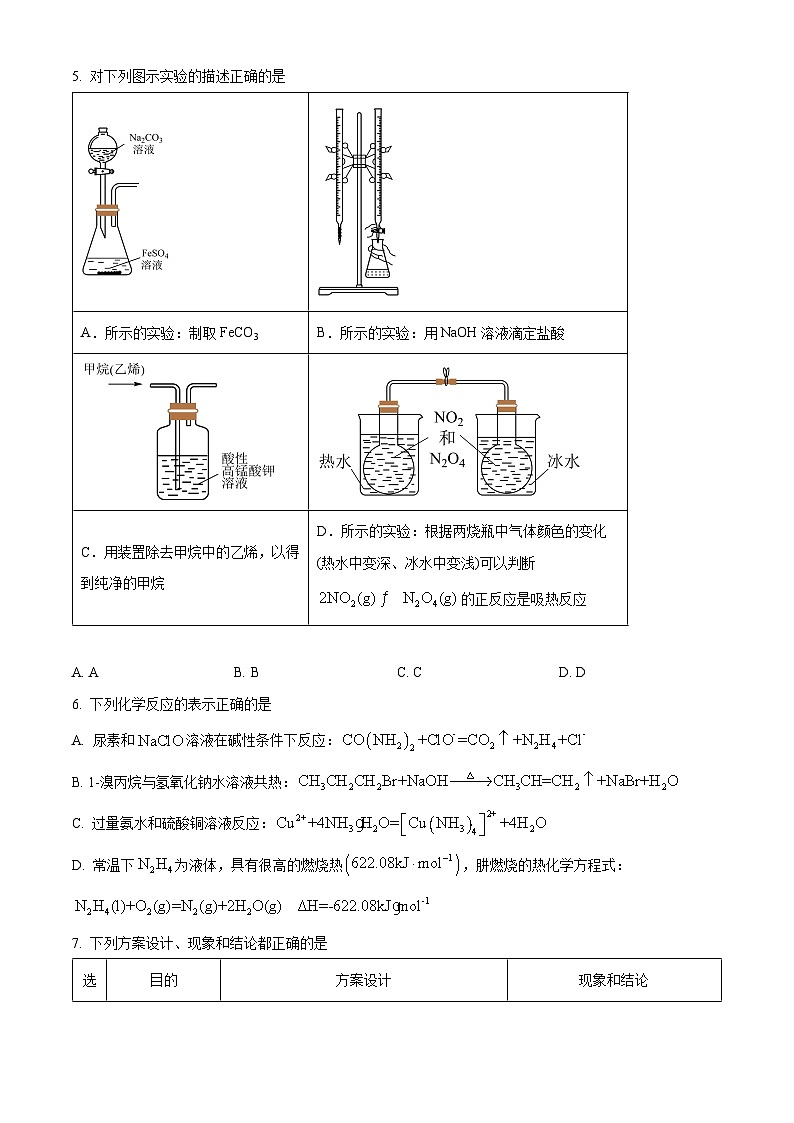
5. 对下列图示实验的描述正确的是
A. AB. BC. CD. D
【答案】A
【解析】
【详解】A.制取FeCO3时,应将Na2CO3溶液滴加到FeSO4溶液中,否则会导致部分Fe2+转化为Fe(OH)2沉淀,A正确;
B.用NaOH溶液滴定盐酸时,盐酸放入锥形瓶内,NaOH应放在碱式滴定管内,而图中滴定管为酸式滴定管,B不正确;
C.除去甲烷中的乙烯时,KMnO4会将乙烯氧化为CO2,混在甲烷气体中,应使用溴水除杂,C不正确;
D.对于反应,升高温度混合气的颜色加深,则表明平衡向生成NO2的方向移动,则正反应为放热反应,D不正确;
故选A。
6. 下列化学反应的表示正确的是
A. 尿素和溶液在碱性条件下反应:
B. 1-溴丙烷与氢氧化钠水溶液共热:
C. 过量氨水和硫酸铜溶液反应:
D. 常温下为液体,具有很高的燃烧热,肼燃烧的热化学方程式:
【答案】C
【解析】
【详解】A.尿素和NaClO溶液在碱性条件下反应生成N2H4、Na2CO3和NaCl,反应的离子方程式为:,A错误;
B.1-溴丙烷与氢氧化钠水溶液共热发生取代反应,,B错误;
C.过量氨水和硫酸铜溶液反应生成,反应的离子方程式为:,C正确;
D.肼燃烧的热化学方程式中H2O应为液态,热化学方程式:,D错误;
故选C。
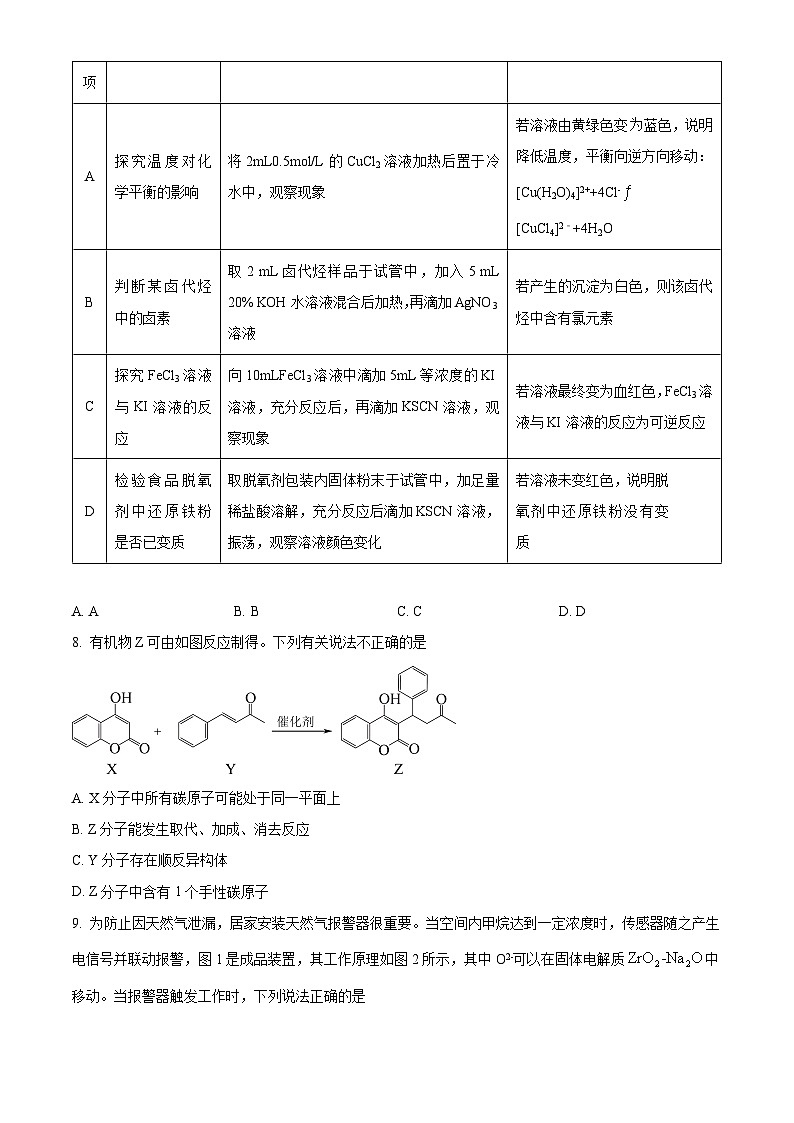
7. 下列方案设计、现象和结论都正确的是
A. AB. BC. CD. D
【答案】A
【解析】
【详解】A.降低温度,溶液由黄绿色变为蓝绿色,[CuCl4]2﹣的浓度减小,则降低温度使[Cu(H2O)4]2++4Cl-[CuCl4]2﹣+4H2O逆向移动,A正确;
B.判断某卤代烃中的卤素,取2 mL卤代烃样品于试管中,加入5 mL 20% KOH水溶液混合后加热,先加入适量HNO3,再滴加AgNO3溶液,若产生的沉淀为白色,则该卤代烃中含有氯元素,B错误;
C.FeCl3溶液过量,反应后有剩余,应控制氯化铁不足,反应后检验铁离子存在,才能证明反应是可逆反应,C错误;
D.溶解时可能Fe与铁离子反应生成亚铁离子,由实验操作和现象不能证明铁粉是否变质,D错误;
故选A。
8. 有机物Z可由如图反应制得。下列有关说法不正确的是
A. X分子中所有碳原子可能处于同一平面上
B. Z分子能发生取代、加成、消去反应
C. Y分子存在顺反异构体
D. Z分子中含有1个手性碳原子
【答案】B
【解析】
【详解】A.苯环是平面结构,乙烯结构及酯基是平面结构,三个平面可能共平面,因此X分子中所有碳原子可能位于同一平面上,A正确;
B.Z分子能发生取代、加成反应,不能发生消去反应,B错误;
C.Y分子中两个不饱和C原子连接不同的原子和原子团,因此Y分子存在顺反异构体,C正确;
D.手性碳原子是连接四个不同的原子或原子团的C原子,即红色标记处为手性碳原子,因此Z分子中仅含有1个手性碳原子,D正确;
故选B。
9. 为防止因天然气泄漏,居家安装天然气报警器很重要。当空间内甲烷达到一定浓度时,传感器随之产生电信号并联动报警,图1是成品装置,其工作原理如图2所示,其中O2-可以在固体电解质中移动。当报警器触发工作时,下列说法正确的是
A. O2-在电解质中向a电极移动,电流方向由a电极经导线流向b电极
B. 报警器触发工作时,图2的装置将电能转化为化学能
C. 当电路中有0.008ml电子转移时,则电极a有22.4mL甲烷参与反应
D. 多孔电极a极上发生的反应的电极反应式为:
【答案】D
【解析】
【分析】甲烷、空气、构成燃料电池,电池工作时,通入CH4的多孔电极a为负极,CH4失电子产物与电解质反应生成CO2等,通入空气的多孔电极b为正极,O2得电子生成O2-。
【详解】A.由分析可知,a为负极,b为正极,则O2-在电解质中向a电极移动,但电流方向由b电极经导线流向a电极,A不正确;
B.报警器触发工作时,图2的装置形成原电池,将化学能转化为电能,B不正确;
C.在a电极,发生电极反应CH4-8e-+4O2-=CO2+2H2O,则当电路中有0.008ml电子转移时,电极a有0.001mlCH4参加反应,在标准状况下其体积为22.4mL,题中没有指明标准状况,C不正确;
D.多孔电极a极为负极,CH4失电子产物与电解质反应生成CO2等,则发生反应的电极反应式为:,D正确;
故选D。
10. 酸性条件下,环氧乙烷水合法制备乙二醇涉及的机理如图:
下列说法不正确的是
A. 二甘醇的分子式是
B. X的结构简式为:
C. 进攻环氧乙烷中的氧原子是因为碳氧键的共用电子对偏向氧
D. 制备乙二醇的总反应为
【答案】B
【解析】
【分析】根据生成乙二醇的机理可以看出,氢离子参与反应且前后不变,说明H+是催化剂,根据生成副产物的反应机理,X应该是,而且再结合生成乙二醇的机理,生成乙二醇反应过程中有中间产物生成。
【详解】A.根据原子守恒,二甘醇中含有4个碳原子、10个氢原子、3个氧原子,分子式为,A正确;
B.根据右图第一步反应的产物可知,X的结构简式为,B错误;
C.氧的电负性强于碳,从而使得碳氧键的共用电子对偏向氧,故H+进攻环氧乙烷中的氧原子,C正确;
D.由图可知,环氧乙烷与水反应生成乙二醇,反应过程中氢离子为催化剂,则制备乙二醇总反应为,D正确;
故选B。
11. 哈伯法合成氨的反应原理为,新研制的催化剂可使该反应在常温、常压下进行。下列有关哈伯法合成氨反应的说法正确的是
A. 该反应在低温下能自发进行,则
B. 选用高效催化剂,可降低该反应的
C. 其它条件不变,增大起始的比值,可提高N2的平衡转化率
D. 提高体系的压强可增大反应的化学平衡常数
【答案】A
【解析】
【详解】A.该反应为熵减小的反应,若该反应能自发进行,则,A正确;
B.催化剂不能改变反应的,B错误;
C.其它条件不变,增大起始的比值,即相当于氢气量不变时,增加氮气的用量,平衡正向移动,可提高H2的平衡转化率,N2的平衡转化率减小,C错误;
D.化学平衡常数只与温度有关,温度不变,平衡常数不变,D错误;
故选A。
12. H2C2O4为二元弱酸。20℃时,配制一组c(H2C2O4)+c(HC2O)+c(C2O)=0.100ml•L﹣1的H2C2O4和NaOH混合溶液,溶液中部分微粒的物质的量浓度随pH的变化曲线如图所示。下列指定溶液中微粒的物质的量浓度关系一定正确的是
A. pH=2.5的溶液中:c(H2C2O4)+c(C2O)>c(HC2O)
B. c(Na+)=0.100 ml•L﹣1的溶液中:c(H+)+c(H2C2O4)=c(OH﹣)+c(C2O)
C. c(HC2O)=c(C2O)的溶液中:c(Na+)>0.100 ml•L﹣1+c(HC2O)
D. pH=7溶液中:c(Na+)< 2c(C2O)
【答案】B
【解析】
【详解】A.由图象可知,pH=2.5的溶液中c( )和c( )浓度之和小于c( ),则c()+c()
C.c()+c()+c()=0.100ml⋅L−1,c()=c(),电荷守恒c(H+)+c(Na+)=2c()+c()+c(OH−),pH约4,此时氢离子浓度大于氢氧根,得到溶液中c(Na+)<0.100ml⋅L−1+c(),故C错误;
D.20℃时,Kw=0.681×10−14,pH=7的溶液显酸性,c(H+)>c(OH−),根据电荷守恒c(H+)+ c(Na+)=2c()+c()+c(OH−)可知:c(Na+)>2c(),故D错误;
故选:B。
13. 在催化剂作用下,氧化可获得。其主要化学反应如下:
反应Ⅰ.
反应Ⅱ.
压强分别为、时,将和的混合气体置于密闭容器中反应,不同温度下体系中乙烷的平衡转化率、乙烯的选择性[]如图所示。下列说法正确的是
A.
B. 压强为、温度为210℃时,反应达平衡时,
C. 的选择性下降的原因可能是随着温度的升高,反应Ⅱ中生成的抑制了反应Ⅰ的进行
D. 研发低温下转化率高和选择性高的催化剂,可以提高平衡时产率
【答案】C
【解析】
【详解】A.相同温度下,增大压强,反应Ⅰ、Ⅱ均逆向移动,乙烷平衡转化率降低,所以,故A错误;
B.压强为、温度为210℃时,乙烷的转化率为50%,乙烯的选择性为80%,参与反应Ⅰ的乙烷为,反应Ⅰ生成的乙烯、一氧化碳都是,参与反应Ⅱ的乙烷为,反应Ⅱ生成的一氧化碳是,反应达平衡时,生成的总物质的量为,生成乙烯的总物质的量为,故B错误;
C.温度升高,反应Ⅰ和反应Ⅱ受温度影响,平衡都会正向移动,由图可知,温度升高的过程中乙焼的转化率逐渐增大,但乙烯的选择性却逐渐降低,说明温度升高的过程中,反应Ⅱ为主,且生成的抑制了反应Ⅰ的进行,故C正确;
D.反应Ⅰ正向为吸热反应,温度升高更有利于的生成,因此为提高平衡时的产率,可研发高温下选择性高的催化剂,故D错误;
故选C。
二、非选择题:共4小题,共61分
14. 已知常温下部分弱电解质的电离平衡常数如表:
(1)常温下,pH相同的三种溶液①NaF溶液;②NaClO溶液;③Na2CO3溶液,其物质的量浓度由大到小的顺序是_______。(填序号)
(2)向足量的次氯酸钠中通入少量的二氧化碳的离子方程式_______。
(3)室温下,经测定溶液,则_______(填“>”、“=”、“<”)。
(4)时,将的氨水与的盐酸等体积混合所得溶液中,则溶液显_______(填“酸”“碱”或“中”)性;用含a的代数式表示的电离平衡常数_______。
(5)将含的烟气通入该氨水中,当溶液显中性时,溶液中_______。
【答案】(1)①>②>③
(2)
(3)> (4) ①. 中 ②.
(5)0.6
【解析】
【小问1详解】
由HF、HClO、的电离常数,可得出三者的水解常数关系Kh(F-)<Kh(ClO-)<Kh(),水解常数越小,生成相同c(OH-)所需的盐的浓度越大,则常温下,pH相同的三种溶液①NaF溶液;②NaClO溶液;③Na2CO3溶液,其物质的量浓度由大到小的顺序是①>②>③。
【小问2详解】
向足量的次氯酸钠中通入少量的二氧化碳,由于Ka1(H2CO3)>Ka(HClO)>Ka2(H2CO3),所以只能生成NaHCO3等,离子方程式为。
【小问3详解】
室温下,经测定溶液,表明Ka()>Kh(),则>。
【小问4详解】
时,将的氨水与的盐酸等体积混合所得溶液中,依据电荷守恒,可得出c(H+)=c(OH-),则溶液显中性;的氨水与的盐酸等体积混合所得溶液中,= ml∙L-1,c()=ml∙L-1,c(OH-)= 1×10-7ml∙L-1,则用含a的代数式表示的电离平衡常数==。
【小问5详解】
将含SO2的烟气通入该氨水中,当溶液显中性时,Ka2(H2SO3)== 6.0×10-8,则溶液中==0.6。
15. 化合物G是合成一种镇痛药物的重要中间体,其合成路线如图。
注:为四氢呋喃、为、为、为
(1)的反应类型为_______。
(2)G中所含官能团名称为腈基、_______、_______。
(3)设计步骤③的目的是_______。
(4)A的一种同分异构体同时满足下列条件,写出任意一个该同分异构体的结构简式:______。
①分子中含有苯环,且苯环上只有一种化学环境的氢原子;
②分子中不含甲基;
③分子和足量溴水反应,消耗。
(5)已知:。设计以为原料制备的合成路线_______。(无机试剂和有机溶剂任选,合成路线示例见本题题干)
【答案】(1)还原反应
(2) ①. 醚键 ②. 碳碘键
(3)保护酚羟基,防止其在步骤④中发生反应
(4) (写出任意一个即可)
(5)
【解析】
【分析】A中羰基被加成生成B,B中醇羟基去掉氧原子生成C,C中酚羟基上的氢原子被-Ts取代生成D,D中苯环上的氢原子被碘原子取代生成E,E中-Ts被氢原子取代生成F,F中酚羟基上氢原子被-CH2CN取代生成G。
【小问1详解】
B→C的过程是去氧过程,故B→C的反应类型为还原反应;
【小问2详解】
G中所含官能团名称为腈基、醚键、碳碘键;
【小问3详解】
通过③④⑤反应,由C即转变为F即,就是在苯环上新引入一个碘原子,而③→④→⑤期间,经历了由-OH→-OTs→-OH的过程,可见设计步骤③的目的是保护酚羟基,防止其在步骤④中发生反应;
【小问4详解】
A中含有9个C原子、3个氧原子,不饱和度为5,其同分异构体满足:①分子中含有苯环,且苯环上只有一种化学环境的氢原子,而根据不饱和度可知,其侧链上一定有一个双键,所以不可能所有取代基相同,则其侧链上至少有4个取代基,且其中至少两个相同,②分子中不含甲基,根据原子个数可知,一定含有碳碳双键和酚羟基;③1ml该分子和足量的溴水反应,消耗3ml Br2,碳碳双键消耗1ml,则还需酚羟基的邻对位有2个空位,所以满足条件的有;
【小问5详解】
要以为原料制备。据分析,结合逆合成分析法可知:先要得到仿照流程中反应②,由和发生信息反应即可得到,需要和镁粉在乙醚中反应获得,与原料相比,原料中1个羟基被溴原子取代、1个被催化氧化,羟基所连碳上没有氢原子(叔醇)的不会发生氧化反应、羟基所连碳上有2个氢原子(伯醇)的可以被氧化为醛基,则氧化反应先发生、取代反应后发生,所以可由与HBr发生取代反应获得、则由在铜催化下被氧气氧化得到;综上,合成线路为: 。
16. 研究氨的制备、应用及氨氮的去除有重要意义。
(1)在固定体积的密闭容器中,进行如下化学反应:,其平衡常数K与温度T的关系如下表。
①试判断_______(填写“>”“=”或“<”)
②一定温度下,在密闭容器中充入和并发生反应。若容器容积恒定,达到平衡时,气体的总物质的量为原来的,则的转化率_______,以表示该过程的反应速率_______。
(2)氨的应用。以和为原料在一定温度和压强下合成尿素的反应分两步:
I.和生成;
Ⅱ.分解生成。
反应过程中能量变化如图所示。
①写出和合成尿素反应的热化学方程式为_______。
②结合反应过程中能量变化示意图,下列说法正确的是_______(填序号)。
a.活化能:反应I<反应Ⅱ
b.I为放热反应,Ⅱ为吸热反应
c.对总反应速率影响较大的是反应I
(3)氨氮的去除。下面是两种电化学除氨氮的方法。
方法一:电化学氧化法
有研究表明,当以碳材料为阴极,可在阴极生成,并进一步生成氧化性更强的,可以将水中氨氮氧化为。
①写出去除氨气的化学反应方程式_______。
②阴极区加入可进一步提高氨氮的去除率,结合如下图,用化学方程式、电极反应式和文字解释的作用_______。
方法二:电化学沉淀法
用溶液模拟氨氮废水,以镁作阳极、不锈钢作阴极进行电解,可将废水中的转化为沉淀而除去。调节溶液初始,氨氮去除率和溶液随时间的变化情况如图所示。
③电解时两极反应式分别为:,。写出废水中生成沉淀离子方程式:_______。
④反应1h以后,氨氮去除率随时间的延长反而下降的原因是_______。
【答案】(1) ①. > ②. ③.
(2) ①. ②. ab
(3) ①. ②. ,向阴极移动,阴极发生,再生,循环使用 ③. ④. 反应1h后,随着溶液中和的增大,会形成或沉淀(或者碱性条件下生成的沉淀会部分转化为或沉淀,释放铵根离子,促使溶液中氨氮的去除率下降。
【解析】
【小问1详解】
①为放热反应,升高温度,平衡逆向移动,平衡常数减小,所以K1>K2;
②平衡时气体的总物质的量为原来的,则平衡后气体总物质的量为(1ml+3ml)×=3.5ml,反应三段式为:
则1-x+3-3x+2x=3.5,解得x=0.25,所以N2的转化率α(N2)=×100%=25%,平衡时氨气的物质的量为0.25ml×2=0.5ml,v(NH3)===0.025ml/(L·min);
【小问2详解】
①由图像可知,;
②由题干图示信息可知,E1<E3,即活化能:反应I<反应Ⅱ,a正确;反应I的反应物总能量大于生成物的总能量为放热反应,反应Ⅱ的反应物总能量小于生成物的总能量为吸热反应,b正确;总反应的速率取决于速率较慢的一步,活化能越大,反应速率越慢,故总反应取决于反应Ⅱ,c错误;答案选ab。
【小问3详解】
①·OH可以将水中氨氮氧化为N2,则·OH去除氨气的化学反应方程式为;
②根据示意图可知存在反应:H2O2+Fe2+=Fe3++·OH+OH-,Fe3+向阴极移动,阴极发生Fe3++e−=Fe2+,Fe2+再生,从而循环使用,因此阴极区加入Fe2+可进一步提高氨氮的去除率;
③根据示意图可知电解过程中阴极水电离出的氢离子放电,电极反应式为2H2O+2e-=2OH-+H2↑;阳极产生的镁离子、阴极产生的氢氧根离子与铵根离子和磷酸二氢根离子反应生成沉淀,反应的方程式为Mg2++2OH-++=MgNH4PO4↓+2H2O;
④反应1h后,随着溶液中和的增大,会形成或沉淀(或者碱性条件下生成的沉淀会部分转化为或沉淀,释放铵根离子,促使溶液中氨氮的去除率下降。
17. CO2的资源化利用能有效减少碳排放充分利用碳资源。
I.CO2合成甲醇(CH3OH)
该反应包括下列两步:
反应I CO2(g)+H2(g)CO(g)+ H2O(g) △H1=+40.9 kJ/ml
反应II CO2(g)+3H2(g)CH3OH(g)+ H2O(g) △H2=+49.5 kJ/ml
(1)由CO与H2合成CH3OH(g)的热化学方程式为_______。
(2)在一定温度下,向体积为2 L的恒容密闭容器中充入3mlH2和1mlCO2,控制条件仅发生反应I,测得CO2、CH3OH(g)和H2O(g)的物质的量(n)随时间的变化如图所示:
①0~3min内,用H2(g)表示的化学反应速率v(H2)=_______。
②在平衡后,再向容器中加入2ml CO2(g)和2ml CH3OH(g)则平衡向_______移动。(填“正反应方向”“逆反应方向”或“不移动”)。
(3)在光电催化下CO2可以合成甲醇,原理如图所示。阴极的电极反应式为_______。
II.CO2合成二甲醚(CH3OCH3)
控制反应条件,同时发生反应Ⅰ、反应Ⅱ和反应Ⅲ,可以合成二甲醚(CH3OCH3)。
反应Ⅲ 2CH3OH(g)CH3OCH3(g)+H2O(g) △H=-24.5 kJ/ml
在压强30 MPa、=4时, CO2的平衡转化率、CO的选择性和CH3OCH3的选择性随温度变化情况如图所示(X的选择性=)
(4)图中,代表CH3OCH3选择性的是曲线_______(填“A”、“B”或“C”)。
(5)当温度超过290℃,曲线B随温度升高而增大的原因是_______。
【答案】(1)CO(g)+ 2H2(g)CH3OH(g) △H=8.6 kJ/ml
(2) ①. ②. 正反应方向
(3)
(4)A (5)生成CO的反应为吸热反应,高温有利于反应向生成CO方向进行,从而提高其选择性
【解析】
【小问1详解】
根据盖斯定律,CO与H2合成CH3OH(g)的反应可由反应II-反应I得到,反应的反应热△H=△H2-△H1=+49.5 kJ/ml -40.9 kJ/ml=8.6 kJ/ml,反应的热化学方程式为:CO(g)+ 2H2(g)CH3OH(g) △H=8.6 kJ/ml,故答案为:CO(g)+ 2H2(g)CH3OH(g) △H=8.6 kJ/ml;
【小问2详解】
①0~3min内,的物质的量由1ml减少至0.25ml,,根据速率之比等于化学计量数之比可得,故答案为:;
②反应达到平衡时:各物质的浓度为:c(CH3OH)=c(H2O)=,c(CO2)= ,c(H2)= ,可得反应平衡常数K==,再向容器中加入2ml CO2(g)和2ml CH3OH(g),此时刻c(CO2)= ,c(CH3OH)= ,此时Qc==<,反应正向移动,故答案为:正反应方向;
【小问3详解】
由图可知阴极二氧化碳转化成甲醇且电解质为酸性环境,电极反应为:,故答案为:;
【小问4详解】
CO2(g)的反应均为吸热反应,温度升高二氧化碳的转化率增大,因此曲线C代表二氧化碳的转化率;有选择性的表达式可知生成二甲醚的选择性高于生成CO的选择性,因此曲线A代表二甲醚的选择性,曲线B代表生成CO的选择性,故答案为:A;
【小问5详解】
生成CO的反应为吸热反应,随温度的升高有利于反应正向移动,使得CO的选择性逐渐增大,故答案为:生成CO的反应为吸热反应,高温有利于反应向生成CO方向进行,从而提高其选择性;A.所示的实验:制取FeCO3
B.所示的实验:用NaOH溶液滴定盐酸
C.用装置除去甲烷中的乙烯,以得到纯净的甲烷
D.所示的实验:根据两烧瓶中气体颜色的变化(热水中变深、冰水中变浅)可以判断的正反应是吸热反应
选项
目的
方案设计
现象和结论
A
探究温度对化学平衡的影响
将2mL0.5ml/L的CuCl2溶液加热后置于冷水中,观察现象
若溶液由黄绿色变为蓝色,说明降低温度,平衡向逆方向移动:
[Cu(H2O)4]2++4Cl-[CuCl4]2﹣+4H2O
B
判断某卤代烃中的卤素
取2 mL卤代烃样品于试管中,加入5 mL 20% KOH水溶液混合后加热,再滴加AgNO3溶液
若产生的沉淀为白色,则该卤代烃中含有氯元素
C
探究FeCl3溶液与KI溶液的反应
向10mLFeCl3溶液中滴加5mL等浓度的KI溶液,充分反应后,再滴加KSCN溶液,观察现象
若溶液最终变为血红色,FeCl3溶液与KI溶液的反应为可逆反应
D
检验食品脱氧剂中还原铁粉是否已变质
取脱氧剂包装内固体粉末于试管中,加足量稀盐酸溶解,充分反应后滴加KSCN溶液,振荡,观察溶液颜色变化
若溶液未变红色,说明脱氧剂中还原铁粉没有变质
化学式
电离常数
T/K
298
398
498
平衡常数K
江苏省无锡市江阴市三校联考2023-2024学年高二下学期4月期中联考化学试题(原卷版+解析版): 这是一份江苏省无锡市江阴市三校联考2023-2024学年高二下学期4月期中联考化学试题(原卷版+解析版),文件包含江苏省无锡市江阴市三校联考2023-2024学年高二下学期4月期中联考化学试题原卷版docx、江苏省无锡市江阴市三校联考2023-2024学年高二下学期4月期中联考化学试题解析版docx等2份试卷配套教学资源,其中试卷共24页, 欢迎下载使用。
江苏省无锡市江阴市四校联考2023-2024学年高一下学期4月期中考试化学试题(原卷版+解析版): 这是一份江苏省无锡市江阴市四校联考2023-2024学年高一下学期4月期中考试化学试题(原卷版+解析版),文件包含江苏省无锡市江阴市四校联考2023-2024学年高一下学期4月期中考试化学试题原卷版docx、江苏省无锡市江阴市四校联考2023-2024学年高一下学期4月期中考试化学试题解析版docx等2份试卷配套教学资源,其中试卷共22页, 欢迎下载使用。
江苏省无锡市江阴市三校2023-2024学年高一下学期4月期中联考化学试题(原卷版+解析版): 这是一份江苏省无锡市江阴市三校2023-2024学年高一下学期4月期中联考化学试题(原卷版+解析版),文件包含江苏省无锡市江阴市三校2023-2024学年高一下学期4月期中联考化学试题原卷版docx、江苏省无锡市江阴市三校2023-2024学年高一下学期4月期中联考化学试题解析版docx等2份试卷配套教学资源,其中试卷共20页, 欢迎下载使用。












