

人教版 (2019)必修 第二册第五章 化工生产中的重要非金属元素第二节 氮及其化合物图片课件ppt
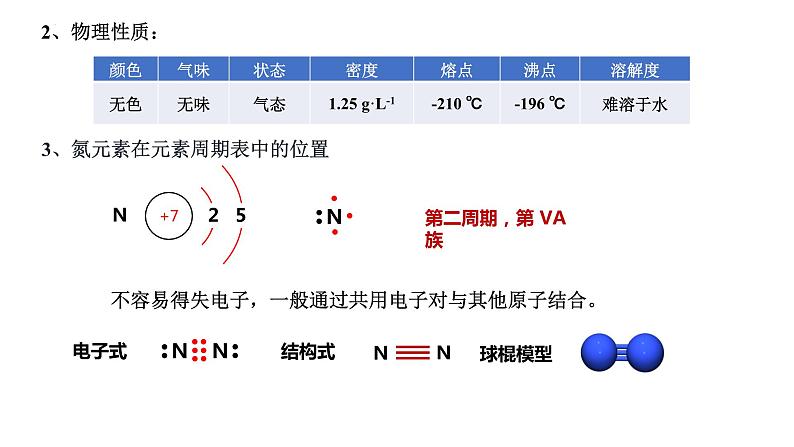
展开3、氮元素在元素周期表中的位置
不容易得失电子,一般通过共用电子对与其他原子结合。
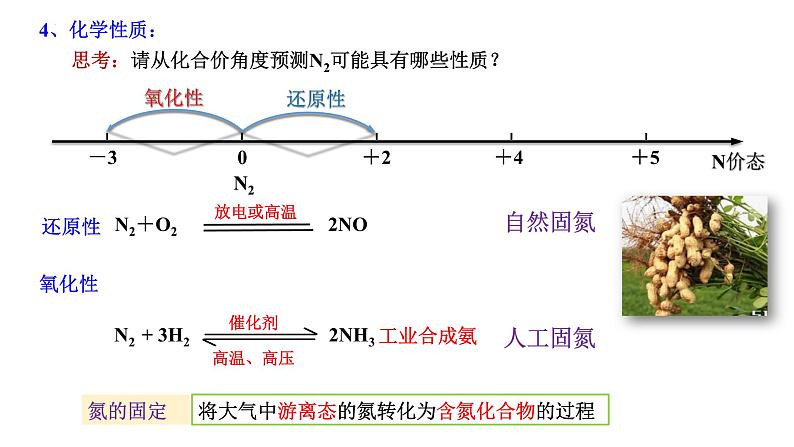
思考:请从化合价角度预测N2可能具有哪些性质?
将大气中游离态的氮转化为含氮化合物的过程
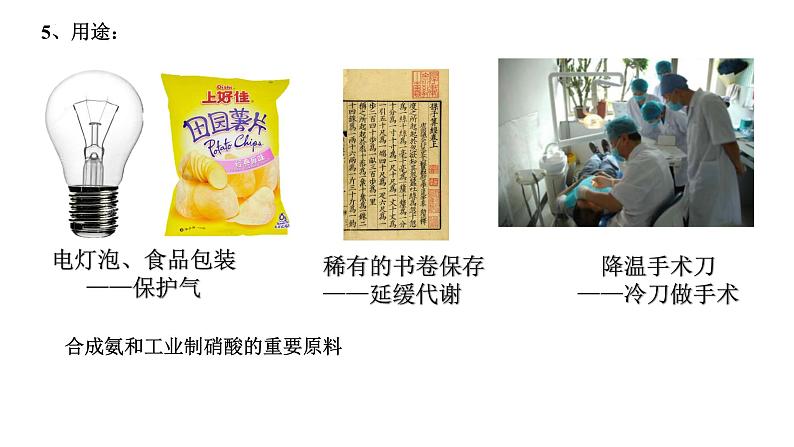
电灯泡、食品包装——保护气
降温手术刀——冷刀做手术
稀有的书卷保存——延缓代谢
合成氨和工业制硝酸的重要原料
在新疆和青海交界处有一狭长山谷,每当牧民和牲畜进入后, 风和日丽的晴天顷刻间电闪雷鸣,狂风大作,人畜往往遭雷击 倒下。奇怪的是这里的牧草茂盛,四季常青,被当地牧民称为“魔鬼谷”。 你能解释“魔鬼谷”牧草茂盛、四季常青的原因吗?
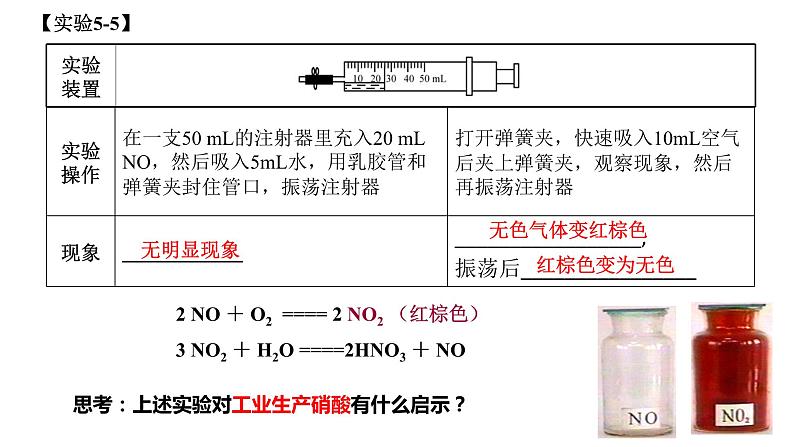
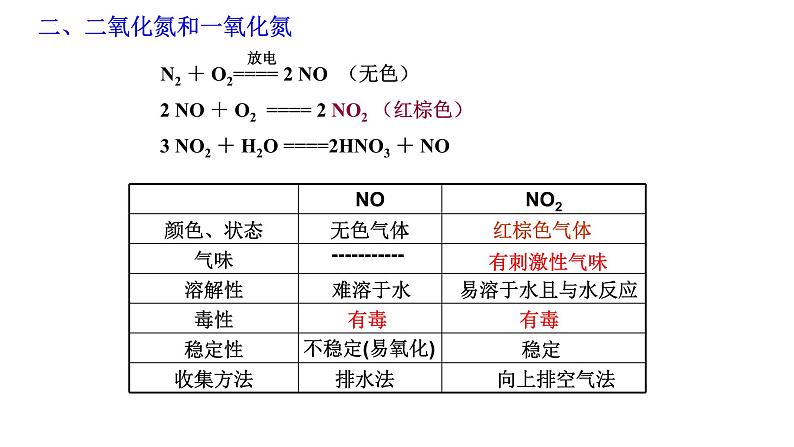
3 NO2 + H2O ====2HNO3 + NO
2 NO + O2 ==== 2 NO2 (红棕色)
思考:上述实验对工业生产硝酸有什么启示?
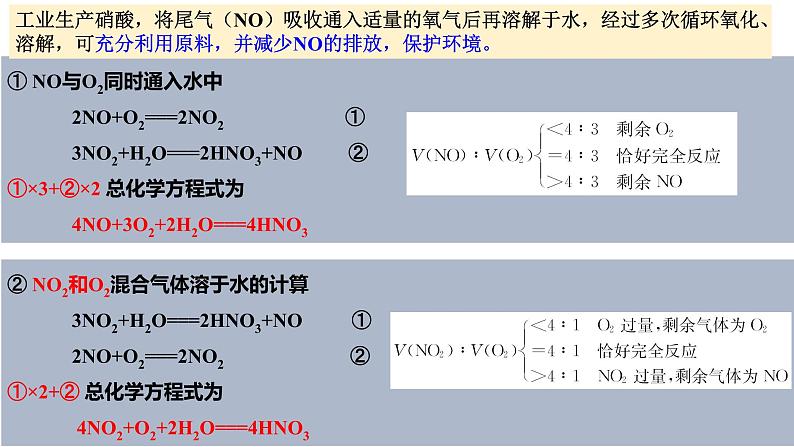
① NO与O2同时通入水中 2NO+O2===2NO2 ① 3NO2+H2O===2HNO3+NO ②①×3+②×2 总化学方程式为 4NO+3O2+2H2O===4HNO3
工业生产硝酸的启示
② NO2和O2混合气体溶于水的计算 3NO2+H2O===2HNO3+NO ① 2NO+O2===2NO2 ②①×2+② 总化学方程式为 4NO2+O2+2H2O===4HNO3
工业生产硝酸,将尾气(NO)吸收通入适量的氧气后再溶解于水,经过多次循环氧化、溶解,可充分利用原料,并减少NO的排放,保护环境。
二、二氧化氮和一氧化氮
-----------
俗语:雷雨肥庄稼?大家知道什么意思吗?
(2)制造硝酸、化肥和炸药;
(1)为火箭发射提供能量
1998年诺贝尔奖获得者伊格纳罗发现少量的NO在生物体内许多组织中存在,它有扩张血管、免疫、增强记忆等功能,成为当前生命科学的研究热点,NO亦称为“明星分子”。
讨论:1、下列气体中只能用排液法收集的是( ) 不能用排水溶液的方法收集的是( ) A. CO2 B. NO C. H2 D. NO2
2.某无色气体可能由O2、NO、NO2、N2、CO2中的一种或几种组成,该混合气经放电后变成红棕色。原混合气的成分中一定含有( ) A. N2、O2、NO B. N2、O2、CO2 C. N2、NO D. N2、O2
3. N2和O2的混合气aL,通过高压放电,发生反应后恢复到原来温度和压强时,气体体积仍为aL,则原混合气体中,N2和O2的质量比是 ( ) A. 任意比 B. 7:8 C. ≥7:8 D. <7:8
讨论: a、b、c、d四支同容积的试管相同条件下分别充入等体积的两种气体(两气体体积比为1:1 )。a管内是NO和O2,b管内是NO2和O2,c管内是NO和NO2,d 管内是NO和N2。将这四支试管都倒插入有足量水的水槽中,水面上升高度应是( ) A.a>b>c>d B.b>a>c>d C.a>c>b>d D.b>c>a>d
O2及NOx的混合物溶于水的计算
1、NO2(NO2+N2、NO2+NO)溶于水
3NO2+H2O = 2HNO3+NO
讨论:标况下,一充满NO2的试管倒立水中,液面上升,假设试管中溶液不扩散, 求试管中硝酸溶液的物质的量浓度?
1/22.4 ml•L-1
2、 NO和O2的混合物溶于水
3NO2+H2O = 2HNO3+NO
2NO+O2=2NO2
总式: 4NO+3O2+2H2O=4HNO3
讨论: 如图, 容积为50mL的容器充满O2和NO,倒置于水槽中, 打开开关阀K,让NO和O2相通,充分反应后,试管内剩余 气体体积为8mL,求原O2和NO的体积。
若剩余气体为O2,NO为24mL,O2为26mL
若剩余气体为NO,NO为32mL,O2为18mL
3、 NO2和O2的混合物溶于水
2NO+O2=2NO2
3NO2+H2O = 2HNO3+NO
总式: 4NO2+O2+2H2O=4HNO3
讨论:将容积为50mL的量筒内充满NO2与O2的混合气体,倒置在盛满水的水槽中, 充分反应后,剩余5mL气体,则混合气体中NO2与O2的体积比可能是
18 :7 或 43 :7
某年某月某日,位于巴南区的“西南饮料食品厂”再次发生严重的氨气泄漏事故。空气中弥漫着刺鼻的化学气味,现场上空犹如下雾一般,白茫茫一片,寒气逼人,氨气浓度之高让人不敢靠近。事发两个小时后,现场的氨气浓度仍然让人窒息。
防化兵在水幕的保护下,一点一点接近氨气罐
氨是无色,有刺激性气味的气体,
极易溶于水(1 :700)
(1)氨为什么会形成喷泉?
氨气极易溶于水,使烧瓶内压强减小,瓶内外形成较大的压强差;大气压将水压入烧瓶。
(2)喷泉实验成功的关键?
a.装置的气密性好;b.气体的纯度高;c.烧瓶必须干燥。
(3)若V L烧瓶充满标况下的氨气,喷泉实验后溶液充满整个烧瓶, 所得溶液的物质的量浓度是________________。
氨极易溶于水,氨水显弱碱性
挤压滴管,气体溶解,P内
(2)常见形成喷泉实验的气体与试剂
容器内外产生较大的压强差
① 氨水中含有的主要微粒有:
分子:H2O、NH3、NH3•H2O
③ NH3•H2O不稳定
注意:计算氨水的质量分数时,以NH3为溶质。
② 氨水密度小于水(氨水浓度越大,密度越小)
关于氨水——氨的水溶液
氨水是一种不稳定、易挥发的一元弱碱
离子:NH4+、OH-
NH3·H2O、H2O、NH3、NH4+、OH- 、H+(少量)
讨论2:相同条件下在三个体积不相同的烧瓶中,分别充满NH3、HCl、NO2,将它们分别用水进行喷泉实验,实验完毕后,三个烧瓶中所得溶液物质的量浓度之比是( )A、1∶1∶1 B、3∶3∶2 C、3∶3∶1 D、1∶1∶2
讨论1:在1L 1ml/L的氨水中( )A、含有1ml NH3 B、含NH3和NH4+的物质的量之和为1ml C、含1ml NH3• H2O D、含NH3、 NH3• H2O和NH4+的物质的量之和为1ml
3、已知25%的氨水的密度为0.91g • cm-3, 5%的氨水的密度为0.98g • cm-3,若将上述两种溶液等体积混合,所得溶液的质量分数 ( )A、等于15% B、大于15%C、小于15% D、无法估算
4、在标准状况下,44.8L氨气溶于1L水中,所得氨水的物质的量浓度为( )A、>2ml/L B、<2ml/LC、2ml/L D、无法确定
NH3 + HCl = NH4Cl(白色固体)
NH3+HNO3=NH4NO3(产生白烟)
氨气通入硫酸中 2NH3+H2SO4=(NH4)2SO4
结论:(1)盐酸、氨水均具有挥发性, (2)NH3 、HCl不能共存。
思考:若把浓盐酸换成浓硝酸、浓硫酸、现象如何?
氨气与酸反应一般生成相应的铵盐。
NH3+H+=NH4+(与酸反应的本质)
(3)与某些盐溶液反应:
Al3 + +3NH3+3H2O ==== Al(OH)3↓+3NH4+
2NH3+CO2(少)+H2O=(NH4)2CO3
NH3+CO2(足)+H2O=NH4HCO3
NH4HCO3+NaCl=NaHCO3↓+NH4Cl
讨论:某同学用下图所示装置作氨催化实验,向浓氨水中缓缓通入空气,并同时将红热螺旋状铂伸入瓶中接近氨水液面,回答以下问题:(1)若在反应过程中铂丝继续保持红热,说明该反应过程______(填“吸热”或“放热”)(3)若在实验过程中看到瓶内有白烟生成,试用化学方程式表示出产生白烟全过程的变化为:
2NO+O2=2NO2
3NO2+H2O=2HNO3+NO
NH3+HNO3=NH4NO3
③3Cl2+2NH3(少量)=N2+6HCl 3Cl2+8NH3(过量)= 。
用途:用于检验氯气管道是否泄露,现象 。
讨论:某无色混合气体可能由NO、O2、CO2、NH3、CO、HCl中的一种或几种组成,室温下取此混合气体100mL通过足量浓H2SO4后,气体体积减少到80mL;再通过足量NaOH溶液,气体体积减少到40mL,余下气体接触空气后立即变红棕色,由此推断原混合气体中一定有 ,一定没有 ,可能有 。
NH3、CO2、NO
绝大多数铵盐是白色或无色晶体,绝大多数铵盐易溶于水
由NH4+和酸根离子组成的化合物叫铵盐。铵盐都是晶体,为离子化合物。
(了解:溶于水时水温降低。)
(1)热不稳定性:受热易分解
NH3 + HCl = NH4Cl
注意:NH4Cl受热分解,产生的气体冷却又生成NH4Cl,
注意:不是所有的铵盐受热分解都生成氨气。
都产生NH3,非氧化还原反应
无NH3产生,是氧化还原反应
思考: 舞台幕布与布景多是用浓氯化铵溶液浸过制成的,可以防火,其原因是什么?
注意: 铵盐与强碱反应的离子方程式的书写
浓溶液 不加热 NH4++OH - = NH3↑ +H2O
稀溶液 不加热 NH4++OH - = NH3• H2O
固态反应 无离子方程式
原理:利用与碱的反应检验NH4+离子的存在
讨论: NH4+的检验
操作:向样品中加入碱溶液,加热, 若放出的气体能使湿润的红色石蕊试纸变蓝,证明含NH4+。
实验室常用氨盐与碱反应制氨气
注意:碱一般不用NaOH,因为其对玻璃有较强的腐蚀作用。
用润湿的红色石蕊试纸或无色酚酞试纸放于瓶口
注意:收集时,导管要插入管底,且管口要塞一团棉花(减弱与空气的对流)
注意:不能用浓H2SO4、P2O5 ,也不能用无水CaCl2干燥。
(1)在试管口放一团用酸溶液或水浸湿的棉花球;
(2)直接将导管通入装酸溶液或水的烧杯中
讨论:下列各方法中,不能用于实验室制NH3的是( )A、对浓氨水进行加热 B、加热NH4Cl或NH4HCO3分解C、加热(NH4)2SO4和消石灰混合物 D、向浓氨水中加入固体CaO或碱石灰等
思考:除了利用上述方法之外,实验室有无其它简单可行的方法来制得氨气?
NH3·H2O+CaO == Ca(OH)2+NH3↑
复习本节学习内容;《升华》第一课时 P76~77 知识点一、 P78 知识点二典例4及知识应用《升华》 P80~81 随堂练习 1、3、4题4. 《活页》 P51~52 第一课时4、5、9题
思考:请你根据氮的价-类二维图预测NH3的化学性质
纯硝酸是无色、有刺激性气味、易挥发,与水以任意比混溶的液体,比水重,沸点低。
质量分数为69%的硝酸为浓硝酸;
质量分数为98%以上的硝酸为发烟硝酸。
硝酸越浓,越容易分解,分解放出的NO2溶于硝酸而使硝酸呈黄色。
注意: 浓盐酸呈黄色是因为其含有Fe3+
保存:硝酸盛放于棕色瓶中,置于冷暗处
Cu + 4HNO3(浓) = Cu(NO3)2 +2NO2 ↑+ 2H2O
3Cu + 8HNO3(稀) = 3Cu(NO3)2 +2NO ↑+ 4H2O
--- 氧化剂、酸性作用
Cu + 4H+ +2NO3- = Cu2+ + 2NO2↑+ 2H2O
3Cu + 8H++2NO3- = 3Cu2+ + 2NO↑+ 4H2O
硝酸无论浓稀都具有氧化性,硝酸越浓,氧化性越强;
讨论2:能否由还原产物化合价的变化多少推出氧化性稀硝酸强?
还原产物:浓硝酸→NO2 稀硝酸→NO
思考:同学们在做铜与浓硝酸反应的实验时,发现反应后的溶液呈绿色,而不显蓝色。甲同学认为是该溶液中硝酸铜的质量分数较高所致,而乙同学认为是该溶液中溶解了生成的气体。同学们分别设计了以下4个实验来判断两种说法是否正确,这些方案中不可行的是( )A.加水稀释该绿色溶液,观察溶液颜色变化B.加热该绿色溶液,观察溶液颜色变化C.向该绿色溶液中通入氮气,观察溶液颜色变化D.向饱和硝酸铜溶液中通入浓硝酸与铜反应产生的气体,观察溶液颜色变化
总 结: 1、硝酸几乎能氧化除金、铂等少数几种金属外的所有金属, 通常不产生H2 。
2、有些金属如,Fe、Al与冷、浓硝酸发生钝化现象。 故浓硝酸可用Fe、Al罐盛装。
3、王水---浓硝酸、浓盐酸体积比1 :3配成的混合液, 可氧化金、铂
讨论:试写出铁与稀硝酸反应的化学方程式
Fe + 4HNO3(稀) = Fe(NO3)3 + NO↑+ 2H2O
3Fe + 8HNO3(稀) = 3Fe(NO3)2 + 2NO↑+ 4H2O
浓硝酸能氧化 C、S、P 等非金属
(3)与还原性化合物反应
3SO2 + 2H2O + 2NO3- = 3SO42- + 2NO↑ + 4H+
3Fe2+ + 4H+ + NO3- = 3Fe3+ + NO↑ + 2H2O
浓硝酸 使Fe、 Al 钝化
Cu+2H2SO4 (浓)===CuSO4+SO2↑+2H2O
Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O
3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O
4HNO3(浓)+C=4NO2↑+CO2↑+2H2O
2H2SO4(浓)+C==2SO2↑+CO2↑+2H2O
硝酸是重要的化工原料,用于制化肥、农药、炸药、染料等。工业上制硝酸的原理是将氨经过一系列反应得到硝酸,如下图所示:
(1) 写出每一步反应的化学方程式。(2) 请分析上述反应中的物质类别和氮元素化合价的变化情况,以及每一步反应中含氮物质发生的是氧化反应还是还原反应。
写出有关化学方程式:N2→NH3: ________________________________。NH3→NO: _______________________________。NO→NO2: _______________________________。NO2→HNO3: _____________________________。
2NO+O2 === 2NO2
3NO2+H2O === 2HNO3+NO
4NH3+5O2 4NO+6H2O
2、取三张蓝色石蕊试纸,放在表面皿上,然后按顺序分别滴加69%的HNO3,98.3%的H2SO4和新制的氯水,三张试纸最后呈现的颜色是( ) A、白、红、白 B、红、黑、红 C、红、红、红 D、白、黑、白
3. 下述实验中均有红棕色气体产生,分析所得结论错误的是 ( )
A. 由①中的红棕色气体,推断产生的气体一定是混合气体B. 红棕色气体不能表明②中木炭与浓硝酸发生了反应C. 由③说明浓硝酸具有挥发性,生成的红棕色气体为还原产物D. ③的气体产物中检测出CO2,由此说明木炭一定与浓硝酸发生了反应
4、等质量的铜分别与足量的下列各种酸反应,生成的气体在相同条件下体积最大的是( ) A、浓HNO3 B、稀HNO3 C、浓H2SO4 D、稀H2SO4
方法一:根据方程式计算
5、铜与1ml/L的硝酸反应,如果NO3-浓度下降0.2ml/L。则溶液 中,氢离子的物质的量浓度同时下降( )A、0.2ml/L B、0.4ml/L C、0.6ml/L D、0.8ml/L
6、38.4g铜与适量浓硝酸反应,铜完全溶解,共收集到气体标准状况下22.4L。反应中耗硝酸物质的量可能是( ) A 1.0 ml B 1.6 ml C 2.2 ml D 2.4 ml
若38.4 g铜与硝酸恰好完全反应,未被还原的硝酸物质的量为?
7. 铜和镁的合金4.6 g完全溶解于浓硝酸中,若反应中硝酸被还原只产生4.48 L的NO2气体和0.224 L的NO气体(气体体积已折算到标准状况),在反应后的溶液中,加入足量的NaOH溶液,生成沉淀的质量为( )A 9.02 g B 8.51 g C 8.26 g D 7.04 g
解法一:质量守恒和得失电子守恒
m(氢氧化物)=m(金属)+ m(OH-)
n(OH-)=n(金属失电子)
=n(HNO3得电子)
解法二:关系式法(得失电子守恒)
8. 将32.64g铜与140mL一定浓度的硝酸反应,铜完全溶解产生的NO和NO2混合气体在标准状况下的体积为11.2L。请回答:(1)NO的体积为_________L,NO2的体积为_________L。(2)待产生的气体全部释放后,向溶液中加入VmLaml/L的NaOH溶液,恰好使溶液中的Cu2+全部转化成沉淀,则原硝酸溶液的浓度为____________________ (3)欲使铜与硝酸反应生成的气体在NaOH溶液中全部转化为NaNO3,至少需要30%的双氧水_________g。
酸 性:与非还原性的碱、碱性氧化物、盐
酸性和氧化性:与金属、还原性的碱、 碱性氧化物、盐等(难点)
方法:两个守恒----元素守恒、得失电子守恒
煤、石油和某些金属矿物中含有硫,在燃烧或冶炼时往往会生成二氧化硫。在机动车发动机中,燃料燃烧产生的高温条件会使空气中的氮气与氧气反应,生成氮氧化物。
这些气体对空气和我们的生活环境能造成什么影响呢?
①定义:主要指 pH小于5.6 的雨水,其主要是含有硫酸和硝酸。
②成因:二氧化硫、氮氧化物及它们在大气中发生反应后的生成物溶于雨水 会形成酸雨。正常雨水因溶解了CO2,其pH约为5.6,而酸雨的pH小于5.6。
SO3+H2O=H2SO4
2H2SO3+O2=2H2SO4
2NO+O2=2NO2
3NO2+H2O=2HNO3+NO
与水反应生成硝酸和亚硝酸
破坏土壤成分使农作物减产甚至死亡
①消除污染源,改变能源结构,开发利用清洁能源
②研究煤的脱硫、燃烧技术,减少SO2排放
SO2 +CaO=CaSO3
2CaSO3+O2=2CaSO4 (生产石膏)
(2)氨水法
③改进汽车尾气的处理技术,控制尾气排放
2NO(g)+2CO(g)====2CO2(g)+N2(g)
④加强工业废气的回收处理
⑤健全法律法规,严格规定污染物的排放标准, 提高环境保护意识
化学必修 第二册第二节 氮及其化合物课文配套课件ppt: 这是一份化学必修 第二册<a href="/hx/tb_c4000034_t3/?tag_id=26" target="_blank">第二节 氮及其化合物课文配套课件ppt</a>,共18页。PPT课件主要包含了物理性质,化学性质,1不稳定性,保存在棕色瓶中,2酸性,①使指示剂变色,②与碱反应,③与碱性氧化物反应,④与金属单质反应,不生成H2等内容,欢迎下载使用。
高中化学人教版 (2019)必修 第二册第二节 氮及其化合物图文ppt课件: 这是一份高中化学人教版 (2019)必修 第二册<a href="/hx/tb_c4000034_t3/?tag_id=26" target="_blank">第二节 氮及其化合物图文ppt课件</a>,共1页。
人教版 (2019)必修 第二册第二节 氮及其化合物优秀ppt课件: 这是一份人教版 (2019)必修 第二册第二节 氮及其化合物优秀ppt课件,共49页。PPT课件主要包含了氮元素的存在,第三部分氨铵盐,思考与练习,抓小偷,第四部分硝酸,第五部分酸雨及防治,自学阅读课本P16等内容,欢迎下载使用。













