







大单元一 第一章 热点强化2 氧化还原反应基本规律及应用-备战2025年高考化学大一轮复习课件(人教版)
展开1.物质氧化态与还原态强弱的依存关系物质的氧化态与还原态的依存关系如下:氧化态 还原态越易失电子的物质(还原态),失电子后就越难得电子(氧化态);所以,氧化剂的氧化性越强,得电子后生成的还原产物的还原性就越弱,反应生成的物质就越稳定,还原剂同理。
2.强弱规律及应用(1)同时含有几种还原剂(或氧化剂),发生氧化还原反应时,还原性(或氧化性)强的优先反应,即“强者优先”,如在FeBr2溶液中通入少量Cl2时,因为还原性:_____>____,所以_____先与Cl2反应,反应的离子方程式:_______________________;在FeBr2溶液中通入足量Cl2时,反应的离子方程式:_____________________________________。
2Fe2++Cl2===2Fe3+
===2Fe3++2Br2+6Cl-
2Fe2++4Br-+3Cl2
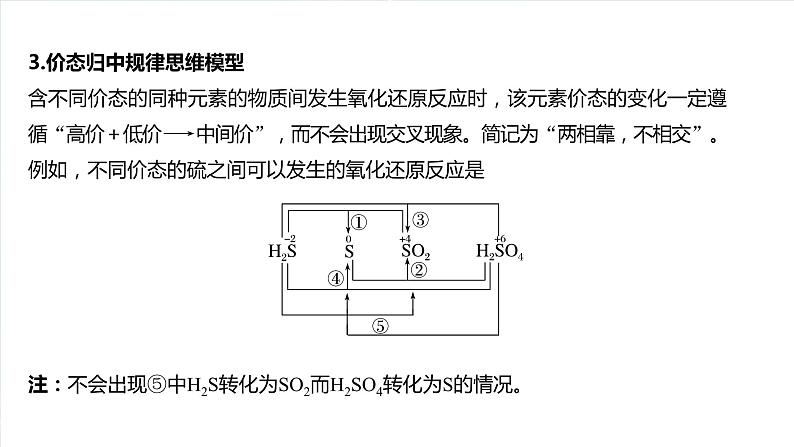
3.价态归中规律思维模型含不同价态的同种元素的物质间发生氧化还原反应时,该元素价态的变化一定遵循“高价+低价―→ 中间价”,而不会出现交叉现象。简记为“两相靠,不相交”。例如,不同价态的硫之间可以发生的氧化还原反应是注:不会出现⑤中H2S转化为SO2而H2SO4转化为S的情况。
4.歧化反应规律“中间价―→ 高价+低价”。具有多种价态的元素(如氯、硫、氮和磷元素等)均可发生歧化反应,如:Cl2+2NaOH===NaCl+NaClO+H2O。
1.已知G、Q、X、Y、Z均为含氯元素的化合物,在一定条件下有下列转化关系(未配平):①G―→ Q+NaCl②Q+H2O X+H2③Y+NaOH―→ G+Q+H2O④Z+NaOH―→ Q+X+H2O这五种化合物中Cl元素化合价由低到高的顺序是________________。
由①得出Q中Cl元素价态高于G,因为G中Cl元素价态必介于Q中Cl元素价态和-1价的氯元素之间,-1价为氯元素的最低价;将该结论引用到③,Y中Cl元素价态介于Q与G之间,故有Q中Cl元素价态高于Y,Y中Cl元素价态高于G;由②知,H2O中的H元素化合价降低,则Q中的氯元素转变为X中的氯元素,化合价必升高,则得出X中Cl元素价态高于Q;由④知,Z中Cl元素价态介于Q、X之间,则X中Cl元素价态高于Z,Z中Cl元素价态高于Q。
2.(2023·日照模拟)已知C2O3在酸性溶液中易被还原成C2+,且还原性:I->Fe2+>Cl->C2+。下列反应在水溶液中不可能发生的是A.3Cl2+6FeI2===2FeCl3+4FeI3B.Cl2+FeI2===FeCl2+I2C.C2O3+6HCl===2CCl2+Cl2↑+3H2OD.2Fe3++2I-===2Fe2++I2
A项,根据氧化性:Cl2>FeCl3>I2,因此氯气可以氧化Fe2+,也可以氧化I-,但是碘离子还原性强于亚铁离子,碘离子会先被氯气氧化,正确的离子方程式是Cl2不足时:Cl2+2I-===2Cl-+I2(Fe2+不反应),Cl2过量时:3Cl2+2Fe2++4I-===6Cl-+2I2+2Fe3+,反应不可能发生;B项,根据反应的化学方程式可得出还原性:I->Cl-,反应可能发生;C项,根据反应的化学方程式可得出还原性:Cl->C2+,反应可能发生;D项,根据反应的化学方程式可得出还原性:I->Fe2+,反应可能发生。
3.(2023·广东韶关模拟)已知有如下反应:①K2Cr2O7+14HCl(浓)===2KCl+2CrCl3+3Cl2↑+7H2O;②Cr+2HCl(稀)===CrCl2+H2↑;③2KMnO4+16HCl(稀)===2KCl+2MnCl2+5Cl2↑+8H2O。下列说法正确的是A.氧化性:K2Cr2O7>KMnO4>Cl2B.反应③中氧化剂与还原剂的物质的量之比为5∶1C.向金属Cr中滴入浓硝酸无明显变化,说明两者不能发生反应
根据氧化性:氧化剂>氧化产物,结合①~③分别可得,氧化性:K2Cr2O7>Cl2、HCl>CrCl2、KMnO4>Cl2,①中使用浓盐酸,③中使用稀盐酸,则氧化性:KMnO4>K2Cr2O7,A错误;反应③中,KMnO4是氧化剂,HCl是还原剂,根据得失电子守恒可知,氧化剂和还原剂的物质的量之比为1∶5,B错误;②中Cr与稀盐酸反应生成H2,向金属Cr中滴入浓硝酸无明显变化,可能是发生了钝化,C错误。
4.向含有Fe2+、I-、Br-的溶液中通入适量氯气,溶液中各种离子的物质的量变化如图所示。下列有关说法不正确的是A.线段BC代表Fe3+物质的量的变化情况B.原混合溶液中c(FeBr2)=6 ml·L-1C.当通入Cl2 2 ml时,溶液中已发生的离子 反应可表示为2Fe2++2I-+2Cl2===2Fe3++I2+4Cl-D.原溶液中n(Fe2+)∶n(I-)∶n(Br-)=2∶1∶3
根据还原性:Br-<Fe2+<I-,线段AB代表I-物质的量的变化情况,线段BC代表Fe3+物质的量的变化情况,线段DE代表Br-物质的量的变化情况,A项正确;溶液体积未知,无法计算浓度,B项错误;根据三段消耗氯气的量可知,原溶液中n(Fe2+)∶n(I-)∶n(Br-)=2∶1∶3,D项正确。
大单元一 第一章 第二讲 离子反应 离子方程式-备战2025年高考化学大一轮复习课件(人教版): 这是一份大单元一 第一章 第二讲 离子反应 离子方程式-备战2025年高考化学大一轮复习课件(人教版),文件包含大单元一第一章第2讲离子反应离子方程式pptx、大单元一第一章第2讲离子反应离子方程式教师版docx、大单元一第一章第2讲离子反应离子方程式学生版docx等3份课件配套教学资源,其中PPT共60页, 欢迎下载使用。
大单元一 第一章 第一讲 物质的组成、性质和转化-备战2025年高考化学大一轮复习课件(人教版): 这是一份大单元一 第一章 第一讲 物质的组成、性质和转化-备战2025年高考化学大一轮复习课件(人教版),文件包含大单元一第一章第1讲物质的组成性质和转化pptx、大单元一第一章第1讲物质的组成性质和转化教师版docx、大单元一第一章第1讲物质的组成性质和转化学生版docx等3份课件配套教学资源,其中PPT共60页, 欢迎下载使用。
(新高考)高考化学大一轮复习课件第8章第49讲热点强化17水解常数(Kh)与电离常数的关系及应用(含解析): 这是一份(新高考)高考化学大一轮复习课件第8章第49讲热点强化17水解常数(Kh)与电离常数的关系及应用(含解析),共21页。PPT课件主要包含了36×10-5,×10-12,③<②<①,归纳总结等内容,欢迎下载使用。












