








高考化学模拟(北京卷)-2024年高考化学考前押题密卷
展开2、锻炼同学的考试心理,训练学生快速进入考试状态。高考的最佳心理状态是紧张中有乐观,压力下有自信,平静中有兴奋。
3、训练同学掌握一定的应试技巧,积累考试经验。模拟考试可以训练答题时间和速度。高考不仅是知识和水平的竞争,也是时间和速度的竞争,可以说每分每秒都是成绩。
4、帮助同学正确评估自己。高考是一种选拨性考试,目的是排序和择优,起决定作用的是自己在整体中的相对位置。因此,模拟考试以后,同学们要想法了解自己的成绩在整体中的位置。
2024年高考考前押题密卷
高三化学
(考试时间:90分钟 试卷满分:100分)
注意事项:
1.答卷前,考生务必将自己的姓名、准考证号填写在答题卡上。
2.回答选择题时,选出每小题答案后,用铅笔把答题卡上对应题目的答案标号涂黑。如需改动,用橡皮擦干净后,再选涂其他答案标号。回答非选择题时,将答案写在答题卡上。写在本试卷上无效。
3.考试结束后,将本试卷和答题卡一并交回。
可能用到的相对原子质量:Na 23 Mg 24 Si 28 S 32 K 39 I 127
第一部分
一、选择题:本题共14小题,每小题3分,共42分。在每小题给出的四个选项中,只有一项是符合题目要求的。
1.最近我国科学家预测并据此合成了新型碳材料:T-碳。可以看作金刚石结构中的一个 碳原子被四个碳原子构成一个正四面体结构单元替代(如图所示,所有小球都代表碳原子)。下列说法正确的是
A.T-碳与石墨、金刚石互为同分异构体
B.T-碳晶体与金刚石晶体类似,属于原子晶体
C.T-碳晶体和金刚石晶体中含有的化学键不同
D.T-碳与金刚石中的碳原子采取的杂化方式不同
2.下列化学用语或图示中表达错误的是
A.的结构式:O=C=O
B.的电子式:
C.的VSEPR模型:
D.基态S原子价层电子轨道表示式:
3.水解原理在生产和生活中都具有重要的应用。下列事实与盐类的水解无关的是
A.氯化铵溶液可以除去铁锈B.加热蒸干溶液得到固体
C.饱和溶液滴入沸水中制胶体D.保存溶液常在溶液中放置铁钉
4.下列事实中,不能用勒夏特列原理加以解释的是
A.Na2S的水溶液有臭味,溶液中加入NaOH固体后臭味减弱
B.浓氨水中加入氢氧化钠固体时产生较多的刺激性气味的气体
C.压缩氢气与碘蒸气反应的平衡混合气体,颜色变深
D.BaSO4在水中溶解度比在稀硫酸中溶解度更大
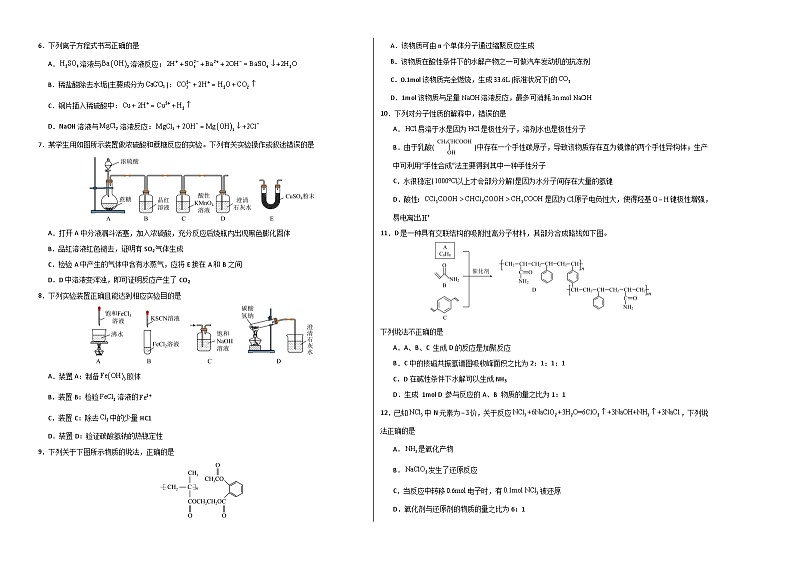
5.FeCl3溶液吸收工业废气H2S后可通过电解装置实现再生,同时将酸性污水中的硝酸盐降解为无污染物质,其工作原理如图所示。下列说法正确的是
A.惰性电极b为电解池的阳极
B.H+从b极区向a极区迁移
C.降解1ml,理论上吸收5mlH2S
D.随着电解进行,阴极区的pH增大
6.下列离子方程式书写正确的是
A.溶液与溶液反应:
B.稀盐酸除去水垢(主要成分为):
C.铜片插入稀硫酸中:
D.NaOH溶液与溶液反应:
7.某学生用如图所示装置做浓硫酸和蔗糖反应的实验。下列有关实验操作或叙述错误的是
A.打开A中分液漏斗活塞,加入浓硫酸,充分反应后烧瓶内出现黑色膨化固体
B.品红溶液红色褪去,证明有SO2气体生成
C.检验A中产生的气体中含有水蒸气,应将E接在A和B之间
D.D中溶液变浑浊,即可证明反应产生了CO2
8.下列实验装置正确且能达到相应实验目的是
A.装置A:制备胶体
B.装置B:检验溶液的
C.装置C:除去中的少量HC1
D.装置D:验证碳酸氢钠的热稳定性
9.下列关于下图所示物质的说法,正确的是
A.该物质可由n个单体分子通过缩聚反应生成
B.该物质在酸性条件下的水解产物之一可做汽车发动机的抗冻剂
C.0.1ml该物质完全燃烧,生成(标准状况下)的
D.1ml该物质与足量溶液反应,最多可消耗
10.下列对分子性质的解释中,错误的是
A.易溶于水是因为是极性分子,溶剂水也是极性分子
B.由于乳酸()中存在一个手性碳原子,导致该物质存在互为镜像的两个手性异构体;生产中可利用“手性合成”法主要得到其中一种手性分子
C.水很稳定(以上才会部分分解)是因为水分子间存在大量的氢键
D.酸性:是因为原子电负性大,使得羟基键极性增强,易电离出
11.D是一种具有交联结构的吸附性高分子材料,其部分合成路线如下图。
下列说法不正确的是
A.A、B、C 生成D的反应是加聚反应
B.C中的核磁共振氢谱图吸收峰面积之比为2:1:1:1
C.D在碱性条件下水解可以生成NH3
D.生成 1ml D 参与反应的A、B 物质的量之比为1:1
12.已知中N元素为价,关于反应,下列说法正确的是
A.是氧化产物
B.发生了还原反应
C.当反应中转移电子时,有被还原
D.氧化剂与还原剂的物质的量之比为6:1
13.一种分解氯化铵实现产物分离的物质转化关系如图所示,下列说法正确的是
A.NH4Cl的电子式为
B.反应①、②均为氧化还原反应
C.反应①的化学方程式为
D.除去NaCl固体中的NH4Cl可加入少量MgO并充分加热
14.利用平衡移动原理,分析常温下Ni2+在不同pH的Na2CO3体系中的可能产物。
已知:图1中曲线表示Na2CO3体系中各含碳粒子的物质的量分数与pH的关系;图2中曲线I的离子浓度关系符合;曲线Ⅱ的离子浓度关系符合;[注:起始Na2CO3体系中;不同pH下c(CO)由图1得到]。下列说法错误的是
A.pH=7时,碳酸钠溶液体系中存在:c()>c(H2CO3)>c()
B.M点时,溶液中存在c()=c(OH-)
C.初始状态pH=9、,平衡后存在
D.沉淀Ni2+制备NiCO3时,选用0.1NaHCO3溶液比0.1Na2CO3溶液效果好
第二部分
本部分共5题,共58分。
15.(11分)碳和硅是同主族元素,但是和的性质和应用却有着很大差异。
(1)原子结构与元素性质分析
①基态碳原子占据的最高能级的原子轨道的形状是 (填名称)。
②基态的价层电子轨道表示式是:
③元素C、Si、O的电负性由大到小的关系是
(2)微粒间相互作用与物质性质
①和中同时存在键和键的是 (填化学式)。
②分子的空间结构是 ,碳原子的杂化轨道类型为 ﹔
③晶体结构如下图所示,硅原子的杂化轨道类型为 。
(3)不同聚集状态的物质与性质
①Si与C同主族,但与的熔沸点等物理性质差距很大,请从晶体结构角度解释其原因 。
②干冰晶体结构如上图所示,下列关于与叙述正确的是 。
a.固体一定是晶体
b.干冰晶体中,每个周围紧邻12个
c.晶胞中,含有Si原子8个和O原子16个
③某种含硅化合物晶胞结构如下图所示,这种含硅化合物的化学式为 。
④已知该化合物的晶胞边长为acm,阿伏伽德罗常数的值为,则其晶体的密度为 。
16.(12分)“绿水青山就是金山银山”,研究消除氮氧化物污染对建设美丽家乡,打造宜居环境有重要意义。
(1)已知:
写出C与反应生成的热化学方程式 。
(2)已知:。在恒容密闭容器中,投入和,经过一段时间后达到平衡状态,测得的转化率为。该温度下,反应的平衡常数为 。
(3)原煤经热解、冷却得到的煤焦可用于的脱除。热解温度为得到的煤焦分别用表示,相关信息如下表:
将NO浓度恒定的废气以固定流速通过反应器(图1)。不同温度下,进行多组平行实验,测定相同时间内NO的出口浓度,可得NO的脱除率与温度的关系如图2所示。
[已知:的脱除主要包含吸附和化学还原()两个过程]
①已知煤焦表面存在的官能团有利于吸附NO,其数量与煤焦中氢碳质量比的值密切相关,比值小,表面官能团少。由图2可知,相同温度下,单位时间内对NO的脱除率比的高,可能原因是 。(答两条)。
②后,随着温度升高,单位时间内NO的脱除率增大的原因是 。
(4)电解氧化吸收法:其原理如图3所示:
①从A口中出来的物质的是 。
②写出电解池阴极的电极反应式 。
17.(12分)我国科研人员发现,中药成分黄芩素能明显抑制新冠病毒的活性。黄芩素的一种合成路线如下:
已知:
①R-Br+CH3ONaR-OCH3+NaBr
②+ +
③+ +H2O(R、R´、R´´为烃基或H)
回答下列问题:
(1)A中所含的官能团为 ,A→B的反应类型为 。
(2)B→D中反应i的化学方程式为 。
(3)E与F反应生成G的化学方程式为 。
(4)H分子中有三个六元环状结构,其结构简式为 。
(5)下列关于黄芩素的说法中,正确的是________ (填字母序号)。
A.分子中有3种含氧官能团,所有碳原子均为sp2杂化
B.能与Na2CO3溶液反应,能与发生取代反应和加成反应
C.存在含苯环、碳碳三键和羧基的同分异构体
D.“H→黄岑素”反应中通入N2的目的可能是防止黄岑素被氧化
(6)有文献指出,C的另外一种合成方法如下:
Ⅰ与NaHCO3溶液反应产生气体,其结构简式为 (不考虑立体异构)。
18.(11分)Na2SO3应用广泛。利用工业废碱渣(主要成分Na2CO3)吸收硫酸厂尾气中的SO2,同时制备无水Na2SO3的方法工艺简便、成本低廉,优势明显。其流程如下:
(1)SO2直接排入大气中可能导致的环境问题是 。
(2)下图为吸收塔中Na2CO3溶液与SO2反应过程中溶液组成变化。则初期反应(图中A点以前)的离子方程式是 。
(3)中和器中发生的主要反应的化学方程式是 。
(4)为了降低由中和器所得溶液中Na2SO3的溶解度,从而提高结晶产率,中和器中加入的NaOH是过量的。
①请结合Na2SO3的溶解平衡解释NaOH过量的原因 。
②结晶时应选择的最佳操作是 (填字母)。
a.95~100℃加热蒸发,直至蒸干
b.维持95~100℃蒸发浓缩至有大量晶体析出
c.95~100℃加热浓缩,冷却至室温结晶
(5)KIO3滴定法可测定成品中Na2SO3的含量:室温下将0.1260 g成品溶于水并加入淀粉做指示剂,再用酸性KIO3标准溶液(x ml/L)进行滴定,到达终点时,消耗KIO3标准溶液体积为y mL。(已知;还原性:)
①滴定终点前反应的离子方程式是: (将方程式补充完整)
②滴定终点的现象为 。
③成品中Na2SO3 (M=126 g/ml)的质量分数是 。
19.(12分)化学小组探究与溶液的反应,实验如下:
已知:经检验白色沉淀为
(1)实验ⅰ中发生的离子方程式为 。
(2)实验ⅱ中检测到,依据的实验现象是 。
(3)从平衡移动的原理解释实验ⅱ红色消失的原因 。
(4)对实验ⅱ中产生的原因作如下假设:
假设1:溶液中的被_______氧化
假设2:与的反应是一个可逆反应
假设3:在实验ⅱ的条件下,被氧化
请将假设1补充完整 。
(5)设计实验验证假设。
实验ⅲ 取2mL溶液a,向其中滴加5滴0.1ml/L溶液,放置较长时间,溶液颜色不变红,证明假设1不成立。
实验ⅳ 实验装置如下图所示,闭合开关K,电流计指针不动。向右侧溶液中滴加0.1ml/L,指针向右大幅度偏转,溶液中有白色浑浊物产生。取出左侧溶液,滴加0.1ml/L,溶液变红。
①溶液a是 。
②假设2不成立的实验证据是 。
③实验证明假设3成立。
请结合电极反应式解释实验ⅱ中产生的原因 。
煤焦
元素分析/%
比表面积
C
H
80.79
2.76
105.69
84.26
0.82
8.98
资料显示:
Ⅰ.Na2SO3在33℃时溶解度最大,将其饱和溶液加热至33℃以上时,由于溶解度降低会析出无水Na2SO3,冷却至33℃以下时析出Na2SO3·7H2O;
Ⅱ.无水Na2SO3在空气中不易被氧化,Na2SO3·7H2O在空气中易被氧化。
序号
实验方案
实验现象
实验ⅰ
振荡试管,观察到溶液变为蓝色,待反应充分后,试管底部有粉剩余。
实验ⅱ
取实验ⅰ中的上层清液,向其中滴加0.1ml/L溶液
溶液局部变红,同时产生白色沉淀,振荡试管,红色消失。
高考化学模拟(广东卷)-2024年高考化学考前押题密卷: 这是一份高考化学模拟(广东卷)-2024年高考化学考前押题密卷,文件包含化学广东卷全解全析docx、化学广东卷考试版A4docx、化学广东卷考试版A3docx、化学广东卷参考答案docx、化学广东卷答题卡pdf等5份试卷配套教学资源,其中试卷共39页, 欢迎下载使用。
高考化学模拟(山东卷)-2024年高考化学考前押题密卷: 这是一份高考化学模拟(山东卷)-2024年高考化学考前押题密卷,文件包含化学山东卷全解全析docx、化学山东卷考试版A4docx、化学山东卷考试版A3docx、化学山东卷参考答案docx、化学山东卷答题卡pdf等5份试卷配套教学资源,其中试卷共38页, 欢迎下载使用。
高考化学模拟(天津卷)-2024年高考化学考前押题密卷: 这是一份高考化学模拟(天津卷)-2024年高考化学考前押题密卷,文件包含化学天津卷全解全析docx、化学天津卷考试版A4docx、化学天津卷考试版A3docx、化学天津卷参考答案docx、化学天津卷答题卡A4pdf等5份试卷配套教学资源,其中试卷共35页, 欢迎下载使用。












