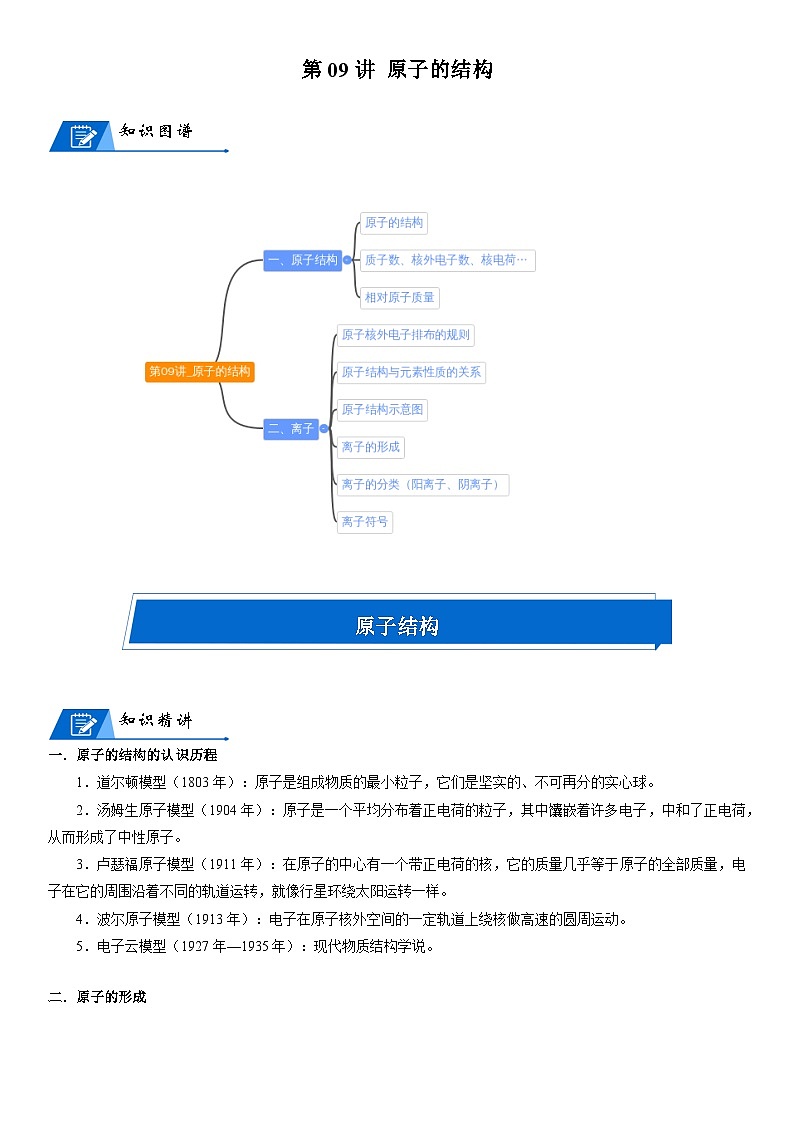


初中化学人教版九年级上册课题2 原子的结构导学案及答案
展开
这是一份初中化学人教版九年级上册课题2 原子的结构导学案及答案,共30页。
原子结构
知识精讲
一.原子的结构的认识历程
1.道尔顿模型(1803年):原子是组成物质的最小粒子,它们是坚实的、不可再分的实心球。
2.汤姆生原子模型(1904年):原子是一个平均分布着正电荷的粒子,其中馕嵌着许多电子,中和了正电荷,从而形成了中性原子。
3.卢瑟福原子模型(1911年):在原子的中心有一个带正电荷的核,它的质量几乎等于原子的全部质量,电子在它的周围沿着不同的轨道运转,就像行星环绕太阳运转一样。
4.波尔原子模型(1913年):电子在原子核外空间的一定轨道上绕核做高速的圆周运动。
5.电子云模型(1927年—1935年):现代物质结构学说。
二.原子的形成
1.原子一般是由质子、中子和电子构成,有的原子不一定有中子,质子数也不一定等于中子数。
2.原子的种类由核电荷数(质子数)决定。
三.质子数、核外电子数、核电荷数的等式关系
原子种类
核电荷数
原子核
核外电子数
质子数
中子数
氢
1
1
0
1
碳
6
6
6
6
氧
8
8
8
8
钠
11
11
12
11
铁
26
26
30
26
构成原子的各种粒子间的关系
在原子中,原子序数=核电荷数=核内质子数=核外电子数。
由于原子核所带的正电荷与核外电子所带的负电荷的电量相等,电性相反,所以原子整体不显电性。
四.相对原子质量
国际上是以一种碳原子(碳12,其原子核内有6个质子和6个中子)的质量的1/12作为标准,其他原子的质量跟它相比较所得的数值,就是这种原子的相对原子质量。
1.相对原子质量是一个比值,不是原子的实际质量
原子种类
质子数
中子数
电子数
相对原子质量
氢
1
0
1
1
碳
6
6
6
12
氧
8
8
8
16
钠
11
12
11
23
铁
26
30
26
56
2.原子的质量主要集中在原子核上,相对原子质量≈质子数+中子数;
五.表示原子组成的方法
:1.X代表元素符号;2.A—质量数;Z—核电荷数(核内质子数)。
三点剖析
一.考点:
1.了解原子的构成
2.知道相对原子质量的表示方法及计算
二.重难点:
1.原子的构成
2.相对原子质量的表示方法及计算
三.易错点:
1.不是所有原子均有质子和中子,氢原子无中子。
2.相对原子质量只有数值,单位是“1”,不写。
原子的结构
例题1、 下列说法中,不正确的是( )
例题2、 下列有关原子的叙述错误的是( )
例题3、 卢瑟福的a离子轰击金箔实验为建立现代原子理论打下了基础,如图中a、b、c、d四条线,可能是a粒子(带正电)在该实验中的运动轨迹的是( )
随练1、 下列关于原子的叙述中,不正确的是( )
随练2、 某化合物的分子中,含有3个原子核和22个电子,能组合该化合物分子的两种核电荷数分别是( )
质子数、核外电子数、核电荷数的等式关系
例题1、 紫薯中含有被誉为“抗癌大王”的硒元素,已知硒原子的核电荷数为34,中子数为44,则硒原子的核外电子数为( )
例题2、 原子序数为94的钚(Pu)是一种核原料,该元素一种原子的质子数和中子数之和为239,下列关于该原子的说法不正确的是( )
例题3、 科学家已研制成以锶原子做摆钟的“光格钟”,成为世界上最精神的钟.已知一种锶原子的相对原子质量为88,其原子序数是38,这种锶原子的得核外电子数为________,中子数为________.( )
随练1、 某元素的相对原子质量是31,原子核外有三个电子层,最外层有5个电子,则该元
素的原子核中的中子数是( )
随练2、 一种铁原子的原子核内有26个质子和30个中子,该原子的核外电子数为( )
随练3、 质子数和电子数均为10的两种粒子,一定不可能是( )
相对原子质量
例题1、 相对原子质量是以碳-12原子质量的_____为标准,已知一个碳-12原子质量为1.993×10-26Kg,则一个质量为2.325×10-26Kg的某原子的相对原子质量约为____________(结果取整数)。
例题2、 下列科学家中,对相对原子质量的测定做出卓越贡献的是( )
例题3、 关于相对原子质量,下列说法正确的是( )
A.相对原子质量就是原子质量
B.一个碳-12原子的质量是mkg,某元素的质量是nkg,则该元素原子的相对原子质量为12m/n
C.两种原子的质量之比等于它们的相对原子质量之比
D.如果钠的相对原子质量是23,铝的相对原子质量是27,则等质量的钠和铝两种金属中,铝所含的原子个数多
随练1、 下列说法错误的是( )
随练2、 已知某碳12原子的相对原子质量为12,镁原子的相对原子质量为24 。若该碳原子的质量为m,则该镁原子的质量为( )
随练3、 已知作为相对原子质量基准的1个碳原子的质量为1.993×10-26kg,1个氟原子的质量3.156×10-26kg。
(1)求氟的相对原子质量(列式计算,结果保留整数)。
(2)求氟气的相对分子质量。
随练4、 已知一个碳-12原子的质量为m kg,一个A原子的质量为n kg,那么A原子的相对原子质量可以表示为________________.
离子
知识精讲
一.原子核外电子排布的规则
在含有很多电子的原子里,电子的能量并不相同,能量高的通常在离核较远的区域运动,能量低的电子通常在离核较近的区域运动,就像分了层一样。这样的运动,我们称为分层运动或分层排布。
现在发现的元素,原子核外电子最少的有1层,最多的有7层。电子层序数越大,层内电子的能量越大,离原子核距离越远。
1.核外电子总是尽先排在能量最低的电子层里,第一层排满才能排第二层,第二层排满才能排第三层;
2.每个电子层最多能容纳2n2个电子(n为层序数,第一层n=1,第二层n=2),如第一层不超过2个;第二层不超过8个;……
3.最外层电子数不超过8个(第一层为最外层时,不超过2个)。
二.原子结构示意图
1.含义:(以一个氯原子的原子结构示意图为例)
+17
2 8 7
弧线表示电子层
弧线上的数字表示该层填充的电子数
表示原子核和核内质子数
2.前18号元素的原子结构示意图
3.原子的最外层电子数与元素的分类、化学性质的关系
元素的分类
最外层电子数
得失电子趋势
化学性质
稀有气体元素
8个(氦为2个)
相对稳定,不易得失电子
稳定
金属元素
一般少于4个
易失去最外层电子
不稳定
非金属元素
一般多于4个
易得到电子
不稳定
(1)元素的化学性质决定于原子的最外层电子数
(2)原子最外层电子数为8(氦为2)的结构称为稳定结构
三.离子
1.定义:带电的原子或原子团叫做离子。
在化学反应中,金属元素原子失去最外层电子,非金属元素原子得到电子,从而使参加反应的原子带上电荷。
2.分类
带正电荷的原子叫做阳离子,带负电荷的原子叫做阴离子。
3.离子符号表示的意义:表示离子(或一个离子)
Mg2+——表示镁离子(一个镁离子)
(1)离子符号前面的化学计量数(系数)表示离子的个数;
(2)离子符号的表示方法:在元素符号(或原子团)右上角表明离子所带的电荷,数值在前,正、负号在后。离子带1个单位的正电荷或个单位的负电荷,“1”省略不写。如:阳离子:Na+、Ca2+、Al3+等,阴离子:Cl-、S2等。
4.原子、阳离子、阴离子的判断
(1)原子:质子数=核外电子数
(2)阴离子:质子数<核外电子数
(3)阳离子:质子数>核外电子数
5.常见原子团离子
SO42- 硫酸根离子
CO32- 碳酸根离子
NO3- 硝酸根离子
OH- 氢氧根离子
NH4+ 铵根离子
三点剖析
一.考点:
1.原子核外电子的分层排布
2.最外层电子数与元素性质的关系
3.离子的形成与符号表示方法
二.重难点:
1.原子核外电子的分层排布
2.离子的形成与符号表示方法
三.易错点:
1.核外电子总是尽先排在能量最低的电子层里,第一层排满才能排第二层,第二层排满才能排第三层。
2.元素的化学性质决定于原子的最外层电子数。
原子核外电子排布的规则
例题1、 某元素的相对原子质量是31,原子核外有三个电子层,最外层有5个电子,则该元素的原子核中的中子数是( )
例题2、 某元素的原子有三个电子层,已知第三层电子数等于第二层与第一层电子数之差,则该元素是( )
例题3、 下列推理符合事实的是( )
A.单质中一定只含一种元素,所以只含一种元素的物质一定是单质
B.氧化物中含有氧元素,含有氧元素的物质一定是氧化物
C.最外层电子数为8的粒子不一定都是稀有气体元素的原子
D.活泼金属可与酸发生置换反应,置换反应一定是金属和酸的反应
随练1、 如图是元素X的一种粒子结构示意图,下列说法中正确的是( )
随练2、 稀有气体元素的原子最外层不一定是8个电子.________.(判断对错)
随练3、 根据下列结构示意图判断,属于原子且容易失去电子的是( )
原子结构与元素性质的关系
例题1、 根据下列四种粒子的结构示意图,所获取的信息不正确的是( )
例题2、 用分子、原子、质子、电子等知识回答:钠元素和镁元素的本质区别是________不同;决定元素化学性质的是________;CO和CO2都由碳元素和氧元素组成,但是化学性质不同,是因为________不同
例题3、 原子结构中与物质的化学性质关系最密切的是( )
随练1、 决定元素化学性质的是( )
随练2、 根据下列各组元素的原子结构示意图分析:具有相似化学性质的一组是( )
随练3、 下图是1~18号元素原子最外层电子数与原子核电荷数的关系图。请回答下列问题:
(1)1~18号元素中属于稀有气体元素的有________(填元素符号)。
(2)He和Be元素的原子最外层均有2个电子它们的化学性质是否相似?________。(填“相似”或“不相似”)。
(3)某元素的原子序数为16,它在化学反应中一般易________电子(填“得到”或“失去”)。
原子结构示意图
例题1、 下列有关粒子结构示意图的说法正确的是( )
A.③和④的元素在元素周期表中属于同一周期
B.②和⑥形成化合物的化学式为MgO
C.①和②、⑤和⑥的最外层电子数相同,化学性质相似
D.①③④是具有稳定结构的原子
例题2、 对于下列结构示意图,有关说法正确的是( )
例题3、 根据如图1粒子结构示意图完成下列问题:
(1)上述粒子中,属于同种元素的粒子是________。(填序号,下同)
(2)某元素R与镁元素形成盐的化学式为MgR,则R元素的离子可能是上述粒子中的________。
(3)写出由A的单质与A、B形成的化合物反应的化学方程式________。
(4)若图2所示的粒子为中性原子,则x的数值范围是________。
随练1、 下图中①、②、③、④是四种粒子的结构示意图,下列说法错误的是( )
随练2、 如图所示的粒子结构示意图中,表示阳离子是( )
随练3、 如图为某原子的结构示意图,下列说法不正确的是( )
随练4、 根据图提供的信息,请回答下列问题:
(1)A图中X的值是________。
(2)化学性质相似的原子是________(填字母序号,下同)。
(3)具有稳定结构的原子________。
(4)属于同种元素的粒子是________。
离子的形成
例题1、 某元素X的原子结构示意图为:,下列有关说法不正确的是( )
A.元素X在周期表中的原子序数为16
B.X属于非金属元素
C.X原子得到电子形成的离子带2个单位的正电荷
D.X的原子在周期表中位于第三周期
例题2、 原子失去或得到电子之后,一定发生变化的是( )
①质子数 ②电子数 ③最外层电子数 ④电子层数 ⑤原子核 ⑥相对原子质量 ⑦电性.
例题3、 下列属于阳离子的是( )
例题4、[多选题] 图表是学习化学的重要工具。下列选项从图中获得的信息正确的是( )
A.硫属于金属元素
B.硫的相对原子质量是32.06g
C.在硫原子中,质子数=电子数=16
D.硫原子在化学反应中易得到2个电子形成S2-
随练1、 下列微粒结构示意图中,表示阳离子的是( )
随练2、 A元素的原子结构示意图为,A元素在化学反应中容易________电子变成________离子,属________元素(填金属或非金属).
随练3、 下列粒子结构示意图中,表示阳离子的是( )
随练4、 甲、乙是两种粒子的结构示意图,下列说法正确的是( )
离子的分类(阳离子、阴离子)
例题1、 下列物质中,由阴、阳离子构成的是( )
例题2、 下列物质由离子构成的是( )
例题3、 下列物质由离子构成的是( )
例题4、 李涛同学撰写的“心目中的原子”短文中,阐述了以下观点,你认为不正确的是( )
随练1、 下列有关分子、原子和离子的说法正确的是( )
A.分子大,原子小
B.分子、原子、离子都可以构成物质
C.物体有热胀冷缩现象,主要是因为物体中的粒子大小随温度的改变而改变
D.原子可以通过得失电子转变成离子,但离子不可以转变为原子
随练2、 下列物质由离子构成的是( )
随练3、 下列叙述正确的是( )
A.氯化钠是由钠离子和氯离子构成的化合物
B.水沸腾时可冲起壶盖,说明温度升高分子会变大
C.“含氟牙膏”中的“氟”指的是单质
D.保持二氧化碳化学性质的粒子是碳原子和氧原子
离子符号
例题1、 下列化学用语书写错误的是( )
例题2、 下列化学符号错误的是( )
例题3、 最近,科学家成功制备出了一种含铱元素的阳离子,在这种离子中,铱元素显+9价。该离子符号的书写正确的是( )
随练1、 下列正确表示离子的是( )
①H2O2 ②Si ③S2- ④ ⑤Mg+2.
随练2、 请用化学用语表示:
氧化铝中铝的化合价为+3价_____________2个亚铁离子_____________。
随练3、 配制农药波尔多液所用硫酸铜的构成粒子是Cu2+和________(填化学符号)
拓展
1、 月球土壤含有大量氦3原子,它可能成为未来核能的重要原料.氦3原子核内有2个质子和1个中子,氦3原子结构示意图是( )
2、 科学家曾通过测定古生物遗骸的碳-14含量来推测古城年代.碳-14原子的核电荷数为6,相对原子质量为14.下列关于碳-14原子的说法中错误的是( )
3、 图1是氢弹的结构图,如表是氢弹相关原子的结构.
(1)钋元素是 元素(填“金属”或“非金属”);
(2)氢原子和氚原子属于同种元素的原子依据是 相同;
(3)图2中表示氘原子的结构示意图的是 .
4、 最近,“镉大米”成为公众关注的热点问题之一.据了解,含镉的大米对人的肝肾损害比较大.镉(Cd)的原子序数为48,中子数为64,下列说法错误的是( )
5、 国际化学联合会于2月19日宣布,第112号化学元素已获正式名称“Cpernicium”,相应元素符号为“Cn”。化学元素周期表中又添新成员。新元素的质量约是氢原子质量的277倍,是目前获得正式承认的最重的元素,则该元素原子核内的中子数为( )
6、中国科研团队首次证实了天然铀单质的存在.用于核电工业的一种铀原子中含有92个质子和143个中子.有关该原子的说法不正确的是( )
7、 硒在光照下导电能力提高近千倍,可用作静电复印硒鼓的材料。元素周期表中“硒”的信息如图所示。下列关于硒元素说法错误的是( )
8、 碳的相对原子质量是( )
9、 已知某氧原子的相对原子质量为16,某硫原子的相对原子质量为32.如果该氧原子的质量为m,则该硫原子的质量为________.
10、 碘是人体必须的一种微量元素.碘元素的符号为I,图1是I-(碘离子)的结构示意图.
(1)图1中x=________;
(2)碘属于________元素(填“金属”或“非金属”).图2表示的微粒中,与I化学性质相似的是________(填字母序号).
11、 如图是元素x的原子结构示意图,下列说法正确的是( )
12、 元素的种类、化学性质分别与下列粒子数密切相关,分别是( )
13、 氮元素与氧元素最本质的区别是( )
14、 核电站中核燃料铀或钚在中子的撞击下,原子核发生分裂,产生氙、锶等原子及一些粒子和射线,同时释放大量的能量,这些能量可用于驱动汽轮机发电.锶元素在元素周期表中显示的信息和粒子结构示意图如图所示.以下表述中正确的是( )
15、 下图中①、②、③、④是四种粒子的结构示意图,下列说法错误的是( )
16、 下列粒子的结构示意图中,表示具有稳定结构的原子的是( )
17、 如图是人体不可缺少的钙元素的原子结构示意图,则有关钙原子的下列说法中正确的是( )
18、 如图是某元素的原子结构示意图.下列说法不正确的是( )
答案解析
原子结构
原子的结构
例题1、
【答案】 A
【解析】 A、氢原子核内没有中子,故A说法错误;
B、构成物质的微粒时刻在不断运动,故B说法正确;
C、促进燃烧的方法:增大氧气的浓度,增大可燃物与氧气的接触面积,故C说法正确;
D、纯净物有固定的组成和性质,故D说法正确.
例题2、
【答案】 A
【解析】 A、原子是化学变化中的最小粒子,但并不意味着原子就是最小的粒子,原子还可以继续被分成更微小的粒子,如质子、中子、电子,故A说法错误;
B、原子质量主要集中在原子核上,核外电子的质量很小可以忽略不计,故B说法正确;
C、原子的质子数=核电荷数=核外电子数,故C说法正确;
D、根据元素的化学性质由最外层电子数决定,故D说法正确;
例题3、
【答案】 B
【解析】 由于原子中原子核体积很小,质量却很大,所以α粒子遇到原子核就会发生偏向,例如c和d.因为原子的核外电子质量很小,但所占的体积却很大,电子的质量小的可以忽略不计,所以α粒子可以直接穿过去,例如b.由于原子核外的电子质量很小,α粒子是直接穿过,且原子核带正电荷,α粒子也带正电荷,同性相斥,所以α是不可能向原子核靠近的,应该远离原子核,所以a不是α粒子在该实验中的运动轨迹.所以选B.
随练1、
【答案】 D
【解析】 A、原子可以结合成分子,故正确.
B、原子在化学变化中是最小的粒子,不能再分,故正确.
C、所有的原子都是由原子核与核外电子构成,故正确.
D、原子是由居于原子中心的带正电的原子核和核外带负电的电子构成的.由于原子核所带电量和核外电子的电量相等,但电性相反,因此原子不显电性,故不正确.
随练2、
【答案】
【解析】 不妨从答案入手考虑,对与A选项,两种原子分别是C和O,组成\(C{{O}_{2}}\)恰好满足要求.B选项中有氦原子,难以形成化合物.C选项是氢原子和氧原子,组成的\({{H}_{2}}O\)的电子数是10,D选项为氟原子和铝原子,由于在化合物中,F常显\(-1\)价,Al常显\(+3\)价,所以难组成三个原子核的化合物.
质子数、核外电子数、核电荷数的等式关系
例题1、
【答案】 B
【解析】 硒原子的核电荷数为34,根据在原子中:核电荷数=核外电子数,可知硒原子的核外电子数为34。
例题2、
【答案】 D
【解析】 A、在原子中质子数=核电荷数=核外电子数=原子序数,钚的原子序数为94,则其质子数为94,又相对原子质量≈质子数+中子数,则其中子数为239-94=145,故A正确;
B、在原子中质子数=核电荷数=核外电子数=原子序数,钚的原子序数为94,则其核外电子数为94,故B正确;
C、在原子中质子数=核电荷数=核外电子数=原子序数,钚的原子序数为94,则其质子数为94,故C正确;
D、在原子中质子数=核电荷数=核外电子数=原子序数,钚的原子序数为94,则其核电荷数为94,故D错误。
例题3、
【答案】 B
【解析】 因为原子中:核电荷数=核内质子数=核外电子数,由题意已知一种锶原子的相对原子质量为88,其原子序数是38,则核外电子数是38,根据相对原子质量=质子数+中子数,由题意该原子的中子数=88-38=50.
随练1、
【答案】 C
【解析】 暂无解析
随练2、
【答案】 B
【解析】 暂无解析
随练3、
【答案】 B
【解析】 A、质子数和电子数均为10的两种粒子,可能是同种元素的两种原子,不正确;
B、两种粒子的质子数相同,原子得失电子形成离子,同种元素的分子和离子核外电子数不同,故不可能是一种分子和一种离子,故选项正确.
C、两种粒子的质子数、电子数都相同,它们可能是两种不同分子,如NH3和H2O分子,质子数与核外电子数均为10,故选项错误.
D、两种粒子的质子数、电子数都相同,它们可能是一种原子和一种分子,如水分子和氖原子的核内质子数和核外电子数均为10,故选项错误.
相对原子质量
例题1、
【答案】 ;14
【解析】 暂无解析
例题2、
【答案】 C
【解析】 A、门捷列夫在化学上的主要贡献是发现了元素周期律,并编制出元素周期表,故选项错误。
B、拉瓦锡首先通过实验得出空气是由氮气和氧气组成的结论,故选项错误。
C、张青莲对相对原子质量的测定作出重要贡献,故选项正确。
D、道尔顿在化学上的主要贡献是提出了原子学说,故选项错误。
例题3、
【答案】 C
【解析】 A、相对原子质量是以一种碳原子的质量的作为标准,其他原子的质量跟它相比较所得到的比值,不是原子质量的另一种说法,故选项说法错误.
B、根据公式:某原子的相对原子质量=,可以知道该元素原子的相对原子质量,故错误;
C、由于相对原子质量是原子的质量与碳原子质量的的比值,故两种原子的质量之比等于它们的相对原子质量之比,故正确;
D、如果钠的相对原子质量是23,铝的相对原子质量是27,则1个钠原子的质量小于1个铝原子的质量,则等质量的钠和铝两种金属中,钠所含的原子个数多,故选项说法错误.
随练1、
【答案】 B
【解析】 A、原子由原子核和核外电子构成,不显电性,故正确;
B、相对原子质量是个比值,是一个比值,单位是“1”,常省略不写,碳的相对原子质量是12,故错误;
C、“酒香不怕巷子深”说明分子在不停运动,故正确;
D、钠的原子核内质子数为11,质子数=原子序数,原子序数是11,元素符号是Na,故正确.
随练2、
【答案】 C
【解析】 暂无解析
随练3、
【答案】 (1)19(2)38
【解析】 (1)、由原子的相对原子质量的概念,则氟的相对原子质量为=19;(2)、氟气的化学式为F2,故氟气的相对分子质量=19×2=38。答:(1)、氟的相对原子质量为19;(2)、氟气的相对分子质量为38。
随练4、
【答案】
【解析】 根据相对原子质量的定义,应该把A原子的质量和碳-12原子质量的\(\frac{1}{12}\)做比
离子
原子核外电子排布的规则
例题1、
【答案】 C
【解析】 原子核外有三个电子层,最外层有5个电子,所以该原子内电子数为=2+8+5=15个;相对原子质量=质子数+中子数,所以该元素原子核中的中子数是=31-15=16。
例题2、
【答案】 C
【解析】 该原子有三个电子层,说明第一层和第二层已经排满电子,即第一层2个,第二层8个,第二层与第一层电子数之差为6,已知第三层电子数等于第二层与第一层电子数之差,则第三层上有6个电子,即原子核外的电子数为2+8+6=16,核内有16个质子,即硫元素.
例题3、
【答案】 C
【解析】 A、单质中一定只含一种元素,只含一种元素的物质不一定是单质,例如氧气和臭氧的混合物不是单质,故A错误;
B、氧化物中含有氧元素,含有氧元素的物质不一定是氧化物,例如:氧气含有氧元素不是氧化物,故B错误;
C、最外层电子数为8的粒子不一定都是稀有气体元素的原子,故C正确;
D、活泼金属可与酸发生置换反应,置换反应不一定是金属和酸的反应,例如,金属能与一些盐发生置换反应,故D错误。
随练1、
【答案】 D
【解析】 A、由粒子的结构示意图,核外的电子数比核内的质子数多1,该粒子可表示为X-,故不正确;
B、由X元素的粒子的结构示意图可知,质子数是17,属于氯元素,是非金属元素,故不正确;
C、由X元素的粒子的结构示意图可知,该粒子的质子数17,原子时,质子数=核外电子数,X的原子最外层电子数为7,故不正确;
D、由粒子的结构示意图可知,该粒子最外层有8个电子,为稳定结构,故正确。
随练2、
【答案】 对
【解析】 稀有气体元素的原子最外层电子不一定是8个,氦原子最外层有两个电子,故说法是正确的;
随练3、
【答案】 C
【解析】 A、由图示可知核电荷数=质子数=核外电子数=2,为原子;不易失去电子,故A不符合题意;
B、核电荷数=质子数=12>核外电子数=10,为阳离子,故B不符合题意;
C、由图示可知核电荷数=质子数=核外电子数=11,为原子;最外层电子数少于4,易失去最外层电子形成阳离子,故C符合题意;
D、核电荷数=质子数=17<核外电子数=18,为阴离子,故D不符合题意。
原子结构与元素性质的关系
例题1、
【答案】 B
【解析】 A、圆圈内数字表示该元素的核内质子数,由图示可知有16、11、8三种,所以表示三种元素,故A说法正确;
B、最外层电子数相同的化学性质相同,所以③和④化学性质相同,故B说法错误;
C、②表示的是质子数为11的钠元素,带有“钅”字旁,属于金属元素,故C说法正确;
D、核内质子数等于核外电子数的属于原子,核内质子数小于核外电子数的是阴离子,所以①表示原子,④表示阴离子,故D说法正确。
例题2、
【答案】 质子数;最外层电子数;分子结构
【解析】 决定元素种类的是核内质子数,所以钠元素和镁元素的本质不同是质子数不同;决定元素化学性质的是原子的最外层电子数;CO和CO2都由碳元素和氧元素组成,但是化学性质不同,是因为分子结构不同;
例题3、
【答案】 B
【解析】 元素性质与原子核外电子的排布,特别是最外层上的电子数目有密切关系,所以决定元素化学性质的是最外层电子数。
随练1、
【答案】 D
【解析】 元素性质与原子核外电子排布,特别是最外层电子数目有密切关系,所以决定元素化学性质的是最外层电子数。
随练2、
【答案】 C
【解析】 A、前者表示的是稀有气体元素氦,而后者表示的是镁元素的原子,二者化学性质不同;
B、表示的两种元素最外层电子数分别为7、1,最外层电子数不同,其化学性质也不同;
C、表示的两种元素分别是氦元素原子和氩元素原子的结构示意图,二种元素都属于稀有气体元素,化学性质相似;
D、表示的两种元素最外层电子数分别为8、6,最外层电子数不同,其化学性质也不同。
随练3、
【答案】 (1)He、Ne、Ar
(2)不相似
(3)得到
【解析】 (1)因有一个电子层时,电子数为2即为稳定结构,则He为稀有气体,有两个以上电子层时,最外层电子数为8的为稳定结构,由图可知则Ne、Ar为稀有气体;
(2)因He有一个电子层,则最外层电子数是2为稳定结构,化学性质稳定,但Be元素的原子有两个电子层,最外层电子数是2,则容易失去2个电子而满足稳定结构,化学性质较活泼,则它们的性质不相似;
(3)因元素的原子序数为16的是S元素,其最外层电子数为6,则容易得到2个电子而满足最外层8电子的稳定结构。
原子结构示意图
例题1、
【答案】 B
【解析】 A、在原子中,周期数=电子层数,③是钠离子,钠原子的核外有三个电子层,在第三周期;④是氖原子,核外有2个电子层,在第二周期,故A错;
B、②和⑥分别是镁元素和氧元素,形成的化合物是氧化镁,化学式为MgO,故B正确;
C、①和②的最外层电子数相同,但①最外层也是第一层,电子数是2,属于稳定结构,②属于不稳定结构;⑤和⑥的最外层电子数相同,化学性质相似,故C错误;
D、①③④具有稳定的结构,①④是原子,③是离子,故D错误。
例题2、
【答案】 C
【解析】 A、由图示可知:①②的最外层电子数不同,故化学性质不相同,故错误;
B、根据不同种元素最本质的区别是质子数不同,①③质子数不同,属于不同种元素;故错误;
C、②中核外电子数=核内质子数,为原子;④中核外电子数=核内质子数,为原子,故正确;
D、①中质子数<核外电子数,为阴离子;③中质子数>核外电子数,为阳离子;故错误。
例题3、
【答案】 (1)CD
(2)E
(3)CO2+C2CO
(4)11~18
【解析】 (1)同种元素的粒子是质子数相同,上述结构示意图中,属于同种元素的粒子是CD。
(2)某元素R与镁元素形成盐的化学式为MgR,镁元素显+2价,则R元素的化合价为-2价,化合价的数值等于离子所带电荷的数值,且符号一致,则R离子应带2个单位的负电荷,可能是上述粒子中的E。
(3)A的单质是碳,B为氧元素,A、B形成的化合物是二氧化碳,二氧化碳与碳在高温下反应生成一氧化碳,反应的化学方程式为:CO2+C2CO。
(4)若图2所示的粒子为中性原子,当质子数=核外电子数,为原子,则x=2+8+y,由图不难看出,该原子有三个电子层,应是第三周期的元素,x的数值范围是11~18。
随练1、
【答案】 D
【解析】 暂无解析
随练2、
【答案】 C
【解析】 A、质子数=8,核外电子数=10,质子数<核外电子数,为阴离子,故选项错误。
B、质子数=核外电子数=10,为原子,故选项错误。
C、质子数=12,核外电子数=10,质子数>核外电子数,为阳离子,故选项正确。
D、质子数=9,核外电子数=10,质子数<核外电子数,为阴离子,故选项错误。
随练3、
【答案】 A
【解析】 A、由某元素的原子结构示意图,圆圈内数字表示核内质子数,其核内质子数为16,故选项说法错误.
B、由某元素的原子结构示意图,圆圈内数字表示核内质子数,其核内质子数=核电荷数=16,故选项说法正确.
C、由某元素的原子结构示意图,弧线表示电子层,弧线上的数字表示该层上的电子数,则最外层电子数为6,故选项说法正确.
D、由某元素的原子结构示意图,有3个电子层,故选项说法正确.
随练4、
【答案】 (1)9
(2)A,C
(3)B
(4)C,D
【解析】 (1)在原子中,质子数=核外电子数,x=2+7=9;
(2)最外层电子数相同的元素化学性质相似,化学性质相似的原子是AC;
(3)最外层为电子数为8,属于相对稳定结构。具有稳定结构的原子B;
(4)元素是质子数(即核电荷数)相同的一类原子的总称,决定元素种类的是质子数(即核电荷数),同种元素的粒子是质子数相同,CD的质子数均为12,相同,属于同种元素。
离子的形成
例题1、
【答案】 C
【解析】 A、由该元素的原子结构示意图可知,该原子的核内质子数是16,故原子序数是16,故A正确;
B、该元素是硫元素,属于非金属元素,故B正确;
C、X原子得到电子形成的离子带2个单位的负电荷,不是正电荷,故C错误;
D、X的原子有三个电子层,位于第三周期,故D正确。
例题2、
【答案】 C
【解析】 由原子变为离子的过程中,原子得失电子形成离子,质子数、原子核一定不变;核外电子数、最外层电子数一定会发生改变;电子层数可能发生改变,也可能不变,如得到电子形成离子,电子层数不变;相对原子质量=质子数+中子数,由于质子数和中子数均不变,则相对原子质量不变;原子得失电子形成离子,电性发生了改变.
故一定发生变化的是②③⑦.
例题3、
【答案】 B
【解析】 A、质子数=核外电子数=10,为原子,故选项错误。
B、质子数=11,核外电子数=10,质子数>核外电子数,为阳离子,故选项正确。
C、质子数=核外电子数=12,为原子,故选项错误。
D、质子数=17,核外电子数=18,质子数<核外电子数,为阴离子,故选项错误。
例题4、[多选题]
【答案】 C D
【解析】 A、硫元素属于非金属元素,该选项说法不正确;
B、硫的相对原子质量是32.065,单位不是g,该选项说法不正确;
C、在硫原子中,质子数=电子数=16,该选项说法正确;
D、硫原子在化学反应中易得到2个电子形成S2-,该选项说法正确。
随练1、
【答案】 D
【解析】 A.核内质子数等于核外电子数,是原子,故A错。
B.核内质子数小于核外电子数,是阴离子,故B错。
C.核内质子数等于核外电子数,是原子,故C错。
D.核内质子数大于核外电子数,是阳离子,故D正确。
随练2、
【答案】 得到;氯;非金属
【解析】 A元素的最外层电子数是7,所以在化学反应中易得到1个电子而带负电荷,是阴离子,因此常表现为-1价,氯元素属于非金属元素.
随练3、
【答案】 C
【解析】 A、质子数=8,核外电子数=10,质子数<核外电子数,为阴离子,故选项错误。
B、质子数=核外电子数=10,为原子,故选项错误。
C、质子数=12,核外电子数=10,质子数>核外电子数,为阳离子,故选项正确。
D、质子数=核外电子数=13,为原子,故选项错误。
随练4、
【答案】 C
【解析】 A.由甲粒子的结构示意图,可知核电荷数=质子数=8<核外电子数=10,为阴离子;A说法错误;
B.由乙粒子的结构示意图,可知核电荷数=质子数=核外电子数=10,为原子;B说法错误;
C.不同种元素最本质的区别是质子数不同,由甲粒子的结构示意图,可知甲乙的质子数不同,甲、乙属于不同种元素,C说法正确;
D.由甲微粒的结构示意图可知甲的原子的最外层电子数为6,为非金属元素;乙为稀有气体,D说法错误;
离子的分类(阳离子、阴离子)
例题1、
【答案】 C
【解析】 A.二氧化碳是由二氧化碳分子构成,故A错。
B.氢气是由氢分子构成的,故B错;
C.氯化钠是由钠离子和氯离子构成的,故C正确。
D.水银是由汞原子构成的,故D错。
例题2、
【答案】 B
【解析】 A、二氧化碳是由非金属元素组成的化合物,是由二氧化碳分子构成的,故选项错误。
B、氯化钠是含有金属元素和非金属元素的化合物,氯化钠是由钠离子和氯离子构成的,故选项正确。
C、铁属于金属单质,是由铁原子直接构成的,故选项错误。
D、氖气属于稀有气体单质,是由氖原子直接构成的,故选项错误。
例题3、
【答案】 B
【解析】 A、水是由非金属元素组成的化合物,是由水分子构成的,故选项错误。
B、氯化钠是含有金属元素和非金属元素的化合物,氯化钠是由钠离子和氯离子构成的,故选项正确。
C、二氧化碳是由非金属元素组成的化合物,是由二氧化碳分子构成的,故选项错误。
D、氦气属于稀有气体单质,是由氦原子直接构成的,故选项错误。
例题4、
【答案】 B
【解析】 A、原子通过得失电子可以转化为离子,故选项说法正确.
B、原子是化学变化中最小的微观粒子,不在化学变化中,原子可以再分,故选项说法错误.
C、物质是由分子、原子、离子构成的,有些物质是由原子构成的,故选项说法正确.
D、分子是由原子构成的,故选项说法正确.
随练1、
【答案】 B
【解析】 稀有气体的单原子分子就是很小的,比一些原子还小,故A错误;
分子是构成物质的一种微粒.原子也是构成物质的一种微粒.在化学变化中,一些原子容易失去电子,而另一些原子则容易得到电子,当原子得到或失去核外电子从而带上电荷以后,便转变为离子.离子也是构成物质的一种微粒.故B正确;
在受热情况下,分子能量增大,运动速率加快,故C错误;
在化学反应中原子,离子可以通过得失电子相互转化,故D不正确.
随练2、
【答案】 D
【解析】 暂无解析
随练3、
【答案】 A
【解析】 暂无解析
离子符号
例题1、
【答案】 D
【解析】 暂无解析
例题2、
【答案】 C
【解析】 A、CO表示1个一氧化碳分子,正确;
B、2CO32-表示2个碳酸根离子,正确;
C、3Fe3+表示3个铁离子,错误;
D、4C表示4个碳原子,正确;
例题3、
【答案】 C
【解析】 科学家成功制备出了一种含铱元素的阳离子,在这种离子中,铱元素显+9价。
A、IrO2+中氧元素显-2价,设铱元素的化合价是x,由原子团中元素的化合价代数和等于原子团的化合价,可得:x+(-2)×2=+1,则x=+5价,故选项错误。
B、IrO3+氧元素显-2价,设铱元素的化合价是y,由原子团中元素的化合价代数和等于原子团的化合价,可得:y+(-2)×3=+1,则y=+7价,故选项错误。
C、IrO4+中氧元素显-2价,设铱元素的化合价是z,由原子团中元素的化合价代数和等于原子团的化合价,可得:z+(-2)×4=+1,则z=+9价,故选项正确。
D、IrO5+中氧元素显-2价,设铱元素的化合价是w,由原子团中元素的化合价代数和等于原子团的化合价,可得:w+(-2)×5=+1,则w=+11价,故选项错误。
随练1、
【答案】 B
【解析】 ①H2O2、②Si分别表示过氧化氢分子、硅原子.
由离子的表示方法,在表示该离子的元素符号右上角,标出该离子所带的正负电荷数,数字在前,正负符号在后,带1个电荷时,1要省略.③S2-可表示硫离子,⑤镁离子的正确书写方法是Mg2+.
④,质子数=9,核外电子数=10,质子数<核外电子数,为阴离子.
故正确表示离子的是③④.
随练2、
【答案】 ;2Fe2+
【解析】 暂无解析
随练3、
【答案】 SO42-
【解析】 硫酸铜是含有金属元素和非金属元素的化合物,硫酸铜是由铜离子和硫酸根离子构成的,其离子符号为:SO42-.
拓展
1、
【答案】 D
【解析】 氦3原子核内有2个质子和1个中子,原子中质子数=核外电子数,则氦3原子核外有2个电子;则氦3原子结构示意图中,核内质子数为2,核外有1个电子层,该电子层上的数字为2,氦3原子结构示意图是.
2、
【答案】 A
【解析】 A、由质子数和中子数之和为14,质子数为6,则中子数为14-6=8,说法错误.
B、由碳-14原子的核电荷数为6,根据质子数等于核电荷数,则质子数为6,说法正确.
C、因质子数等于电子数,质子数为6,则电子数为6,说法正确.
D、因核电荷数为6,根据质子数等于核电荷数,则质子数为6,质子数和中子数之和为14,说法正确.
3、
【答案】 (1)金属;
(2)质子数;
(3)A.
【解析】 (1)钋元素属于金属元素,故填:金属;
(2)氢原子和氚原子属于同种元素的原子是因为二者的质子数相同,故填:质子数;
(3)图2中表示氘原子的结构示意图的是A,故填:A.
4、
【答案】 D
【解析】 A、镉(Cd)的原子序数为48,根据在原子中质子数=原子序数可知,镉原子的质子数为48,故此说法正确.
B、镉(Cd)的原子序数为48,根据在原子中原子序数=核外电子数可知,镉原子的核外电子数为48,故此说法正确.
C、镉字的偏旁是“金”字旁,故镉是金属元素,故此说法正确.
D、相对原子质量单位是1,原子质量的单位是g,故此说法错误.
5、
【答案】 C
【解析】 原子序号即为原子的质子数,故该新元素的质子数为112,新元素的质量为氢原子的277倍,氢原子的相对原子质量为1,故新元素的相对原子质量为277,原子的相对原子质量在数值上等于质子数加中子数,则中子数为165,故C项正确。
6、
【答案】 D
【解析】 A、由于铀的元素名称铀中含有偏旁“钅”故该元素属于金属元素;
B、原子中质子数等于核外电子数,故铀核外含有92个电子;
C、原子中质子数等于核电荷数,核电荷数为92;
D、由于相对原子质量≈质子数+中子数,143是中子数,不是相对原子质量.
7、
【答案】 B
【解析】 暂无解析
8、
【答案】 B
【解析】 A、相对原子质量是个比值,是一个比值,单位是“1”,常省略不写,碳的相对原子质量是12,单位不是克,故选项错误;
B、相对原子质量是个比值,是一个比值,单位是“1”,常省略不写,碳的相对原子质量是12,故选项正确;
C、相对原子质量是个比值,是一个比值,单位是“1”,常省略不写,碳的相对原子质量是12,不是1.66×10-27千克,故选项错误;
D、相对原子质量是个比值,是一个比值,单位是“1”,常省略不写,碳的相对原子质量是12,单位不是克,故选项错误。
9、
【答案】 2m
【解析】 原子的相对原子质量与原子的质量呈正比,已知某氧原子的相对原子质量为16,某硫原子的相对原子质量为32,如果该氧原子的质量为m,则该硫原子的质量为.
10、
【答案】 (1)53
(2)非金属;E
【解析】 (1)由于I-是碘原子得到一个电子形成的,在原子中,核河内的质子数等于核外的电子数.所以,X=2+8+18+18+8-1=53;
(2)碘元素的汉字名称中在带“石”字旁,属于非金属元素,最外层电子数是7,由于决定元素化学性质的是最外层电子数,E的最外层是7,所以与I化学性质相似的是E.
11、
【答案】
【解析】 解:A、由元素x的原子结构示意图,核内质子数为12,为镁元素,属于金属元素,故选项说法错误.
B、由元素x的原子结构示意图,最外层电子数为2,原子最外电子层没有达到稳定结构,故选项说法错误.
C、由元素x的原子结构示意图,圆圈内的数字是12,该原子的核电荷数为l2,故选项说法正确.
D、由元素x的原子结构示意图,最外层电子数为2,在化学反应中易失去2个电子而形成带2个单位正电荷的阳离子,其元素的化合价为+2价,氯元素显﹣1价,其化合物的化学式为XCl2,故选项说法错误.
故选:C.
12、
【答案】 A
【解析】 暂无解析
13、
【答案】 D
【解析】 元素是质子数(即核电荷数)相同的一类原子的总称,不同种元素最本质的区别是质子数(即核电荷数)不同,所以氧元素与氮元素的本质区别是质子数(即核电荷数)不同.
14、
【答案】 A
【解析】 A、根据锶元素在元素周期表中显示的信息可知,其原子序数是38,又核内质子数=原子序数,因此锶元素的核内质子数等于38,图2、图3中的微粒的核内质子数都为38,根据元素的种类取决于核内质子数可以知道图2、图3都属于锶元素,故说法正确;
B、图3所表示粒子的核内质子数是38,核外电子数是36,核内质子数大于核外电子数,是锶离子,带2个单位的正电荷,其化学符号是Sr2+;故说法错误;
C、根据锶元素在元素周期表中显示的信息可知,其相对原子质量为87.62,又其核内质子数=原子序数=38,根据相对原子质量约等于质子数加中子数可知,锶原子的中子数不等于38,故说法错误;
D、根据锶元素在元素周期表中显示的信息可知,锶原子的相对原子质量是87.62,不是87.62g,故说法错误.
15、
【答案】 D
【解析】 A.①和②属于同种元素的粒子,核内质子数决定元素的种类,故A正确;
B.①和③的化学性质相似,最外层电子数决定元素的化学性质,故B正确;
C.粒子②是一种阴离子,核内质子数小于核外电子数,故C正确;
D.③和④不可能属于同种元素,核内质子数决定元素的种类,故D正确。
16、【答案】 C
【解析】 A、最外层电子数是6,在化学反应中易得到2个电子而形成阴离子,不具有稳定结构,故选项错误.
B、该粒子最外层电子数为8,但该粒子质子数=12,核外电子数=10,质子数>核外电子数,为阴离子,故选项错误.
C、该粒子最外层电子数为8,质子数=核外电子数=10,为原子,故选项正确.
D、该粒子最外层电子数为8,但该粒子质子数=9,核外电子数=10,质子数<核外电子数,为阴离子,故选项错误.
17、
【答案】 B
【解析】 A、由钙元素的原子结构示意图可知,核外共有4个电子层,故A错误;
B、由钙元素的原子结构示意图可知,最外层电子数为2,在化学反应中易失电子,故B正确;
C、由钙元素的原子结构示意图可知,核外电子总数为:2+8+8+2=20,故C错误;
D、在化学反应中“易得”电子,说法错误,故D错误.
18、
【答案】 D
【解析】 A、由某元素的原子结构示意图,圆圈内的数字是12,该元素原子核内有12个质子,故选项说法正确.
B、由某元素的原子结构示意图,该粒子核外有3个电子层,故选项说法正确.
C、由某元素的原子结构示意图,该原子的核外电子数为2+8+2=12,故选项说法正确.
D、由某元素的原子结构示意图,最外层电子数是2,在化学反应中易失去2个电子而形成阳离子,故选项说法错误.
A.原子中一定含有质子、中子和电子
B.自然界中的物质都在不断运动
C.增大氧气的浓度能促进可燃物的燃烧
D.任何纯净物都有固定的组成
A.原子是最小的粒子
B.原子质量主要集中在原子核上
C.原子的质子数等于核电荷数
D.原子的化学性质由最外层电子数决定
A.abcd
B.bcd
C.abc
D.ad
A.原子可以构成分子
B.原子是化学反应中的最小微粒
C.原子是由原子核和核外电子构成的
D.原子不带电是因为原子中不存在带电的粒子
A.10
B.34
C.44
D.78
A.中子数为145
B.核外电子数为94
C.质子数为94
D.核电荷数为239
A.126,88
B.38,50
C.50,88
D.38,126
A.12个
B.15个
C.16个
D.17个
A.30
B.26
C.56
D.4
A.同种元素的两种原子
B.一种分子和一种离子
C.两种分子
D.一种分子和一种原子
A.门捷列夫
B.拉瓦锡
C.张青莲
D.道尔顿
A.原子由原子核和核外电子构成,不显电性
B.碳的相对原子质量是12g
C.“酒香不怕巷子深”说明分子在不停运动
D.钠的原子序数是11,元素符号是Na
A.32m
B.12m
C.2m
D.m
A.12个
B.15个
C.16个
D.17个
A.铝
B.镁
C.硫
D.磷
A.该粒子可表示为X+
B.X是金属元素
C.X的原子最外层电子数为8
D.该粒子最外电子层是相对稳定结构
A.
B.
C.
D.
A.它们表示三种元素
B.②③的化学性质相同
C.②表示的元素是金属元素
D.①表示的是原子,而④表示的是阴离子
A.质子数
B.最外层电子数
C.中子数
D.电子层数
A.质子数
B.中子数
C.核电荷数
D.最外层电子数
A.
B.
C.
D.
A.①、②表示的微粒化学性质相同
B.①、③表示粒子属于同种元素
C.②、④表示的粒子均是原子
D.①、③表示的粒子都是阳离子
A.①和②属于同种元素的粒子
B.①和③的化学性质相似
C.粒子②是一种阴离子
D.③和④可能属于同种元素
A.
B.
C.
D.
A.该原子的质子数为6
B.该原子的核电荷数为16
C.该原子的最外层电子数为6
D.该原子的核外共有3个电子层
A.②③④
B.①⑤⑥
C.②③⑦
D.①②③④⑦
A.
B.
C.
D.
A.
B.
C.
D.
A.
B.
C.
D.
A.甲是阳离子
B.乙是阴离子
C.甲、乙属于不同种元素
D.甲、乙都属于金属元素
A.二氧化碳
B.氢气
C.氯化钠晶体
D.水银
A.二氧化碳
B.氯化钠
C.铁
D.氖气
A.水
B.氯化钠
C.二氧化碳
D.氦气
A.原子可以转化为离子
B.原子是最小的微观粒子
C.有些物质是由原子构成的
D.原子可以“搭建”成分子
A.铜
B.二氧化碳
C.金刚石
D.氯化钠
A.硫酸根离子:SO42-
B.铝元素:Al
C.碳酸:H2CO3
D.2个氮分子:2N
A.1个一氧化碳分子:CO
B.2个碳酸根离子:2CO32-
C.3个铁离子:3Fe2+
D.4个碳原子:4C
A.IrO2+
B.IrO3+
C.IrO4+
D.IrO5+
A.①②
B.③④
C.②④
D.③⑤
A.
B.
C.
D.
A.中子数为6
B.质子数为6
C.电子数为6
D.质子数与中子数之和为14
A.镉原子的质子数为48
B.镉原子的核外电子数为48
C.镉是金属元素
D.镉原子的相对原子质量为112 g
A.112
B.277
C.165
D.389
A.属于金属元素
B.电子数为92
C.核电荷数为92
D.相对原子质量为143
A.是非金属元素
B.相对原子质量为78.96g
C.原子序数为34
D.元素符号为Se
A.12克
B.12
×10-27千克
D.克
A.质子数、最外层电子数
B.质子数、电子数
C.中子数、最外层电子数
D.最外层电子数、质子数
A.相对原子质量不同
B.中子数不同
C.中子数与核外电子数之和不同
D.质子数不同
A.图2、图3都属于锶元素
B.图3所表示粒子的化学符号是Sr
C.锶原子的中子数为38
D.锶原子的相对原子质量是87.62g
A.①和②属于同种元素的粒子
B.①和③的化学性质相似
C.粒子②是一种阴离子
D.③和④可能属于同种元素
A.
B.
C.
D.
A.核外共有2个电子层
B.在化学反应中易失电子
C.核外电子总数为40
D.在化学反应中易得电子
A.该原子的质子数为12
B.该原子的核外有三个电子层
C.该原子的核外电子数为12
D.该原子在化学反应中容易得到2个电子
相关学案
这是一份初中化学人教版九年级上册第三单元 物质构成的奥秘课题2 原子的结构学案,共12页。学案主要包含了学习目标,重难点,考点精讲等内容,欢迎下载使用。
这是一份人教版九年级上册第三单元 物质构成的奥秘课题1 分子和原子学案设计,共20页。
这是一份人教版九年级上册课题3 制取氧气导学案,共31页。学案主要包含了实验方案,实验记录等内容,欢迎下载使用。










