

安徽省六安第一中学2024届高三下学期质量检测(二+)化学试题
展开
这是一份安徽省六安第一中学2024届高三下学期质量检测(二+)化学试题,共12页。试卷主要包含了 劳动有利于“知行合一”, 下列表示正确的是, 下列对事实的分析正确的是等内容,欢迎下载使用。
满分:100分 时间:75分钟
可能用到的相对原子质量:H 1 C 12 N 14 Cl 35.5 C 59 Cu 64 Pb 207
一、单选题(本题共14小题,每小题3分,共42分。在每小题给出的四个选项中,只有一项是符合题目要求的)
1. 劳动有利于“知行合一”。下列劳动项目与所述的化学知识没有关联的是( )
A. AB. BC. CD. D
2. 下列表示正确的是( )
A. 的价层电子对互斥(VSEPR)模型:
B. 的电子式:
C. 基态的价层电子轨道表示式:
D. 的名称:乙二酸乙二酯
3. 常温下,下列各组离子在给定溶液中能大量共存的是( )
A. 溶液中:、、、
B. 的溶液:、、、
C. 溶液中:、、、
D. 能使甲基橙变红的溶液中:、、、
4. AlN是一种半导体材料,一种制备方法是。设为阿伏加德罗常数的值。下列叙述正确的是( )
A. 标准状况下,含键数目为
B. 12g C(金刚石)含非极性键数目为
C. 每生成1ml AlN时转移电子数目为
D. 溶于足量盐酸,溶液中含数目为
5. 一种在航空航天、国防军工等领域具有应用前景的液晶聚芳酯G可由如下反应制备。下列说法错误的是( )
A. ,化合物X为乙酸B. 化合物F最多有24个原子共平面
C. 反应说明化合物E可发生缩聚反应D. 聚芳酯G与稀和NaOH溶液均可反应
6. 下列应用中涉及氧化还原反应的是( )
A. 用二氧化硫作漂白剂使色素褪色B. 用过氧化钠作潜水艇中的供氧剂
C. 使用明矾对自来水进行净化D. 使用热的纯碱溶液去除油污
7. 下列对事实的分析正确的是( )
A. AB. BC. CD. D
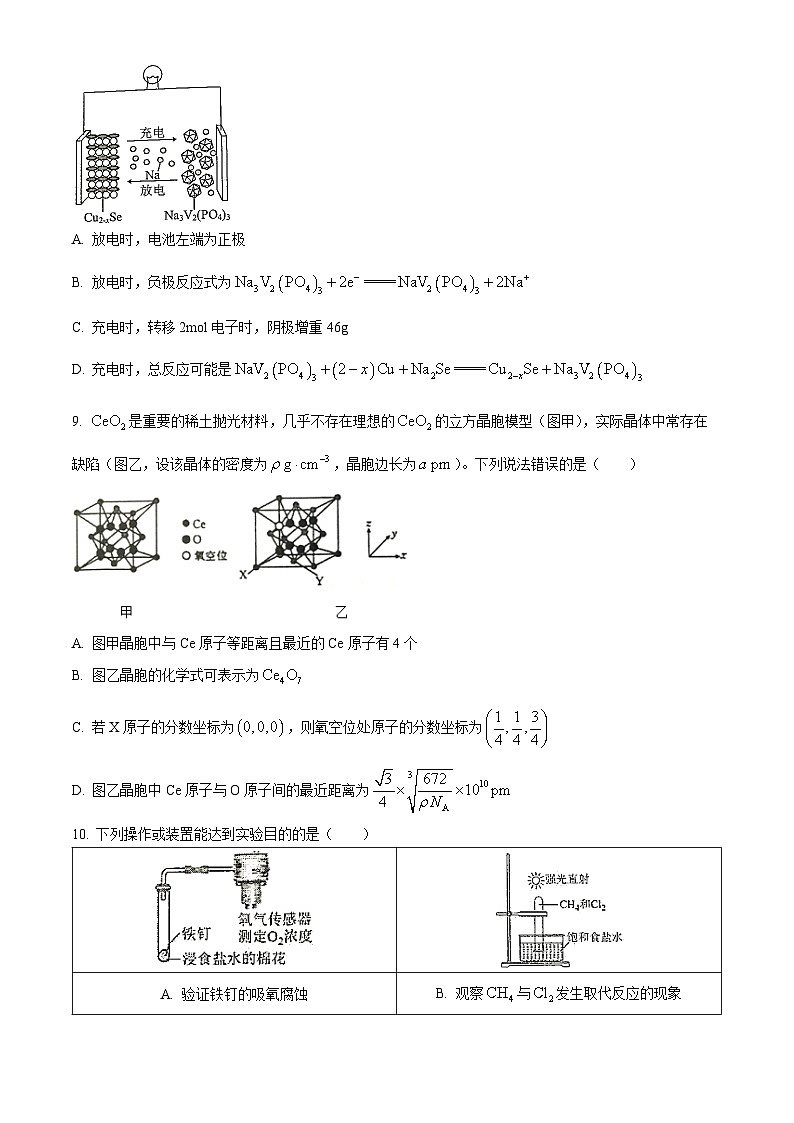
8. 近日,我国科学家开发一款新型钠离子二次电池,工作原理如图所示。已知:钒常见的化合价有+2、+3、+4、+5。放电时最终还原产物为和Cu,氧化产物为。下列叙述错误的是( )
A. 放电时,电池左端为正极
B. 放电时,负极反应式为
C. 充电时,转移2ml电子时,阴极增重46g
D. 充电时,总反应可能是
9. 是重要的稀土抛光材料,几乎不存在理想的的立方晶胞模型(图甲),实际晶体中常存在缺陷(图乙,设该晶体的密度为,晶胞边长为)。下列说法错误的是( )
A. 图甲晶胞中与Ce原子等距离且最近的Ce原子有4个
B. 图乙晶胞的化学式可表示为
C. 若X原子的分数坐标为,则氧空位处原子的分数坐标为
D. 图乙晶胞中Ce原子与O原子间的最近距离为
10. 下列操作或装置能达到实验目的的是( )
A. AB. BC. CD. D
11. 已知X、Y、Z、W、R是原子序数依次增大的五种短周期元素,W和R组成的一种化合物具有强氧化性,可用于自来水消毒,五种元素形成的某种化合物结构如图,下列说法正确的是( )
A. 原子半径:R>W>Z>Y>XB. 简单氢化物的沸点:R>W>Z>Y
C. W单质均为非极性分子D. X和Z组成的化合物可能含有非极性键
12. 是电解铝烟气的主要组分之一,属于强温室气体,其温室效应指数为的7390倍。我国科学家用作为催化剂实现了催化水解,其历程如图所示。下列说法错误的是( )
A. 总反应为
B. 不能改变总反应的
C. 反应过程中,、键既有断裂又有形成
D. 反应过程中涉及的小分子包含两种非极性分子
13. 辉铜矿(,含杂质和)合成流程如图所示。下列说法中错误的是( )
A. 气体X的主要成分为B. 步骤Ⅱ中滤渣主要成分为
C. 溶液D为深蓝色D. 步骤Ⅳ的操作为蒸发结晶
14. 菠萝“扎嘴”的原因之一是菠萝中含有一种难溶于水的草酸钙针晶。常温下,草酸钙在不同pH下体系中与pH关系如图所示(M代表、、、),已知、。下列有关说法正确的是( )
A. 数量级为
B. 溶液时,
C. 时,曲线①呈上升趋势的原因是部分转化为
D. A点时,体系中
二、非选择题:本题共4小题,共58分。
15.(14分)铜(I)配合物的制备及纯度分析步骤如下。
Ⅰ. 制备
将乙腈、、过量铜粉混合于圆底烧瓶,控温85℃、磁力搅拌,至反应完全(装置如图)。经一系列操作,得到白色固体产品。
Ⅱ. 纯度分析
取产品完全溶解于足量浓硝酸中,再加水、醋酸钠溶液配成250.0mL溶液。取25.0mL溶液,加入指示剂后,再用标准溶液滴定至终点。平行滴定三次,消耗EDTA溶液的平均体积为。
已知:①沸点为81℃,酸性条件下生成醋酸()和铵盐()
②()较易被空气氧化;
③EDTA与形成配合物;
④滴定需在弱碱性条件下进行。
回答下列问题:
(1)图中仪器a的作用是______;b中应加入______作为最佳传热介质。
(2)加入过量铜粉能提高产物的纯度,可能的原因是____________。
(3)“一系列操作”依次为______(操作名称)、蒸发浓缩、冷却结晶、过滤、洗涤、干燥。
(4)与足量浓硝酸发生反应的离子方程式为____________。
(5)加入醋酸钠溶液的主要目的是____________。
(6)测得产品的纯度为____________(用含m、c、V的代数式表示)。
16.(14分)草酸钴是制作氧化钴和金属钴的原料。一种利用含钴废料(主要成分为,含少量、、CaO、MgO、碳及有机物等)制取的工艺流程如图:
(1)“550℃焙烧”的目的是____________。
(2)“碱浸”过程中浸出液主要成分是____________。
(3)“钴浸出”过程中,不能用盐酸代替硫酸,因为与盐酸反应生成污染环境,该反应的离子方程式为____________,的作用是____________。
(4)“净化除杂1”过程中,先在加入,再升温至,加入溶液,调pH至4.5。滤渣1的主要成分是____________金属离子与反应的离子方程式为____________。
(5)“净化除杂2”过程中,加入NaF以除去原溶液中(浓度为)和,若控制溶液中,则的去除率准确值为______。[已知某温度下,]
17.(15分)我国科学家成功利用光伏发电,将电解水获得的与反应合成甲醇,再由甲醇经若干酶促反应合成淀粉。该研究成果已在国际学术期刊《科学》上发表。回答下列问题:
(1)人工合成转化为淀粉只需要11步,其中前两步涉及的反应如图所示。
反应的______(用含、、、的代数式表示)。
(2)有学者结合实验和计算机模拟结果,得出的一种反应历程如图所示,其中吸附在催化剂表面的物种用“·”标注,TS1、TS2、TS3、TS4均为过渡态。决速步骤对应的化学方程式为____________;TS3对应的步骤适合在______(填“高温”或“低温”)条件下进行。
(3)在密闭容器中充入一定量的和,发生反应 ,在催化剂作用下单位时间内的转化率与温度、催化剂的关系如图所示。
①a点时,的生成速率______(填“>”“<”或“=”)的消耗速率;
②b点之后的转化率降低,可能的原因是____________;
(4)已知催化加氢的主要反应如下:
反应Ⅰ.
反应Ⅱ.
①230℃时,将和按物质的量之比为混合通入恒温刚性密闭容器中,在催化剂作用下同时发生反应Ⅰ和反应Ⅱ,容器内压强随时间的变化如下表所示。
平衡时,则该温度下反应Ⅰ的化学平衡常数______(用含的代数式表示)。
②二氧化碳催化加氢合成甲醇反应往往伴随副反应Ⅱ。一定温度和压强条件下,为了提高反应速率和甲醇选择性,应当____________。
18.(15分)依度沙班主要用于预防和治疗手术后的静脉血栓栓塞,临床效果显著。以下是其一种重要中间体的盐酸盐(化合物J)的合成路线:
已知:代表碳酸䣲二叔丁酯;Et代表乙基;n-Bu代表正丁基。
回答下列问题:
(1)A的化学名称是异烟酸,则C的化学名称是____________;
(2)C中氮原子的轨道杂化类型____________;
(3)B转变为C的化学方程式为____________,反应类型为____________;
(4)K是B同分异构体,同时满足下列条件的K共有______种;
①含有苯环;②直接和苯环相连。
其中,核磁共振氢谱显示为三组峰,且峰面积比为的物质的结构简式为______(任写一种)。
(5)结合本题合成路线,以为主要原料(其他有机试剂和无机试剂任选),设计制备的合成路线:____________。
六安一中2024届高三年级质量检测卷
化学试卷(二)参考答案
一、单选题(每小题3分,共45分)
1. C
2. A. 的中心原子价层电子对数为,其VSEPR模型为平面三角形,A正确;
B. 的电子式为,B错误;
C. 基态的价层电子轨道表示式为C错误;
D. 的名称为乙二酸二乙酯,D错误。
3. B A. 溶液中和会发生双水解反应,不能大量共存,故A不选;
B. 常温下,的溶液呈碱性,、、、、之间不发生反应,可以大量共存,故B选;
C. 溶液中、和发生氧化还原反应不能大量共存,故C不选;
D. 能使甲基橙变红的溶液中呈酸性,和反应生成二氧化碳,不能大量共存。
4. B 5. B
A. 由上述方程式可以判断,X为羟基和结合成的乙酸分子,p等于,
B. F中,左侧甲基上的3个氢有1个可能与右边的分子整体共平面,故最多有25个原子可能共平面,故B错误;
C. 由方程式可知,E分子中含有酯基和羧基,E也可以发生缩聚反应,故C正确;
D. 聚芳酯G中含有酯基,稀和NaOH溶液均可发生水解反应,故D正确。
6. B 7. C 8. B
A. 由题干图示信息可知,根据放电时的移动方向可知,放电时,电池左端为正极,A正确;
B. 放电时负极发生氧化反应,故负极反应式为,B错误;
C. 由分析可知,充电时,每生成转移2ml电子,理论上迁移,阴极增重46g,C正确;
D. 由分析可知,充电时,阴极反应式为,阳极式为:;故总反应可能是,D正确。
9. A
A. 由图甲知,Ce位于面心和顶点,晶胞中与Ce原子等距且最近的Ce原子为面对角线的处,共有个,A错误;
B. 由图乙知,晶胞中Ce的个数为,O的个数为7,故化学式可表示为,
C. 由图乙知,若X原子的分数坐标为,由俯视知,氧空位处原子的x和y分数坐标为,由正视知,z的分数坐标为,C正确;
D. 由图乙知,晶胞中Ce原子与O原子间的最近距离为体对角线的,由密度得,晶胞边长为,体对角线为,故Ce原子与O原子间的最近距离为,D正确。
10. A 11. D
A. 同周期元素,从左到右原子半径依次减小,则氧原子、氮原子、碳原子的原子半径依次增大,故A错误;
B. 水分子能形成分子间氢键,氯化氢不能形成分子间氢键,所以水的分子间作用力大于氯化氢,沸点高于氯化氢,故B错误;
C. 二氧化氯是分子结构不对称的V形,属于极性分子,故C错误;
D. 肼分子的分子式为,是含有极性键和非极性键的极性分子,故D正确;
故选D。
12. C
A. 从循环反应中可得,为催化剂,发生反应的方程式为,
B. 为催化剂,催化剂改变反应历程,降低活化能,不改变总反应的,B正确;
C. 反应过程中,既有断裂又有形成,键只有断裂没有形成,C错误;
D. 反应过程中涉及的小分子有、、、HF,其中、为非极性分子。
13. D 【详解】A. 由分析可知,气体X的主要成分为二氧化硫,故A正确;
B. 由分析可知,滤渣主要成分为二氧化硅,故B正确;
C. 由分析可知,溶液D为深蓝色的硫酸四氨合铜溶液,故C正确;
D. 由分析可知,步骤Ⅳ的操作为蒸发浓缩、冷却结晶、过滤、洗涤、干燥,故D错误;
故选D。
14. B 【详解】A. ,,①③相交时从图中可知此时pH大于4小于5,所以数量级为,故A错误;
B. 溶液时,溶液中电荷守恒,所以,
C. 由图像可知,时,如,,,此时,即没有氢氧化钙沉淀析出,
D. 据以上分析可知,①表示、②表示、③表示、④表示,所以A点时①表示的浓度小于此时溶液中的,故D错误。
二、非选择题(共58分)
15.(14分)(1)冷凝回流 水
(2)能将反应中可能生成的二价铜还原为一价铜
(3)过滤
(4)
(5)为滴定提供碱性环境
(6)
16.(14分)(1)除去碳和有机物
(2)
(3) 将和还原为和(作还原剂)
(4)
(5)90%
17.(15分)(1)(3分)
(2)(或) 低温
(3)> 温度升高,平衡向逆反应方向移动(或催化剂活性降低;或温度升高反应左移与催化剂活性降低共同作用)
(4) 选择适宜的催化剂
18.(1)异烟酸酰胺
(2)sp2
(3) 取代反应
(4)9 或
(5)选项
劳动项目
化学知识
A
帮厨活动:帮食堂师傅煎鸡蛋准备午餐
加热使蛋白质变性
B
环保行动:宣传使用聚乳酸制造的包装材料
聚乳酸在自然界可生物降解
C
家务劳动:擦干已洗净的铁锅,以防生锈
铁丝在中燃烧生成
D
学农活动:利用秸秆、厨余垃圾等生产沼气
沼气中含有的可作燃料
选项
事实
分析
A
键角:
电负性:C<N<O
B
第一电离能:P>S
原子半径:P>S
C
沸点:
CO为极性分子,为非极性分子
D
热稳定性:HF>HCl
HF中存在氢键,HCl中不存在氢键
A. 验证铁钉的吸氧腐蚀
B. 观察与发生取代反应的现象
C. 制取并收集
D. 探究压强对平衡的影响
时间/min
0
20
40
60
80
压强/MPa
1
2
3
4
5
6
7
C
A
B
B
B
B
C
8
9
10
11
12
13
14
B
A
A
D
C
D
B
相关试卷
这是一份2024安徽省京师测评高三质量联合检测化学试题,文件包含2024安徽省高三质量联合检测化学试卷docx、2024安徽省高三质量联合检测化学答案定稿pdf等2份试卷配套教学资源,其中试卷共10页, 欢迎下载使用。
这是一份2024安徽省京师测评高三质量联合检测化学试题,文件包含2024安徽省高三质量联合检测化学试卷docx、2024安徽省高三质量联合检测化学答案定稿pdf等2份试卷配套教学资源,其中试卷共10页, 欢迎下载使用。
这是一份2024安徽省京师测评高三质量联合检测化学试题,文件包含2024安徽省高三质量联合检测化学试卷docx、2024安徽省高三质量联合检测化学答案定稿pdf等2份试卷配套教学资源,其中试卷共10页, 欢迎下载使用。









