
还剩7页未读,
继续阅读
四川省攀枝花市第三高级中学校2023-2024学年高一下学期期中考试化学试题(无答案)
展开这是一份四川省攀枝花市第三高级中学校2023-2024学年高一下学期期中考试化学试题(无答案),共10页。试卷主要包含了05,5分,共40分,5 kJ/ml,已知等内容,欢迎下载使用。
考生注意:
1.试题总分100分,考试时间70分钟
2.请考生用2B铅笔将选择题答案涂在答题卡上,直接书写在试卷上无效
3.请考生用0.5mm黑色签字笔将非选择题答案直接书写在答题卡相应区域内
4.可能用到的相对原子质量:
H-1 C-12 N-14 O-16 Na-23 Mg-24 S-32 Fe-56 Cu-64
第I卷(选择题共40分)
一、选择题:(本大题包括16小题,每小题2.5分,共40分。每小题只有一个选项符合题意。)
1.化学与生活密切相关,下列说法正确的是( )
A.酸雨是指pH7的雨水
B.碳纳米材料属于新型有机高分子材料
C.门窗玻璃、计算机芯片、混凝土桥墩都含有二氧化硅
D.葡萄酒、果脯中加入适量以起到杀菌、抗氧化的作用
2.下列说法正确的是( )
A.实验室用稀硝酸清洗附着在试管内壁的银,说明稀硝酸具有酸性
B.人类通过控制条件,将氮气氧化或还原为氮的化合物,实现人工固氮
C.工业上常用铁罐盛装大量稀硫酸
D.普通玻璃以纯碱、熟石灰和石英砂为原料,发生复杂的物理和化学变化制得
3.下列有关化学用语表达正确的是( )
A.十一烷的结构式为:B.和互为同系物
C.丙烷分子的球棍模型:D.分子的空间填充模型:
4.和在催化剂表面合成氨的微观历程示意图如下,用、、分别表示、、,下列说法正确的是( )
A.②到③过程中,需要释放能量
B.③到④变化过程中,需要吸收能量
C.催化剂的作用只是吸附反应物,不能加快反应速率
D.因反应中化学键断裂吸收的能量小于形成新化学键放出的能量,故该反应为放热反应
5.下列关于原电池的说法中,正确的是( )
A.原电池是一种能把电能转化为化学能的装置
B.原电池的总反应可以不是氧化还原反应
C.原电池的两个电极可以不是金属
D.原电池工作时,电子流入的一极是负极
6.下列反应中,调节反应物质的用量或反应条件,不会改变反应产物的是( )
A.硫粉在氧气中点燃B.通入烧碱溶液中
C.硝酸中加入铁粉D.钠与氧气反应
7.设代表阿伏加德罗常数的值,以下说法正确的是( )
A.4.4 g 含有共价键数目为
B.17 g 与22.4 L(标准状况下)HCl混合后的气体分子数为
C.标准状况下,11.2 L甲烷与氯气在光照条件下充分反应得到均为
D.足量铜与10 mL 18.4 ml/L浓硫酸充分反应,得到的分子数目为
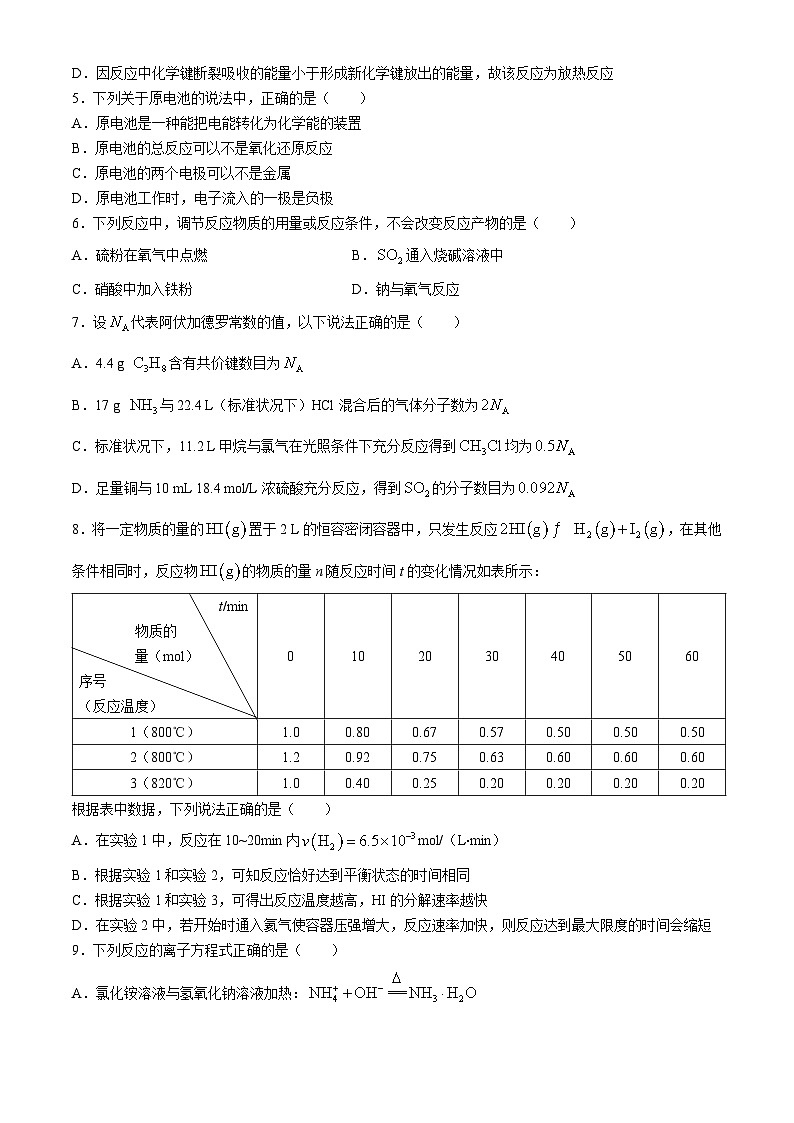
8.将一定物质的量的置于2 L的恒容密闭容器中,只发生反应,在其他条件相同时,反应物的物质的量n随反应时间t的变化情况如表所示:
根据表中数据,下列说法正确的是( )
A.在实验1中,反应在10~20min内ml/(L⋅min)
B.根据实验1和实验2,可知反应恰好达到平衡状态的时间相同
C.根据实验1和实验3,可得出反应温度越高,HI的分解速率越快
D.在实验2中,若开始时通入氦气使容器压强增大,反应速率加快,则反应达到最大限度的时间会缩短
9.下列反应的离子方程式正确的是( )
A.氯化铵溶液与氢氧化钠溶液加热:
B.通入新制氯水:
C.向硝酸亚铁溶液中加入稀硫酸:
D.往水玻璃中通入过量二氧化碳:
10.下图的每一方格中表示有关的一种反应物或生成物,其中A、C、D、E为无色气体,F为红棕色气体。下列说法不正确的是( )
A.F与水的反应中氧化剂与还原剂的物质的量之比为2∶1
B.用蘸有浓盐酸的玻璃棒靠近瓶口可以检验C气体是否收集满
C.M可能是纯净物或混合物
D.D在一定条件下可以与C发生置换反应
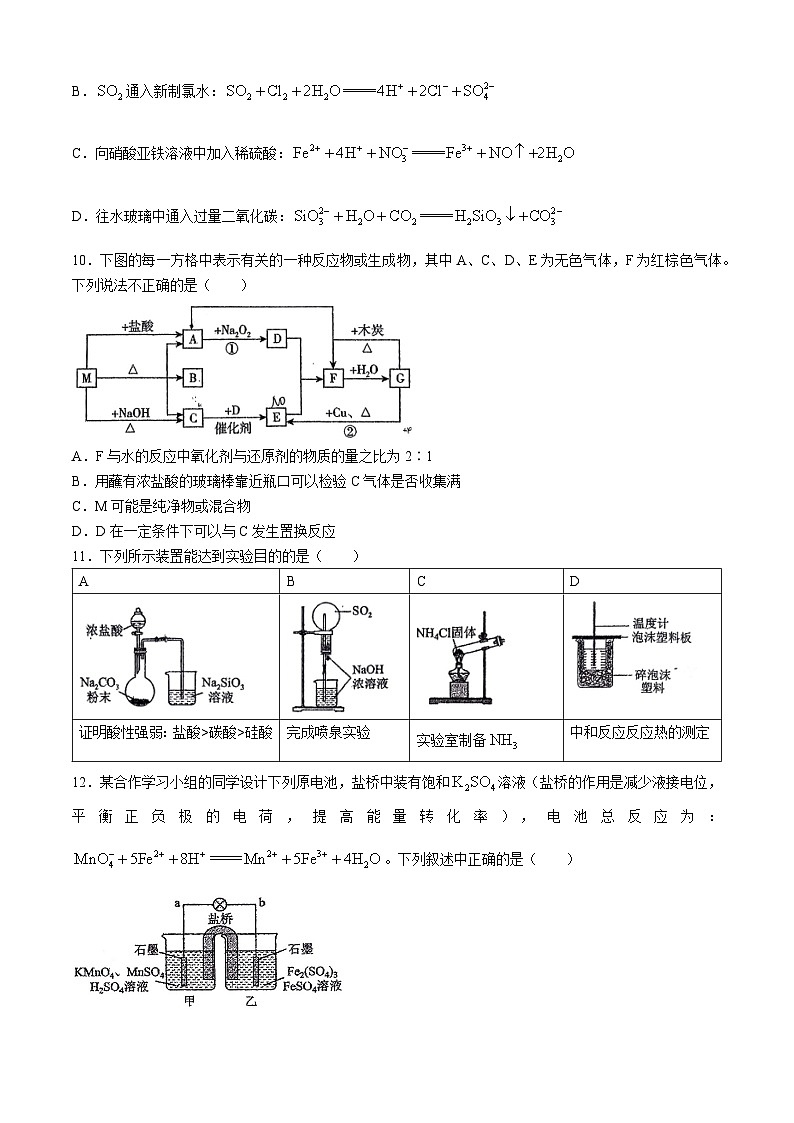
11.下列所示装置能达到实验目的的是( )
12.某合作学习小组的同学设计下列原电池,盐桥中装有饱和溶液(盐桥的作用是减少液接电位,平衡正负极的电荷,提高能量转化率),电池总反应为:。下列叙述中正确的是( )
A.盐桥中K⁺向乙烧杯方向移动
B.电池工作一段时间,甲烧杯中酸性增强
C.乙烧杯中的电极反应式为:
D.电子流动方向:石墨(甲)→a→b→石墨(乙)→盐桥→石墨(甲)
13.某工厂拟综合处理含废水和工业废气(主要含、、、NO、CO,不考虑其他成分),设计了如下流程:
下列说法正确的是( )
A.X可以是空气,且需过量
B.捕获剂所捕获的气体主要是CO
C.固体1的主要成分为、
D.处理含废水时,发生的反应为
14.某同学按如图所示实验装置探究铜与浓硫酸的反应,记录各装置实验现象如下。
实验现象:①白雾、白色固体产生;②大量白色沉淀;③少量白色沉淀;④品红溶液褪色
下列说法不正确的是( )
A.①中玻璃管有平衡气压的作用
B.②③中的白色沉淀成分相同
C.为了确定①中白色固体是否为硫酸铜,可将试管内的物质缓慢注入水中,振荡观察
D.实验时若先往装置内通入足量,再加热试管①,实验现象不变
15.氢能源是现在研究的热点。以太阳能为能源,热化学循环在较低温度下制备氢气的反应是一种高效、环保的制氢方法,其流程如图所示。
相关反应的热化学方程式为:
反应Ⅰ: kJ/ml
反应Ⅱ: kJ/ml
反应Ⅲ: kJ/ml
下列说法不正确的是( )
A.和是总反应的催化剂
B.该过程实现了太阳能到化学能的转化
C.若反应 kJ/ml,则
D.总反应的热化学方程式为: kJ/ml
16.向200 mL稀硫酸和稀硝酸的混合溶液中缓慢加入铁粉,产生气体的体积随铁粉质量的变化如图所示(已知硝酸只被还原为NO气体)。下列说法正确的是( )
A.OA段反应的离子方程式为:
B.A点溶液中的溶质为
C.原混合溶液中的物质的量为0.2 ml
D.原混合溶液中的物质的量浓度为1 ml/L X
第Ⅱ卷(非选择题共60分)
二、非选择题(本部分7个小题,共60分)
17.(10分)按照要求,回答下列问题:
(1)硅酸盐材料是传统无机非金属材料,下列产品属于硅酸盐的是______(填序号)。
①玻璃②陶瓷③水晶④硅芯片⑤水泥⑥光导纤维⑦钻石
(2)下列变化中属于吸热反应的是______。
①铝片与稀盐酸的反应②将胆矾加热变为白色粉末③甲烷在氧气中的燃烧反应④与反应⑤煅烧石灰石⑥固体溶于水
(3)已知部分共价键的键能如下:kJ/ml,kJ/ml,kJ/ml。根据以上数据写出工业合成氨的热化学反应方程式:____________。
(4)在25℃、101kPa下,液态甲醇())的燃烧热为726.5 kJ/ml,已知: kJ/ml,写出甲醇燃烧生成水蒸气的热化学方程式____________。
(5)某反应的与活化能()的关系为。在右图中补充该反应过程的能量变化示意图______。
18.(12分)非金属单质A经下列转化过程可转化为含氧酸D,已知D为强酸。请回答下列问题。
(1)若A在常温下为固体,B是能使品红溶液褪色的有刺激性气味的无色气体。
①写出C的化学式______。
②D的浓溶液可使蔗糖变黑并释放出B,该过程体现了D的浓溶液的性质有______,请写出释放出B的化学方程式____________。
(2)若A在常温下为气体,C是在常温下是一种红棕色气体。
①写出A的简单氢化物与D反应的离子方程式____________,
②D的浓溶液显黄色的原因是(化学方程式)____________,应如何保存____________。
19.(12分)Ⅰ.我国提出争取在2060年实现碳中和,这对于改善环境、实现绿色发展至关重要。“碳中和”是指的排放总量和减少总量相当。工业上有一种方法是利用生产甲醇();,该反应过程中的能量变化如图所示:
反应过程
(1)该反应是______(填“放热”或“吸热”)反应,若有1 ml 参加反应,则变化的能量是______kJ。
(2)一定条件下,将2 ml 和6 ml 在2 L恒容密闭容器中发生上述反应,经过2min反应达到了平衡,此时浓度为0.8 ml/L。
①2 min内用表示该反应的速率为:______。
②平衡时体系内气体压强与开始时的压强之比为______。
③一定能说明该反应达到平衡的标志是______。
A.和的物质的量浓度相等
B.和物质的量浓度的比值不变
C.混合气体的平均摩尔质量不再改变
D.混合气体的密度保持不变
E.
F.单位时间内3 ml键断裂,同时水中有2 ml 键断裂
Ⅱ.有人设想寻求合适的催化剂和电极材料,以、为电极反应物,以为电解质溶液制造出一种既能提供电能,又能实现氮固定的新型燃料电池,如上图所示。
(3)a电极上的电极反应式是____________。
(4)假设放电过程中电解质溶液的体积不变,当溶液中的物质的量改变0.8 ml时,理论上电池能为外电路提供______ml电子。
20.(6分)某化学兴趣小组利用如图装置进行中和反应反应热的测定实验。
Ⅰ.实验步骤:
①量取50 mL 0.25 ml/L 溶液,倒入小烧杯中,测量温度;
②量取50 mL 0.55 ml/L NaOH溶液,测量温度;
③将NaOH溶液倒入小烧杯中,测量混合液的最高温度。
Ⅱ.实验数据如下:
请回答下列问题:
①仪器甲的名称为______,进行该实验还缺少的仪器为______(填仪器名称)。
②设实验所用的酸、碱溶液的密度均为1 g/cm,且酸、碱中和后的溶液的比热容J⋅g⋅C。计算该实验中生成1 ml水时的反应热______(保留一位小数)
③若改用60 mL 0.5 0ml⋅L盐酸与60 mL 0.55 ml⋅LNaOH溶液进行反应,与(1)中实验相比,所放出的热量______(填写“相等”或“不相等”);若用50 mL 0.50ml⋅L 溶液代替盐酸进行(1)中实验,测得反应生成1 ml水时的反应热______(填写“偏大”、“偏小”或“不变”)。
21.(14分)硫代硫酸钠()俗称大苏打或海波,在碱性条件下稳定,遇酸易分解。将通入按一定比例配成的和的混合溶液中,便可得到,同时生成。
Ⅰ.制备
(1)仪器A的名称为______,装置D的作用是____________,
B中的试剂最好选用______(填序号)。
A.稀B.NaOH溶液
C.饱和溶液D.饱和溶液
(2)写出C中反应的离子方程式为____________。
(3)写出一种可以提高装置C中吸收效率的方法____________。
(4)为保证硫代硫酸钠的产量,实验中产生的不能过量,原因是____________;
Ⅱ.的应用
已知:
某同学探究与稀反应的速率影响因素时,设计了如下系列实验:
(5)实验①、②可探究______对反应速率的影响,因此______;
(6)实验①、③可探究______对反应速率的影响,因此______,______。
22.(6分)①现有6.6 g铜镁合金与一定量浓硝酸恰好完全反应,得到、NO的混合气体(不考虑等其它气体)体积为4.48 L(本题气体体积均为标准状况下):②这些气体与一定体积氧气混合后通入水中,所有气体完全被水吸收生成硝酸。若向①所得溶液中加入:5 ml/L NaOH溶液至金属离子恰好完全沉淀,消耗NaOH溶液的体积是60 mL。试回答下列问题(要求写出计算过程):
(1)①中参加反应的硝酸是______ml;
(2)②中消耗氧气的体积是______L;
(3)铜镁合金中镁的质量为______g。t/min
物质的
量(ml)
序号
(反应温度)
0
10
20
30
40
50
60
1(800℃)
1.0
0.80
0.67
0.57
0.50
0.50
0.50
2(800℃)
1.2
0.92
0.75
0.63
0.60
0.60
0.60
3(820℃)
1.0
0.40
0.25
0.20
0.20
0.20
0.20
A
B
C
D
证明酸性强弱:盐酸>碳酸>硅酸
完成喷泉实验
实验室制备
中和反应反应热的测定
实验序号
起始温度/℃
终止温度/℃
溶液
NaOH溶液
平均值
1
25.0
25.2
28.5
2
24.9
25.1
28.2
3
25.5
26.5
31.8
实验序号
反应温度/℃
溶液
稀
V/mL
c/(ml/L)
c/(ml/L)
V/mL
V/mL
①
20
10.0
0.10
10.0
0.50
0
②
40
10.0
0.10
0.50
0
③
20
0.10
4.0
0.50
相关试卷
四川省攀枝花市第三高级中学校2023-2024学年高一下学期期中考试化学试题:
这是一份四川省攀枝花市第三高级中学校2023-2024学年高一下学期期中考试化学试题,共7页。
河北省邢台市翰林高级中学等校2023-2024学年高一下学期4月期中考试化学试题:
这是一份河北省邢台市翰林高级中学等校2023-2024学年高一下学期4月期中考试化学试题,文件包含河北省邢台市翰林高级中学等校2023-2024学年高一年级下学期4月期中考试化学试题pdf、化学408A答案1pdf等2份试卷配套教学资源,其中试卷共5页, 欢迎下载使用。
四川省成都成华区某校2023-2024学年高一下学期期中考试化学试题:
这是一份四川省成都成华区某校2023-2024学年高一下学期期中考试化学试题,文件包含高2023级高一化学试题pdf、高2023级高一化学答案pdf等2份试卷配套教学资源,其中试卷共8页, 欢迎下载使用。








