






高教版(2021)化学通用类第一节 常见非金属单质及其化合物教学演示ppt课件
展开主题四 常见无机物及其应用 4.1.1 常见非金属单质
1.通过辨识氯、硫、氮元素原子的核外电子排布,从微观角度出发预测非金属单质及其化合物的化学性质;通过判断物质类别,从宏观角度出发,构建研究物质性质的一般思路,发展宏观辨识与微观探析等化学学科核心素养。2.通过观察实验现象,认识非金属单质及其化合物的主要性质,并藉此设计合理的实验方案,完成Cl-、SO42-和NH4+的检验,总结鉴别反应的特点,发展现象观察与规律认知、实验探究与创新意识等化学学科核心素养。3.通过实践活动,了解酸雨形成的原因,讨论酸雨的危害及防治措施,认识氯、硫、氮等非金属单质及其化合物在生产、生活中的应用和对生态环境的影响,发展变化观念与平衡思想、科学态度与社会责任等化学学科核心素养。
1929 年,享有“味精大王”美誉的爱国实业家吴蕴初(1891—1953)“开中国电化工业之新纪元”,在上海独创了我国第一家氯碱厂——天原电化厂。今天,中国的氯碱工业早已插上腾飞的翅膀,成为国民经济的重要组成部分。氯碱工业为什么被称为中国现代化工之母呢?
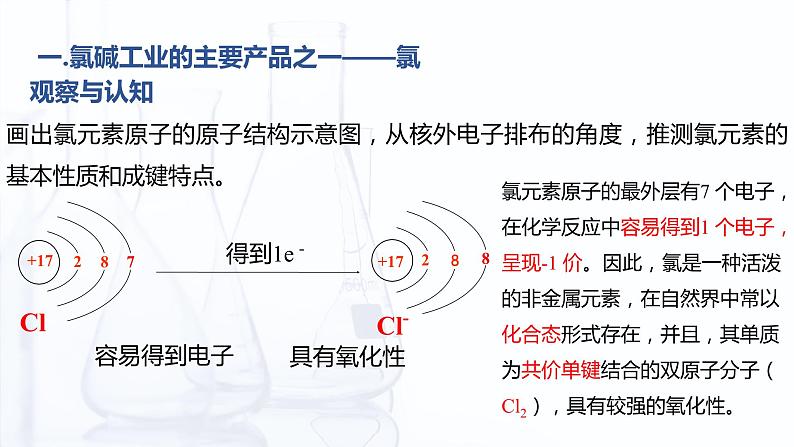
一.氯碱工业的主要产品之一——氯
画出氯元素原子的原子结构示意图,从核外电子排布的角度,推测氯元素的基本性质和成键特点。
氯元素原子的最外层有7 个电子,在化学反应中容易得到1 个电子,呈现-1 价。因此,氯是一种活泼的非金属元素,在自然界中常以化合态形式存在,并且,其单质为共价单键结合的双原子分子(Cl2),具有较强的氧化性。
1774 年,瑞典化学家舍勒(1742—1786)在将软锰矿(主要成分是MnO2)与浓盐酸混合加热的过程中,发现了一种具有强烈刺激性气味的黄绿色气体——氯气。后来,英国化学家戴维(1778—1829)将组成这种气体单质的元素命名为“Chlrine”。
②有强烈刺激性气味、有毒
④易液化,常压下,冷却至–34.6 ℃,变为黄绿色油状液体, 工业上称为“液氯”
⑤能溶于水,常温下1体积水能溶解2体积氯气
实验室制备氯气时,必须在通风橱中进行,并注意尾气处理。
结合氯气的物理性质,思考以下问题:①如何正确嗅闻氯气?②如果不慎发生氯气泄露事故,现场应该如何自救?
①应采用左图所示的方法嗅闻氯气②应立即离开现场,向上风地区转移,并用湿毛巾护住口鼻。
实验探究1:氯气与金属的反应
观看金属钠、铁、铜在氯气中燃烧的视频,记录反应现象,写出对应的化学方程式。
钠、铁、铜均能在氯气中剧烈燃烧,分别产生大量白烟、棕黄色烟、棕褐色烟。
2Fe+3Cl2 2FeCl3
氯气的化学性质很活泼,能与所有的金属直接化合,且一般把变价金属(如Fe、Cu)氧化到最高价。
实验探究2:氯气与非金属的反应
在常温下,氯气与氢气化合缓慢。如果点燃或用强光直接照射氯气和氢气的混合气体,就会剧烈反应而发生爆炸,生成氯化氢气体。纯净的氢气可在氯气中安静燃烧,火焰呈苍白色。
思考:为什么H2在Cl2中能安静燃烧,而两者的混合物光照时会爆炸?
氯气能溶于水,常温下,1 体积的水能够溶解大约2.5 体积的氯气。氯气的水溶液称为“氯水”,新制的氯水呈黄绿色,但放置一段时间后颜色会变浅。分析讨论:氯气在溶于水的同时是否还发生了化学反应?氯水的成分是怎样的?
实验探究3:氯气与水的反应
氯气溶于水得到的氯水呈黄绿色,有氯气的气味。
Cl2+H2O HCl+HClO
操作2:在两个干燥的集气瓶中分别放入一小片干燥的红色纸条a和湿润的红色纸条b,通入氯气,观察纸条颜色的变化。
氯气溶于水并与水反应生成次氯酸(HClO),HClO具有强氧化性和漂白性,能杀死水里的细菌,也能使有机物褪色。
操作3:分别用干燥、洁净的玻璃棒蘸取少量新制氯水和稀盐酸,滴在pH 试纸上,观察并比较对应的pH 以及试纸颜色有无变化。
氯水中存在次氯酸(HClO)和 HCl,因而既显酸性又有漂白性。
操作4:在一洁净的试管中加入2 mL 新制氯水,再向试管中加入几滴10% AgNO3 溶液和几滴稀硝酸,观察现象,写出对应的离子方程式。
加入AgNO3 溶液时有白色沉淀生成,该沉淀不溶于稀硝酸。这是氯水中含有的HCl与AgNO3溶液间的反应。
操作5:将两瓶新制氯水分别置于阳光下和冷暗处,相同时间后观察并比较溶液颜色的变化。
置于阳光下的氯水颜色明显变浅,思考:若放置太久,氯水的成分会发生怎样的变化?
HClO 不稳定,容易分解放出氧气,在光照下其分解速率加快。因此,氯水最好现用现配,并贮存于棕色瓶中、置于冷暗处。
新制氯水与久置氯水的比较
实验探究4:氯气与碱的反应
将氯气通入氢氧化钠溶液中——可制取漂白液制取反应的化学方程式:__________________________________________。离子方程式:________________________________。漂白液的有效成分是_________。
用向上排空气法收集氯气
多余的氯气用氢氧化钠溶液吸收
小明在淸洗抽水马桶时,为强化清洗效果,便将洁厕灵和84消毒液同时倒入抽水马桶,结果两种液体迅速反应,并产生黄绿色、令人窒息的刺激性气体。阅读洁厕灵安全使用说明后发现:“请勿与漂白剂或其他化学产品一起使用,以免产生有害气体”,方知两者不能混用。请你利用所学知识解释“84消毒液”不能和洁厕灵混用的原因。
“84消毒液”主要成分是次氯酸钠(NaClO),是强酸弱碱盐,在水中可以水解生成次氯酸(HClO)。次氯酸具有强氧化性,所以可以漂白、消毒。洁厕灵的主要成分是盐酸(HCl),两者相遇后会发生化学反应:2HCl+NaClO === NaCl+Cl2↑+H2O
鉴于传统的利用Cl2 和漂粉精等产生的HClO 来进行饮用水消毒的方法存在能产生致癌物质等隐患,人们一直在积极研发更加科学、有效、健康的新型自来水消毒制剂。目前备受推崇的是被世界卫生组织(WHO)列为A1 级高效安全灭菌消毒剂的二氧化氯(ClO2)。这种同样为黄绿色气体的新型自来水消毒剂,具有在水中的杀菌、消毒能力强,持效长, 受水体自身的pH 变化影响小的特点。我国自2000 年起逐步用二氧化氯取代氯气对饮用水进行消毒。
二.黑火药的组成成分——硫
画出硫元素原子的原子结构示意图,根据硫元素原子得失电子的情况,推测其基本性质及成键特点。解释单质硫为什么会以S2、S4 、S6 、S8等形式存在?
硫原子有多种共用电子的方式,能形成多种共价键,S2、S4、S6、S8互为“同素异形体”。
在自然界中,硫元素常以游离态存在于火山口或地壳岩层内,或以硫化物和硫酸盐等形式存在于煤、石油和矿泉水中。
颜 色:状 态:硬 度:溶解性:凝 华:
不溶于水,微溶于酒精,易溶于二硫化碳
硫蒸气急剧冷却,会直接凝聚成粉末形成硫华
即学即用:如何清洗沾有硫磺的试管呢 ?
结合硫元素的原子结构示意图以及其在元素周期表中的位置,预测硫单质的化学性质。
硫的最高正化合价 +6;最低负化合价 -2
单质S既具有氧化性,也具有还原性
硫蒸气能和氢气直接化合成硫化氢。
硫在空气或纯氧中燃烧时,生成二氧化硫,火焰为蓝色
(剧烈反应并发生爆炸)
硫的氧化性不如氯,因此,S与变价金属(如Fe)作用时不能将金属氧化至高价态,硫的化学性质比较活泼,能和除金、铂以外的各种金属直接化合,生成金属硫合物并放出热量
硫元素的化合价与氧化性、还原性之间的关系
新能源汽车的核心动力一直是制约其发展的短板。高比能新型锂硫电池的研发是突破发展瓶颈的一个方向。这种电池摒弃了三元锂电池正极材料所使用的镍盐、钴盐和锰盐,单纯的以硫为电池正极,金属锂作为电池负极。具有高比容量、高比能量密度、自然资源丰富、低成本、环境友好、较宽的温度使用范围、过充保护等诸多优势。尤其是将石墨烯气凝胶应用于其中后使得性能进一步优化。锂硫电池的研发在全球科研界和产业界备受关注,我国于2011 年开始锂硫电池的研发,目前正处于积极的推进阶段。
三.空气中含量最多的元素——氮
画出氮元素原子的原子结构示意图,根据氮元素的得失电子情况,写出氮气的电子式,推测其基本性质,并从化学键的角度解释为何氮气分子在通常情况下非常稳定。
色 态:气 味:密 度:溶解性:
比空气稍轻,在100kPa、–195.8 ℃时变为无色液体, –209.86 ℃时变成雪状固体
通常状况下,1体积水大约只溶解0.02体积的氮气
思考:能用排空气法收集氮气吗?
氮气约占空气体积的78%(体积分数),是空气中含量最多的元素。结合你对空气的认识,想一想氮气的物理性质是怎样的?
医学上,常用液氮作冷冻剂
在高温或一定条件下氮气的反应能力增强,能与氢气、氧气、金属等发生化学反应
工业上,氮气是合成氨、制硝酸的重要原料
氮分子中的两个氮原子以共价叁键相结合,使得氮分子在通常状况下很稳定,既不可燃、不助燃,也很难参加化学反应。由于氮的化学惰性,常用作保护气体。例如,用氮气填充粮仓,可使粮食不霉烂、不发芽。
俗语说“雷雨发庄稼”。小组合作,分析这句话所涉及的化学知识。并以此为导引讨论“氮固定”的方法,学习科学家卢嘉锡先生的事迹。
在雷雨天,闪电使大气中产生NO并进一步氧化,再转化为硝酸或硝酸盐等。据估算,每年因雷雨而渗入大地的氮肥约有4亿吨。
1.下列有关硫的叙述中,错误的是A.黑火药的成分中含硫B.硫磺软膏可医治某些皮肤病C.单质硫易溶于二硫化碳D.单质硫只有氧化性【答案】D
2.液氮能长时间保存活体组织和生物样品,主要利用氮气的性质是A.密度小B.沸点低C.难溶于水D.无色无味【答案】B
3.下列关于氯气的说法中,不正确的是A.氯气是黄绿色气体,易液化B.氯气有毒,吸入过多会使人中毒死亡C.相同状况下氯气的密度比空气的密度大D.氯气易溶于水,并能与水反应,氯水无色【答案】D
4.下列关于新制氯水的叙述,正确的是A.新制氯水显酸性,使蓝色石蕊试纸最终变红色B.新制氯水呈浅黄绿色,是因为含有未参加反应的Cl2分子C.光照新制氯水有气泡逸出,该气体是Cl2D.新制氯水放置数天后,漂白能力将变强【答案】B
5.下列说法不正确的是A.硫在元素周期表第ⅥA族,非金属性比氧弱B.化石燃料直接燃烧会产生对大气有严重污染的SO2气体C.硫在空气中燃烧的产物是SO2,在氧气中燃烧的产物是SO3D.硫通常情况下为固态,不溶于水【答案】C
中职化学高教版(2021)化学通用类第二节 烃优质ppt课件: 这是一份中职化学高教版(2021)化学通用类<a href="/hx/tb_c4034934_t3/?tag_id=26" target="_blank">第二节 烃优质ppt课件</a>,共59页。PPT课件主要包含了情境与问题,拓展延伸,甲烷的性质,甲烷的用途,二烷烃,观察与认知,烷烃的命名,烷烃的命名例题,乙烯的性质,乙烯的用途等内容,欢迎下载使用。
中职化学高教版(2021)加工制造类第一节 常见非金属单质及其化合物优秀课件ppt: 这是一份中职化学高教版(2021)加工制造类<a href="/hx/tb_c4035014_t3/?tag_id=26" target="_blank">第一节 常见非金属单质及其化合物优秀课件ppt</a>,文件包含主题四第一节常见非金属单质及其化合物课件中职专用高中化学高教版2021加工制造类pptx、主题四第一节常见非金属单质及其化合物习题中职专用高中化学高教版2021加工制造类原卷版docx、主题四第一节常见非金属单质及其化合物习题中职专用高中化学高教版2021加工制造类解析版docx等3份课件配套教学资源,其中PPT共60页, 欢迎下载使用。
中职化学高教版(2021)医药卫生类第二节 常见金属单质及其化合物一等奖课件ppt: 这是一份中职化学高教版(2021)医药卫生类<a href="/hx/tb_c4035058_t3/?tag_id=26" target="_blank">第二节 常见金属单质及其化合物一等奖课件ppt</a>,文件包含42常见金属单质及其化合物课件中职专用高中化学高教版2021医药卫生类pptx、42常见金属单质及其化合物练习中职专用高中化学高教版2021医药卫生类原卷版docx、42常见金属单质及其化合物练习中职专用高中化学高教版2021医药卫生类解析版docx等3份课件配套教学资源,其中PPT共60页, 欢迎下载使用。












