

湖南省衡阳市2024年高考第二次联考(二模) 化学试题
展开第Ⅰ卷的注释
一、选择题:本题共14小题,每小题3分,共42分。在每小题给出的四个选项中,只有一项是符合题目要求的。(共14题)
---------------------------------------------------------------------
1. 中国传统文化历史悠久,传统文化中承载着大量的化学知识。下列说法错误的是( )
A . 商代豕形铜尊的主要成分为合金 B . 黑火药点火爆炸发生了氧化还原反应 C . 唐摹绢本《兰亭序》卷之绢的主要成分为蛋白质 D . 花鼓戏之兽皮鼓面的主要成分是橡胶
---------------------------------------------------------------------
2. 实验室可用蘸有浓氨水的玻璃棒靠近盛有浓硝酸的试剂瓶口,检验试剂瓶中是否有逸出:。下列说法或化学用语表示错误的是( )
A . 基态O原子的价电子排布式: B . 放射性元素氚(T): C . 的电子式为 D . 中含有离子键、极性键
---------------------------------------------------------------------
3. 实验室用固体和浓盐酸制备纯净的时用不到的实验仪器有( )
A . ①②④⑤ B . ③⑥ C . ②③⑤ D . ③④⑤
---------------------------------------------------------------------
4. 下列说法错误的是( )
A . 一级结构的蛋白质分子主要通过氢键形成盘绕、折叠二级结构 B . 聚乳酸作为可降解塑料是因为其结构中含酯基 C . 对粉末进行X射线衍射,衍射图谱中出现明锐的衍射峰,则为非晶体 D . 五光十色的霓虹灯发光变色过程属于物理变化
---------------------------------------------------------------------
5. 下列离子方程式或电极反应式书写错误的是( )
A . 向溶液中滴加少量氨水,出现蓝色沉淀: B . 酸性条件下,电解丙烯腈()生产己二腈[]的阴极反应: C . 铅酸蓄电池放电时的正极反应: D . 用纯碱溶液除去锅炉水垢中的:
---------------------------------------------------------------------
6. 扬州大学俞磊教授团队利用萤石直接制备电池电解质材料甲()的新方法如下:、 , 其中X、Y、Z、M、Q为原子序数依次增大的前20号主族元素,X、Q为金属元素,Y、M为同主族元素,且Y是电负性最大的元素,基态Z原子的成对电子数与未成对电子数之比为4∶1。下列说法错误的是( )
A . 基态X原子核外只有1个未成对电子 B . 第一电离能:Q<Z<M<Y C . 简单离子半径:Q>M>Y D . 、均为三角锥形分子
---------------------------------------------------------------------
7. 下列实验设计能达到对应实验目的的是( )
A . A B . B C . C D . D
---------------------------------------------------------------------
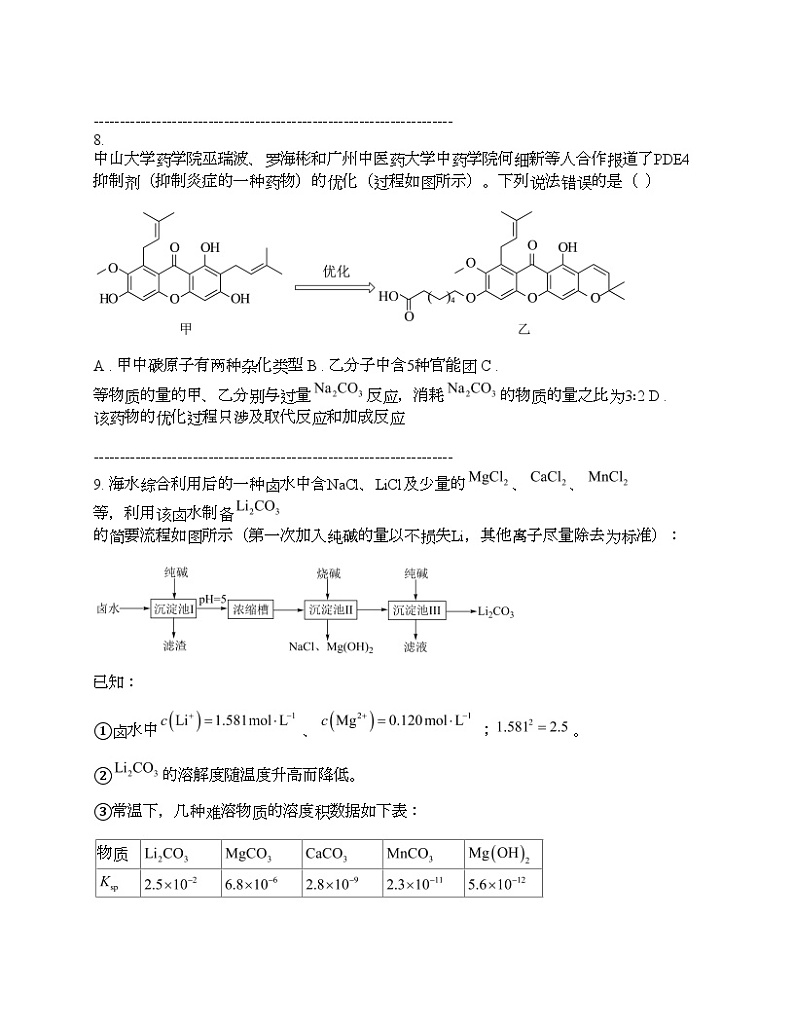
8. 中山大学药学院巫瑞波、罗海彬和广州中医药大学中药学院何细新等人合作报道了PDE4抑制剂(抑制炎症的一种药物)的优化(过程如图所示)。下列说法错误的是( )
A . 甲中碳原子有两种杂化类型 B . 乙分子中含5种官能团 C . 等物质的量的甲、乙分别与过量反应,消耗的物质的量之比为3∶2 D . 该药物的优化过程只涉及取代反应和加成反应
---------------------------------------------------------------------
9. 海水综合利用后的一种卤水中含NaCl、LiCl及少量的、、等,利用该卤水制备的简要流程如图所示(第一次加入纯碱的量以不损失Li,其他离子尽量除去为标准):
已知:
①卤水中、;。
②的溶解度随温度升高而降低。
③常温下,几种难溶物质的溶度积数据如下表:
下列说法错误的是( )
A . 滤渣中含有、和 B . 在实验室中分离出滤渣需要的玻璃仪器主要为漏斗、玻璃棒和烧杯 C . “沉淀池Ⅱ”中滴加烧碱前, D . 从“沉淀池Ⅲ”中析出的需用热水洗涤
---------------------------------------------------------------------
10. 一种钇钡铜氧化物为黑色固体,能作高温超导体,应用广泛,其晶体结构单元如图所示。设表示阿伏加德罗常数的值,下列说法错误的是( )
A . 基态的价电子轨道表示式为 B . 该晶体的化学式为 C . 与等距离且距离最近的为8个 D . 该晶体的密度为
---------------------------------------------------------------------
11. 含氮废水中氮元素有铵态氮和硝态氮两种形式,利用铁碳微电池法在弱酸性条件下进行电化学处理,可同时除去铵态氮和硝态氮,该电化学装置的工作原理如图所示。下列说法正确的是( )
A . 该装置工作时,碳电极附近pH增大 B . 该装置工作时,移向碳电极附近 C . Fe电极为负极,电极反应为 D . 理论上消耗的与的物质的量之比为5∶3
---------------------------------------------------------------------
12. 中国从人工合成淀粉被国际学术界认为是影响世界的重大颠覆性技术,合成步骤由60多步缩减到11步,突破了自然界淀粉合成的复杂调控障碍。其中加氢的主要反应如下。
反应ⅰ:
反应ⅱ:
向密闭容器中通入的混合气体,在不同压强(、)、不同温度下,平衡体系中的转化率、和CO的选择性随温度的变化如图所示。
下列说法错误的是( )
A . 压强: B . 曲线①、⑤分别表示平衡体系中的选择性和的转化率 C . 235℃时,m点体系中 D . 随着温度升高,与的平衡转化率之比先减小后增大
---------------------------------------------------------------------
13. 中国科学院武汉物理与数学研究所在甲烷和一氧化碳催化转化制备有机物X的反应机理(如图)研究方面取得重要进展。下列说法错误的是( )
A . 有机物X可用作厨房中的调味剂 B . 中间体和中C的化合价不同 C . 反应②过程中存在键的断裂 D . 过程⑤的反应为
---------------------------------------------------------------------
14. 乙二胺(H2NCH2CH2NH2 , 用EDA表示)是一种重要的化工原料,应用于印染工业、电镀、农药制备、医药生产等。常温下,向锥形瓶中加入20.0mL 0.1ml/L乙二胺的盐酸盐(EDAH2Cl2)溶液,并向其中加入NaOH固体,锥形瓶混合液体系中lgc[指lgc(EDA)、、]、与溶液的pOH[]的关系如图所示。下列说法错误的是( )
A . 甲为的变化曲线 B . 乙二胺的一级电离常数 C . a点溶液的pH=7.2 D . d点溶液中:
二、非选择题:本题共4小题,共58分。(共4题)
---------------------------------------------------------------------
15. 无水氯化铬()是有机合成和无机合成的重要原料,实验室中可采用含水氧化铬制备无水氯化铬。制备步骤如下:
ⅰ.组装好装置,检验装置气密性,向瓷舟中加入。
ⅱ.向体系中通入干燥纯净的一段时间。
ⅲ.使通过 , 进入到硬质玻璃管中,同时打开管式炉,对反应物加热。
ⅳ.制备实验结束后,继续通入纯净的 , 直至产物冷却为室温,硬质玻璃管右端有紫色薄片出现。
ⅴ.检测产品纯度。
实验装置如图所示:
已知相关部分物质的性质如下表:
回答下列问题:
(1) 步骤ⅰ中,检验装置B气密性的方法是。
(2) 步骤ⅱ中,通入纯净的时,请描述、、的关闭或打开状态:。
(3) 管式炉中,先失水转化为 , 然后与反应,除目标产物外,还产生光气,生成目标产物的化学方程式是。该实验中为了得到足够浓度的气态 , 可采取的方法为。
(4) 反应过程中,通入的作用是。
(5) 装置C中NaOH溶液的作用是(用离子方程式表示)。
(6) 该装置存在的弊端有(填两条)。
---------------------------------------------------------------------
16. 低碳烯烃是重要的化工原料,广泛用于生产塑料、溶剂、药物、化妆品等。低碳烯烃主要是指乙烯、丙烯、丁烯。回答下列问题:
(1)
Ⅰ.我国科学家研究出新型催化剂/ZMS—5,能使加氢生成乙烯,反应过程如图所示:
催化加氢的反应由反应①和反应②两步完成,反应①的活化能>反应②的活化能 , 则催化加氢反应的决速步骤是(填“反应①”或“反应②”)。反应③为解聚、烯烃异构化反应,烯烃异构化是指改变烯烃结构而相对分子质量不变的反应过程,化工生产中的下列烯烃能发生异构化反应的是(填字母)。
A.乙烯 B.2-甲基丙烯 C.2,3-二甲基-1-丁烯
(2) Ⅱ.丙烯作为化工原料,其用量仅次于乙烯,应用丙烷脱氢制丙烯成为丙烯的重要来源,涉及的主要反应如下:
ⅰ.
ⅱ.
。
(3) 按起始投料比将气体匀速通入到恒压(100kPa)密闭容器中,发生反应ⅰ和反应ⅱ。在相同时间不同温度(T)下,测得反应过程中、的转化率变化曲线如图所示:
M表示(填“”或“”)的转化率随温度变化的曲线;C点后,随着温度升高,主要进行的反应是(填“ⅰ”或“ⅱ”),该反应在温度为K时的压强平衡常数kPa(保留一位小数)。
(4)
Ⅲ.中国科学院大连化学物理研究所利用金属氧化物和分子筛的复合催化剂(OXZEO)实现了合成气(CO、)转化为低碳烯烃,反应过程如图所示:
该图显示,CO吸附到金属氧化物表面,碳氧键被“剪断”变成O原子和C原子,与C原子反应形成烃类中间体,该烃类中间体的电子式为。该中间体通过碳原子的链式增长,生成各种烯烃。该反应机理中,碳原子的链式增长的位置为(填字母)。
A.金属氧化物表面 B.金属氧化物与分子筛之间的气体氛围中
C.分子筛表面 D.分子筛的孔道中
---------------------------------------------------------------------
17. 一种硫酸镍粗品中含有、、、、等杂质离子,采用下列流程可以对硫酸镍进行提纯,并能获取蓝矾。
已知:常温下,①;
②部分金属离子(起始浓度为0.1 , 沉淀完全的浓度为)生成氢氧化物沉淀的pH范围如下表:
回答下列问题:
(1) “水浸”时常适当加热,加热的目的是。
(2) 常温下,X是一种气体,则X、、中键角从大到小的顺序是(用化学式表示),其原因是。
(3) “沉铁”时,总反应的离子方程式为;其中加入的作用是调节溶液pH=(填字母)。
A.1.5 B.4.0 C.6.3 D.6.9
(4) 若某次工艺生产中,“沉铁”后,1.0t(体积约为L)滤液中 , “沉钙”后, , 则最少加入g(保留三位有效数字)。
(5) 萃取剂P204的结构简式如图1所示,1ml P204中含ml手性碳原子;萃取时,萃取液pH对相关金属离子的影响如图2所示,则最适宜的pH为。
---------------------------------------------------------------------
18. 化合物J是一种药物中间体,合成该化合物的一种路线如图所示(部分反应条件已简化)。
已知:(“Bc—”表示)
回答下列问题:
(1) 化合物A中含7个碳原子,且只含两种官能团,则A的结构简式为。
(2) B转化为C的反应类型是。
(3) 依据上述合成路线提供的信息,下列反应产物L的结构简式是。
(4) E转化为G的化学方程式是。
(5) H含有的官能团名称是碳氯键、氨基、。
(6) 化合物C的同分异构体中,符合下列条件的有种。
①能发生银镜反应
②含硝基
③含苯环结构
其中核磁共振氢谱中有2组峰的结构简式是(填一种)。
(7) 设计以苯和为原料制备的合成路线:(其他试剂任选)。
难度系数:0.57
第Ⅰ卷 客观题
一、选择题:本题共14小题,每小题3分,共42分。在每小题给出的四个选项中,只有一项是符合题目要求的。
1 2 3 4 5 6 7 8 9 10 11 12 13 14
第Ⅱ卷 主观题
二、非选择题:本题共4小题,共58分。
15 16 17 18
选项
实验目的
实验设计
A
检验溶液中是否含
在待测液中滴加溶液,观察是否出现特征蓝色沉淀
B
检验含碘食盐中存在碘元素
在含碘食盐溶液中加入淀粉溶液,再滴加稀硝酸,观察溶液是否变蓝
C
验证溶度积:
在2mL 0.1溶液中先滴加5滴0.1溶液,再滴加5滴0.1溶液,观察是否出现沉淀
D
探究和氧化性强弱
在溶液中滴加酸化的过氧化氢溶液,观察溶液是否变为黄色
物质
无水氯化铬()
紫色晶体,950℃升华,易溶于水
绿色粉末固体,熔点2435℃,高温下能被氧化
无色液体,沸点:76~77℃
光气()
无色气体,剧毒,遇水水解:
金属离子
开始沉淀的pH
1.5
4.2
6.2
6.3
6.9
11.8
完全沉淀的pH
2.8
6.2
82
8.3
8.9
13.8
湖南省衡阳市2024届高三下学期第二次联考(二模)化学试题(含解析): 这是一份湖南省衡阳市2024届高三下学期第二次联考(二模)化学试题(含解析),共26页。试卷主要包含了单选题,解答题等内容,欢迎下载使用。
湖南省衡阳市2024届高三下学期第二次联考(二模)化学试题(含答案): 这是一份湖南省衡阳市2024届高三下学期第二次联考(二模)化学试题(含答案),共12页。试卷主要包含了下列说法错误的是等内容,欢迎下载使用。
天一大联考2024届湖南省衡阳市高三第二次联考(衡阳二模)化学试题及答案: 这是一份天一大联考2024届湖南省衡阳市高三第二次联考(衡阳二模)化学试题及答案,文件包含化学试卷docx、化学-湖南高三二模简易答案pdf等2份试卷配套教学资源,其中试卷共10页, 欢迎下载使用。












