初中化学人教版九年级上册课题3 元素练习题
展开
这是一份初中化学人教版九年级上册课题3 元素练习题,共24页。
一、元素概念
1.定义:元素是 质子数(即核电荷数)相同的一类原子 的总称
(1)元素通常描述物质的组成 。
(2)在原子基础上研究元素,决定元素种类的是质子数 。
(3)元素是宏观概念,只能论 种类 ,不能论 个数 。
(4)同种元素可以组成性质不同 物质。如金刚石和石墨都是由碳元素组成的。
2.概念理解:
①元素是以质子数为标准对 原子进行分类的。
②“一类原子”是指核电荷数相同,中子数不一定相同的一类原子。同种元素既包括质子数相同、中子数不同的原子,也包括质子数相同而电子数不同的原子和离子。
③元素的化学性质由最外层电子数决定,同种元素的离子因为所带电荷数不同,其化学性质也不同(如Fe2+、Fe3+)。
3.元素的分类:
一般我们将元素分为金属元素和非金属元素,当然分类标准不同,所分类别也不同。
元素种类的判断:
①金属元素:金属元素名称的偏旁一般是“钅”字旁,除 汞元素 外。金属元素组成的单质,除汞单质常温下是 液态 ,其他的金属单质一般在常温下是固态。
②非金属元素:非金属元素名称的偏旁一般是“石”字旁、“氵”字旁、“气”字旁,它们的单质在常温下一般分别是固态、液态、气态 。
4. 元素在自然界的分布
元素在自然界存在的形成有化合态和单质 。
元素在自然界的分布情况
地壳中含量占前五的元素分别是氧、硅、铝、铁、钙 。
海水中含量占前四的元素分别是 氧、氢、氯、钠 。
空气中中含量占前二的元素分别是氮、氧。
人体中含量占前五的元素分别是 氧、碳、氢、氮、钙 。
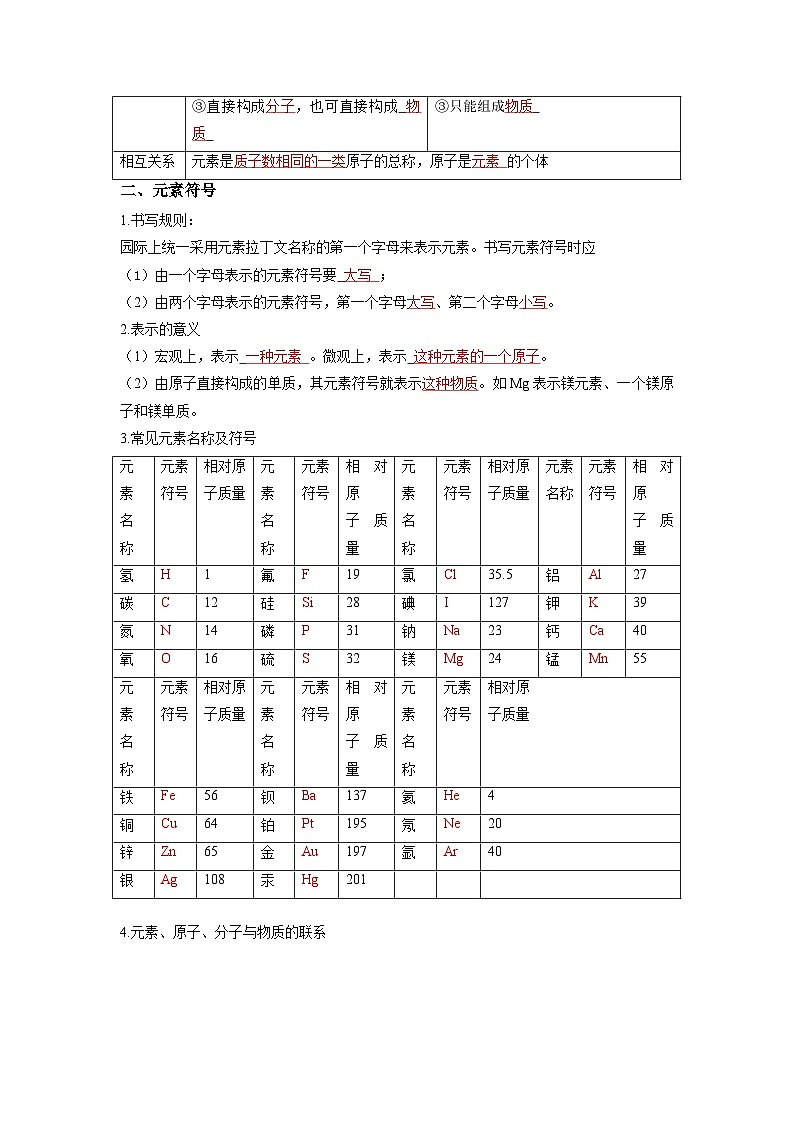
5.元素和原子比较
二、元素符号
1.书写规则:
园际上统一采用元素拉丁文名称的第一个字母来表示元素。书写元素符号时应
(1)由一个字母表示的元素符号要 大写 ;
(2)由两个字母表示的元素符号,第一个字母大写、第二个字母小写。
2.表示的意义
宏观上,表示 一种元素 。微观上,表示 这种元素的一个原子。
由原子直接构成的单质,其元素符号就表示这种物质。如Mg表示镁元素、一个镁原子和镁单质。
3.常见元素名称及符号
4.元素、原子、分子与物质的联系
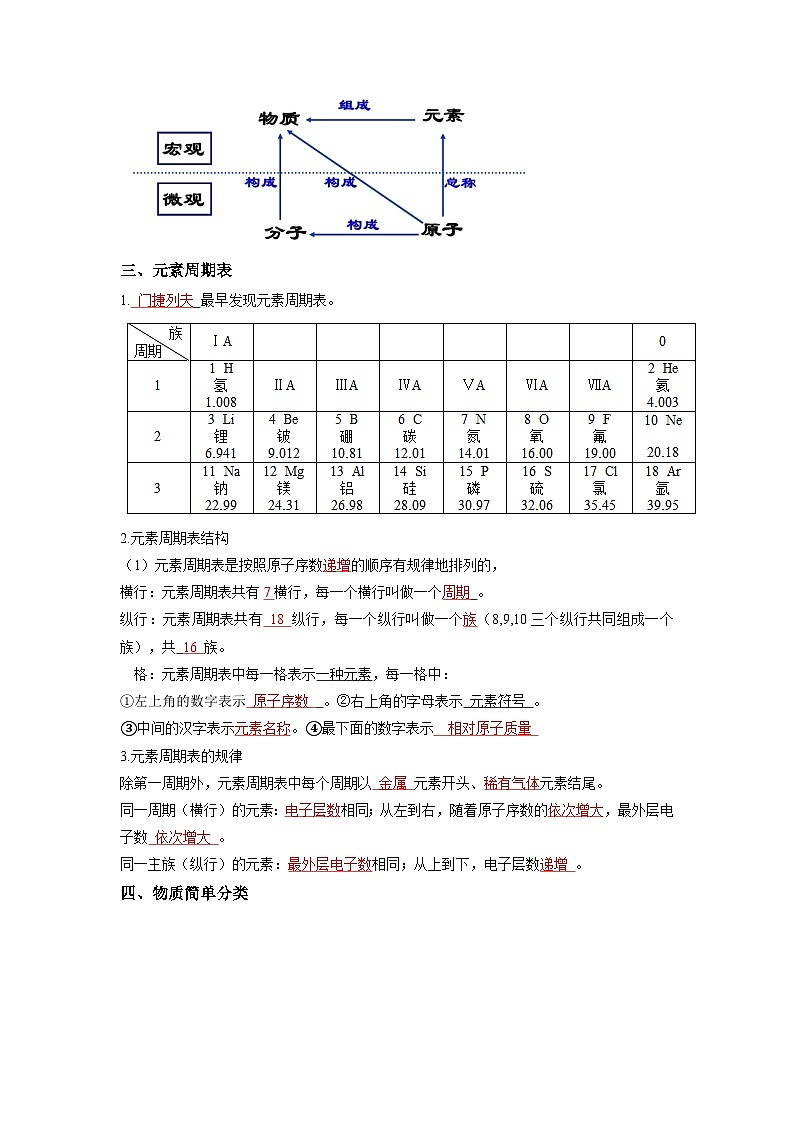
三、元素周期表
1. 门捷列夫 最早发现元素周期表。
2.元素周期表结构
(1)元素周期表是按照原子序数递增的顺序有规律地排列的,
横行:元素周期表共有7横行,每一个横行叫做一个周期 。
纵行:元素周期表共有 18 纵行,每一个纵行叫做一个族(8,9,10三个纵行共同组成一个族),共 16 族。
格:元素周期表中每一格表示一种元素,每一格中:
①左上角的数字表示 原子序数 。②右上角的字母表示 元素符号 。
③中间的汉字表示元素名称。④最下面的数字表示 相对原子质量
3.元素周期表的规律
除第一周期外,元素周期表中每个周期以 金属 元素开头、稀有气体元素结尾。
同一周期(横行)的元素:电子层数相同;从左到右,随着原子序数的依次增大,最外层电子数 依次增大 。
同一主族(纵行)的元素:最外层电子数相同;从上到下,电子层数递增 。
四、物质简单分类
1.纯净物和混合物
纯净物:只有 一种物质 组成的物质。
①纯净物有固体的组成,可用化学式表示。
②纯净物在微观组成上:只含有一种 一种分子。
③纯净物包括 单质和化合物。
混合物:由两种或两种以上物质混合而成的物质。
①混合物可以看成是几种纯净物混合而成的。
②混合物的组成不固定,不能用化学式表示。
2.单质
概念:由同种元素组成的 纯净物 。
概念解读:①单质首先是纯净物 ,且该纯净物是由同种元素组成的。
②由同种元素组成物质不一定是单质,有可能是混合物。
单质的分类
根据组成单质的元素种类将单质分类如下:
①金属单质:由金属元素组成的单质,如铁、铜等。
②非金属单质:由非金属元素组成的单质,如碳、磷、氮气等。
3.化合物
概念:由两种或两种以上元素组成的纯净物。
概念解读:化合物必须是纯净物,且该纯净物的元素组成有多种 。
化合物分类:可将化合物分为有机化合物和无机化合物。
4.氧化物
概念:由两种元素组成的化合物中,其中一种元素是氧元素的化合物,叫做氧化物。
分类
①根据组成元素可分为:金属氧化物和非金属氧化物。
②根据氧化物的性质可分为:
酸性氧化物:能跟 跟碱反应,只生成盐和水 的氧化物,如CO2、SO3等
碱性氧化物:能与 与酸反应,只生成盐和水的氧化物,如CaO等。
不成盐氧化物: 不能直接生成盐的氧化物,如CO、NO等。
5.有机化合物
概念:通常指含有 碳元素 的化合物,有机化合物简称有机物。
概念解读:有机物一定含有碳元素,但含有碳元素的化合物 不一定是有机物。像二氧化碳、一氧化碳、碳酸、碳酸盐等虽然含有碳元素,但不是有机物。
特征:有机物大多数难容于水,易溶于 有机溶剂 ;大部分有机物受热易分解,容易燃烧,燃烧产物有二氧化碳和水等。
6.无机化合物
概念:通常指不含碳元素 的化合物,但少数含有碳元素。
分类:一般可将无机化合物分为氧化物、酸、碱、盐。
【题典精讲】
【例题1】原子和离子既有联系又有差别,下列对于同元素原子和离子差别表述错误的是( )
A.原子整体上不显电性,离子显电性
B.原子中质子数等于电子数,离子中质子数不等于电子数
C.很多离子具有相对稳定的结构,而原子(稀有气体元素的原子除外)一般不是相对稳定的结构
D.离子的相对原子质量不等于原子的相对原子质量
【答案】D
【解析】A.原子整体上不显电性,离子显电性,故A正确;
B.原子中质子数等于电子数,离子中质子数不等于电子数,故B正确;
C.很多离子具有相对稳定的结构,而原子(稀有气体元素的原子除外)一般不是相对稳定的结构,故C正确;
D.原子的相对原子质量主要集中在原子核上,离子和原子的主要区别是最外层电子不同,所以离子的相对原子质量等于原子的相对原子质量,故D错误;
故选:D。
【例题2】物质都是微观粒子构成的,下列说法错误的是( )
A.在化学变化中,分子可以再分,而原子不可再分
B.带正电的离子是阳离子
C.只有分子能构成物质
D.质子数相同的一类原子属于同种元素
【答案】C
【解析】A.分子在化学变化中可分,原子不可分,故A正确;
B.带正电荷的离子是阳离子,故B正确;
C.构成物质的微粒有分子、原子和离子,故C错误;
D.我们把具有相同核电荷数(质子数)的同一类原子统称为元素,故D正确。故选:C。
【例题3】如图是金属钠和氯气反应生成氯化钠的徵观示意图,根据图示回答下列问题。
(1)钠原子在反应中 (填“失去”、“得到”)电子;
(2)构成氯化钠的粒子是 ;
(3)由原子核外电子层数与元素所在周期表中的周期数相同可知,氯元素在元素周期表中应排在第 周期。
【答案】(1)失去 (2)钠离子、氯离子(或Na+、Cl﹣);(3)三。
【解析】(1)11号元素是钠元素,钠原子的核内有11个质子,核外电子排布情况为2、8、1结构,最外层有1个电子,在化学反应中易失去电子;
(2)构成氯化钠的粒子是钠离子和氯离子;
(3)由原子核外电子层数与元素所在周期表中的周期数相同可知,氯原子的核外有三个电子层,氯元素在周期表中应排在第三周期。
【例题4】下列有关分子、原子、离子、元素的说法中,正确的是( )
A.原子都是由质子、中子、核外电子构成的
B.同种元素的原子质子数相同,中子数也一定相同
C.氯化钠由氯离子和钠离子构成
D.保持水的化学性质的最小粒子是氢原子和氧原子
【答案】C
【解析】A.不是所有的原子都含有中子,比如氢原子,故A错误;B.同种元素的原子质子数相同,中子数不一定相同,故B错误;C.氯化钠是离子化合物,由钠离子和氯离子构成,故C正确;D.保持水的化学性质的最小微粒是水分子,故D错误。故选C
【例题5】日本福岛多次发生放射性碘泄露的事故。可以服用不具有放射性的碘-127以降低放射性碘-131对人体的伤害,其原子结构示意图如图。以下说法正确的是( )
A.碘-127的核电荷数与碘-131的核电荷数不同
B.碘-127 原子与碘-131原子的相对原子质量相同
C.由碘元素组成的纯净物的化学式为I
D.碘元素的化学性质与氯元素的化学性质相似
【答案】D
【解析】A.元素是质子数相同的一类原子的总称,碘-127和碘-131属于同种元素,核电荷数相同,故A错误;B.相对原子质量约等于质子数+中子数,他们中子数不同,相对原子质量不同,故B错误;C.碘的化学式是I2,故C错误;D.元素化学性质与原子的最外层电子数密切联系,他们最外层电子书都是7.故化学性质相似,故D正确。故选D
【例题6】(2018秋•德惠市期末)如图中,A、B、C是三种粒子的结构示意图.
试回答:
(1)A、B、C中属于同种元素的粒子是 (写字母编号)
(2)A和B两种粒子的 相同,所以它们具有相似的化学性质;在化学反应中它们容易 (填“得到”或“失去”)电子;属于 (填“金属”或“非金属”)元素.
(3)C所表示的粒子是 (填“原子”或“离子”).
(4)由于原子核外电子层数与元素所在周期表中的周期数相同,可知B图所表示的元素在元素周期表中应该排在笫 周期.
【答案】(1)B C;(2)最外层电子数;得到;非金属.(3)离子;(4)三.
【解析】(1)元素是质子数(即核电荷数)相同的一类原子的总称,决定元素种类的是质子数(即核电荷数),同种元素的粒子是质子数相同,AB的质子数相同,属于同种元素.
(2)最外层电子数相同,化学性质相似,A和B两种粒子的最外层电子数相同,AB的最外层电子数均为7,大于4,在化学反应中均易得1个电子形成8个电子的稳定结构.属于非金属元;
(3)C所表示的粒子中质子数=17<核外电子数,为阴离子;
(4)由于原子核外电子层数与元素所在周期表中的周期数相同,可知B图所表示的元素在元素周期表中应该排在笫三周期.
【例题7】图中A、B、C、D四种粒子的结构示意图,E是硒元素在元素周期表中的信息,请回答下列问题:
图中A、B、C、D四种粒子中属于同种元素的是 (填字母)
D中x= 。
A、B、C、D四种粒子中具有稳定结构的原子是 (填字母)
E中硒元素的相对原子质量是 。
【答案】(1)三;(2)8;(3)D,(4)78.96。
【解析】(1)依据质子数不同元素种类不同,由图示可知四种微粒中共有质子数是13、17和18的三种元素;
(2)在原子中,原子中核内质子数等于核外电子数,所以x=18﹣2﹣8=8;
(3)原子结构最外层电子数达到8个是稳定结构,只有D表示的是原子。
(4)根据元素周期表可知,78.96是硒元素的相对原子质量
【例题8】】下列对有关物质的分类不正确的是( )
【答案】B
【解析】A.蒸馏水是纯净物,属于不同类,故A正确;B.K2CO3不属于氧化物,不同类划分错误,故B错误;C.白磷是单质,不同类划分正确;D.CO是化合物,不同类划分正确。故选B
【例题9】意人利罗马大学的科学家获得了极具理论研究意义的N4分子,N4分子结构如下图所示。下列有关N4的说法正确的是( )
N4约占空气体积的78% B.N4是一种单质
C.N4属于一种新型的化合物 D.由于N4与N2的组成元素相同,所以他们的性质相同
【答案】B
【解析】A.N4不是空气成分,故A错误;B.N4是有氮元素组成的纯净物,是单质,故B正确;C.N4属于同种元素组成的纯净物,是单质,故C错误;D.N4与N2分子构成不同化学性质不同,故D错误。故选B
【例题10】下图是表示气体分子的示意图,图中“●和○”分别表示两种含有不同质子数的原子,其中表示纯净物的是 ,表示混合物的是 ,表示单质的是 ,表示化合物的是 ,可能是氧化物的是 。
A. B. C. D.
【答案】AB CD A B
【解析】略
【例题11】元素周期表是学习和研究化学的重要工具,下表是元素周期表的一部分,A—F代表六种不同短周期元素。下列说法不正确的是( )
A.原子序数E<C
B.A、D同族
C.A、B同周期
D.C、F化学性质相似
【答案】A
【解析】A.元素周期表,每一周期按照原子序数从左到右逐渐递增,原子序数E>C,故A错误;B.A和D在同一纵行,属于同族,故B正确;C.A和B在同一行,属于同一周期,故C正确;D.C、F属于同族元素,最外层电子数相同,故化学性质相似,故D正确。故选A
【考点训练】
1.蜡烛燃烧生成二氧化碳和水,证明蜡烛中( )
A.一定含C、H、O三种元素 B.只含C、H两种元素
C.一定含C、H两种元素,可能含O元素 D.只含O元素
【答案】C
【解析】蜡烛燃烧生成二氧化碳和水,说明一定含有C、H元素,氧元素可能是蜡烛含有的元素也有可能是空气中的氧气参与反应。故选C
2.一种“环保石头纸”在两会上以便签、文件袋等形式亮相。“环保石头纸”的主要原料是碳酸钙和高分子材料。“环保石头纸”属于( )
A. 单质 B. 化合物 C. 纯净物 D. 混合物
【答案】D
【解析】“环保石头纸”的主要原料是碳酸钙和高分子材料,是两种不同的物质混合组成的,属于混合物。故选D
3.下列物质中,属于氧化物的是( )
A. NaCl B. CaO C. NaOH D. H2SO4
【答案】B
【解析】氧化物是两种元素组成,且其中一种元素是氧元素的纯净物。故选B
4.下图表示分子的示意图,图中●和○分别表示两种含有不同质子数的原子,则图中表示单质的是( )
A. B. C. D.
【答案】A
【解析】单质是由同种元素组成的纯净物,故选A
5. 南京理工大学胡炳成团队用新方法制得了NaN5•3H2O,该化合物中含有N5-等微粒。已知N为7号元素,则下列有关说法正确的是( )
A.氮原子的核外电子数为14 B.1个N5-带1个单位的正电荷
C.1个N5-中共含有35个质子 D.1个N5-中共含有35个电子
【答案】C
【解析】氮原子的质子数和电子数均为7,N5的质子数和电子数均为7×5=35;N5﹣中是N5得到一个电子得到的微粒,所以每个N5﹣中含有35个质子和36个电子,所以:
A.N为7号元素,质子数是7,核外电子数是7,故错误;
B.1个N5-带1个单位的负电荷,故错误;
C.每个N5﹣中含有35个质子,故正确;
D.每个N5﹣中含有36个电子,故错误。故选:C。
6.石门山森林公园环境优美,空气清新,有丰富的负离子,空气中氧分子得到电子就能形成负离子(如O2﹣),O2﹣与O2比较,不相同的是( )
A.质子数 B.含氧原子个数 C.电子数 D.相对原子质量之和
【答案】C
【解析】A、通过O2﹣与O2比较,可知O2﹣与O2质子数相同,故A说法不符合题意;
B、通过O2﹣与O2比较,可知O2﹣与O2含氧原子个数相同,故B说法不符合题意;
C、通过O2﹣与O2比较,可知O2﹣与O2电子数不相同,故C说法符合题意;
D、通过O2﹣与O2比较,可知O2﹣与O2相对原子质量之和相同,故D说法不符合题意;故选:C。
7.关于分子、原子、离子的说法正确的是( )
A.原子是最小的粒子,不可再分 B.分子、原子、离子都可以直接构成物质
C.分子比原子大,原子又比离子大 D.钠原子的质子数大于钠离子的质子数
【答案】B
【解析】A、原子是化学变化中的最小的微粒,错误;
B、分子、原子、离子都可以直接构成物质,正确;
C、分子比它的构成原子大,错误;
D、钠原子的质子数等于钠离子的质子数,错误;故选:B。
8.某粒子X2﹣核外有18个电子,核内有16个中子,下列有关该粒子的说法中,正确的是( )
A.属于金属元素 B.性质稳定 C.易得到两个电子 D.相对原子质量为32g
【答案】B
【解析】由题意,该粒子X2﹣核外有18个电子,核内有16个中子,其质子数=18﹣2=16,质子数<核外电子数,为阴离子。
A、由分析可知,该元素的质子数为16,故是硫元素,属于非金属元素,故选项错误。
B、该粒子的质子数为16,核外电子数为18,质子数<核外电子数,为阴离子,离子已达到稳定结构,性质稳定,故选项正确。
C、该粒子的质子数为16,核外电子数为18,质子数<核外电子数,为阴离子,不易得失电子,故选项不正确。
D、相对原子质量≈质子数+中子数=16+16=32,单位不是克,故选项错误。故选:B。
9.核外电子数相同、所显电性和所带电量也相同的微粒称为等电子等质子体.下列各组内的两种微粒属于等电子等质子体的是( )
A.Na+和 OH﹣ B.Na+和NH4+ C.F﹣和Cl﹣ D.O2﹣和Mg2+
【答案】B
【解析】A、Na+和 OH﹣一个带正电荷一个带负电荷,电性不同,不是等质子体;
B、Na+和NH4+核外电子数都为10个,都呈正电性,所带电量都为一个正电荷,所以是等质子体;
C、F﹣和Cl﹣核外电子数不同,前者为10个电子,后者为18个电子,所以不是等质子体;
D、O2﹣和Mg2+所显电性不同,前者显负电性,后者显正电性,所以不是等质子体;
故选:B。
10.原子和离子既有联系又有差别,下列对于同元素原子和离子差别表述错误的是( )
A.原子整体上不显电性,离子显电性
B.原子中质子数等于电子数,离子中质子数不等于电子数
C.很多离子具有相对稳定的结构,而原子(稀有气体元素的原子除外)一般不是相对稳定的结构
D.离子的相对原子质量不等于原子的相对原子质量
【答案】D
【解析】A.原子整体上不显电性,离子显电性,故A正确;
B.原子中质子数等于电子数,离子中质子数不等于电子数,故B正确;
C.很多离子具有相对稳定的结构,而原子(稀有气体元素的原子除外)一般不是相对稳定的结构,故C正确;
D.原子的相对原子质量主要集中在原子核上,离子和原子的主要区别是最外层电子不同,所以离子的相对原子质量等于原子的相对原子质量,故D错误;故选:D。
11.物质都是微观粒子构成的,下列说法错误的是( )
A.在化学变化中,分子可以再分,而原子不可再分 B.带正电的离子是阳离子
C.只有分子能构成物质 D.质子数相同的一类原子属于同种元素
【答案】C
【解析】A.分子在化学变化中可分,原子不可分,故A正确;
B.带正电荷的离子是阳离子,故B正确;
C.构成物质的微粒有分子、原子和离子,故C错误;
D.我们把具有相同核电荷数(质子数)的同一类原子统称为元素,故D正确。故选:C。
12.用微粒的观念学习化学有助于更好地认识物质构成,下列有关说法错误的是( )
A.同一元素的原子和离子可以相互转化 B.分子是由原子构成的,但分子不一定比原子大
C.同一种原子不可能构成不同的分子 D.分子、原子、离子都是构成物质的微粒
【答案】C
【解析】A、原子通过得失电子变成离子,离子也能变成原子,说法正确;
B、分子和原子不能比较大小,但由原子构成的分子,其分子比构成它的原子大,故分子不一定比原子大,说法正确。
C、相同的原子可能构成不同的分子,如氧原子可以构成氧分子和臭氧分子,说法错误;
D、分子、原子、离子都是构成物质的微粒,说法正确。故选:C。
13.现有四种粒子,其结构如图所示。以下说法正确的是( )
A.它们表示四种元素 B.②表示的原子在化学反应中易失2个电子
C.①④形成的化合物为MgO2 D.①③表示的是阳离子
【答案】B
【解析】A、质子数决定元素种类,图示表示的是三种元素:O、Mg、Na,故错误;
B、②表示的是镁元素,镁元素最外层电子数是2,容易失去两个电子,所以在化合物中通常显+2价,故正确;
C、①表示氧元素,④表示的元素是镁元素,①④形成的化合物为MgO,故错误;
D、阳离子的核内质子数大于核外电子数,③表示的是阳离子,①中质子数小于核外电子数,为阴离子,故错误;
故选:B。
14.关于下列五种粒子结构示意图的说法中正确的是( )
A.①④属于不同种元素B.②⑤属于金属元素
C.④⑤均具有稳定结构D.①③两种粒子可以形成化合物MgCl2
【答案】D
【解析】A、①④的质子数相同,属于同种元素,故选项说法错误。
B、②⑤的核内质子数分别是11、2,分别是钠元素、氦元素,氦元素属于稀有气体元素,故选项说法错误。
C、④最外层电子数是7,在化学反应中易得到1个电子而形成阴离子,不属于稳定结构,故选项说法错误。
D、①③分别是氯离子、镁离子,化合价分别是﹣1价、+2价,可以形成化合物MgCl2,故选项说法正确。
故选:D。
【培优训练】
1.下列四种微粒中,能形成化合物的是( )
A.①和②B.①和③C.①和④D.②和③
【答案】B
【解析】四种粒子分别是氟离子、氖原子、钠离子和钠原子,阴阳离子可以形成离子化合物,①和③分别是氟离子、钠离子,可形成化合物氟化钠。故选:B。
2.下列各组微粒结构示意图中,与表示的意义一致的是( )
A.图①都属于阳离子 B.图②中的原子化学性质相似
C.图③的两种原子均位于同一周期 D.图④属于同一种元素
【答案】D
【解析】A、前者质子数=9<核外电子数=10,为阴离子,后者质子数=12>核外电子数=10,为阳离子,故选项说法错误。
B、前者质子数=17<核外电子数=18,为阴离子,不是原子,后者质子数=核外电子数,为原子,原子的最外层电子数不同,化学性质不同,故选项说法错误。
C、图③的两种原子的电子层数不同,不位于同一周期;故选项说法错误。
D、两者的核内质子数均为11,质子数相同,属于同一种元素,故选项说法正确。故选:D。
3.下列关于四种粒子的结构示意图的说法中正确的是( )
A.②表示的元素在化合物中通常显+1价
B.①③是不同种元素
C.②③的化学性质相似
D.①④表示的是离子
【答案】A
【解析】A、②的最外层电子数是1,小于4,在反应中易失去,表示的元素在化合物中通常显+1价,故说法正确;
B、①③的质子数相同,属于同种元素,故说法不正确;
C、①③的最外层电子数不相同,化学性质不相似,故说法不正确;
D、在①中,质子数=17<电子数=18,是氯离子,④中质子数=核外电子数,为原子。故说法不正确。
故选:A。
4.科学家计划用质子数为 20的钙原子,轰击核电荷数为 98的锎元素靶,使两元素的原子核合在一起,合成核电荷数为 118的新元素。对此理解正确的是( )
A.该变化是化学变化 B.新元素的相对原子质量为118
C.新元素的原子序数为118 D.变化过程中元素种类没有发生改变
【答案】C
【解析】由题意可知,新元素的核电荷数为20+98=118,即原子内质子数为118,核外电子数为118,在元素周期表中原子序数为118。
A.因为发生了元素的变化,不属于化学变化研究范围。化学变化仅限于原子的电子的得失和原子的重新组合,故错误;
B.新元素的相对原子质量应为质子数与中子数之和,一定大于118,故错误;
C.原子序数=核电荷数,所以新元素的原子序数为118,故正确;
D.变化过程中元素种类没有发生改变,在该变化中,两种原子核合并在一起,质子数增多,元素种类是改变了,故错误。故选:C。
5.科学研究表明:海洋生物可利用氮的多寡是影响海洋生产力的重要因素,且氮的生物地球化学循环会产生大量温室效应气体。因而,氮循环的波动对全球气候变化有着重要影响。上述有关表述中的“氮”指的是( )
A.原子 B.分子 C.元素 D.物质
【答案】C
【解析】海洋生物可利用氮的多寡是影响海洋生产力的重要因素,且氮的生物地球化学循环会产生大量温室效应气体,氮循环的波动对全球气候变化有着重要影响,这里的“氮”等不是以单质、分子、原子等形式存在,这里所指的“氮”是强调存在的元素,与具体形态无关。故选:C。
6.地壳中含量最多的元素是( )
A.氧 B.铝 C.硅 D.铁
【答案】C
【解析】海洋生物可利用氮的多寡是影响海洋生产力的重要因素,且氮的生物地球化学循环会产生大量温室效应气体,氮循环的波动对全球气候变化有着重要影响,这里的“氮”等不是以单质、分子、原子等形式存在,这里所指的“氮”是强调存在的元素,与具体形态无关。
故选:C。
7.下列各组元素中,元素符号的第一个字母相同的一组( )
A.氮、氧、氦、氩 B.钙、铜、铬、氯
C.磷、硫、碳、硅 D.铂、铍、钡、溴
【答案】B
【解析】A.氮、氧、氦、氩的元素符号依次为:N、O、He、Ar,故错误;
B.钙、铜、铬、氯的元素符号依次为:Ca、Cu、Cr、Cl,故正确;
C.磷、硫、碳、硅的元素符号依次为:P、S、C、Si,故错误;
D.铂、铍、钡、溴的元素符号依次为:Pt、Be、Ba、Br,故错误。
故选:B。
8.元素“Al”的名称是( )
A.氯 B.铝 C.硅 D.氦
【答案】B
【解析】A、元素“Al”的名称是铝,不是氯,故选项错误
B、元素“Al”的名称是铝,故选项正确。
C、元素“Al”的名称是铝,不是硅,故选项错误。
D、元素“Al”的名称是铝,不是氦,故选项错误。故选:B
9.国际通用的元素符号是采用元素拉丁文名称前 1 个或 2 个字母表示的。镍元素的拉丁文 名称为 Nicclum,则镍的元素符号为( )
A.Ni B.NI C.N D.Na
【答案】A
【解析】A、国际通用的元素符号是采用元素拉丁文名称前1个或2个字母表示的,镍元素的拉丁文 名称为 Nicclum,其元素符号为Ni,故选项正确。
B、第二个字母小写,故选项说法错误。
C、N为氮元素的元素符号,故选项错误。
D、Na为钠元素的元素符号,故选项错误。故选:A。
10.下列属于非金属元素的是( )
A.Mg B.Zn C.Cl D.Ag
【答案】C
【解析】A、Mg是镁元素的元素符号,带“钅”字旁,属于金属元素,故选项错误。
B、Zn是锌元素的元素符号,带“钅”字旁,属于金属元素,故选项错误。
C、Cl是氯元素的元素符号,带“气”字旁,属于气态非金属元素,故选项正确。
D、Ag是银元素的元素符号,带“钅”字旁,属于金属元素,故选项错误。故选:C。
11.2020年是元素周期表年,下列元素中属于非金属元素的是( )
A.Na B.Mg C.S D.Zn
【答案】C
【解析】A、Na是钠元素的元素符号,带“钅”字旁,属于金属元素,故选项错误。
B、Mg是镁元素的元素符号,带“钅”字旁,属于金属元素,故选项错误。
C、S是硫元素的元素符号,带“石”字旁,属于固态非金属元素,故选项正确。
D、Zn是锌元素的元素符号,带“钅”字旁,属于金属元素,故选项错误。
故选:C。
12.黄金是贵重金属,性质稳定,应用广泛,有关金元素的说法正确的是( )
A.核电荷数为276B.原子序数为118
C.中子数为118 D.相对原子质量为197.0g
【答案】C
【解析】A.由题目中“金元素在元素周期表中的信息示意图”可知其原子序数为79,根据“原子序数=核电荷数”可知其核电荷数为79,故说法错误;
B.由题目中“金元素在元素周期表中的信息示意图”可知其原子序数为79,故说法错误;
C.由题目中“金元素在元素周期表中的信息示意图”可知其相对原子质量为197,又核内质子数=原子序数=79,所以根据“相对原子质量≈质子数+中子数(近似整数值)”,则中子数=197﹣79=118,故说法正确;
D.由题目中“金元素在元素周期表中的信息示意图”可知其相对原子质量为197.0,其单位不是“g”而是“1”,通常省略不写,故说法错误。故选:C。
13.镧的合金是一种储氢材料。下列有关元素镧(La)的说法不正确的是( )
A.该元素是非金属元素
B.该原子的核电荷数为57
C.该原子的核外电子数为57
D.该原子的相对原子质量为138.9
【答案】A
【解析】A.镧元素,带“钅”字旁,属于金属元素,故选项说法错误。
B.57号是镧元素的原子序数,原子中原子序数=核电荷数=质子数,则该元素原子的核电荷数为57,故选项说法正确。
C.57号是镧元素的原子序数,原子中原子序数=核电荷数=质子数=核外电子数,则该元素原子的核外电子数为57,故选项说法正确。
D.该元素原子的相对原子质量为138.9,由表中可读出相关信息,故此选项正确。故选:A。
14.在CO2、SO2、NO2三种分子中,含有一样多的是( )
A.氧元素 B.氧原子 C.氧分子 D.氧元素的质量分数
【答案】B
【解析】分子由原子构成,故选B
15.卟啉铁(C34H32ClFeN4O4)对人体缺铁性贫血有显著疗效。以下说法正确的是( )
A.卟啉铁中含有五种元素 B.卟啉铁是由卟啉铁分子构成的
C.人体补铁的唯一方法是服用卟啉铁 D.“缺铁性贫血”中的“铁”指单质铁
【答案】B
【解析】A.卟啉铁中含有六种元素,故A错误;B.卟啉铁是由卟啉铁分子构成的,故B正确;C.补铁的方法有多种,故C错误;D.“缺铁性贫血”中的“铁”指铁元素。故选B
16.由同种元素组成的物质( )
A.一定是单质 B.一定是金属 C.可能是混合物 D.可能是化合物
【答案】C
【解析】由同种元素组成的物质可能是单质或混合物,故选C
17.对于“具有相同质子数的粒子”,下列叙述正确的是( )
A.一定属于同种元素 B.属不同种元素 C.是同一种原子 D.上述说法都不全面
【答案】D
【解析】粒子包括,分子、原子、离子,“具有相同质子数的粒子”有可能是同种元素,也有可能是质子数相同的不同微粒,比如水分子质子数是10,氖原子质子数也是10,故选D
【拔尖训练】
1.资料显示,原子半径主要受原子核外电子层数和核电荷数影响。一般来说,电子层数越多,原子半径越大; 当电子层数相同时,核电荷数越多,半径越小。根据这一规律,下列说法不正确的是( )
A.原子半径: r(S)>r(O)
B.半径: r(Mg)>r(Mg2+)
C.半径: r(Al3+)>r(F-)
D.元素周期表中第三周期元素中原子半径最大的是钠
【答案】C
【解析】A、S原子核外有3个电子层,O原子核外有2个电子层,电子层数越多,原子半径越大,则原子半径r(S)>r(O),故选项说法正确;
B、Mg能失去最外层的两个电子形成Mg2+,则半径r(Mg)>r(Mg2+),故选项说法正确;
C、Al3+与F-,核外电子结构相同,Al核电荷数为13,F核电荷数为9,当电子层数相同时,核电荷数越多,半径越小,则半径r(Al3+)<r(F-),故选项说法正确;
D、当电子层数相同时,核电荷数越多,半径越小;元素周期表中第三周期元素的原子都有3个电子层,其中Na的核电荷最小,则原子半径最大的是钠,故选项说法正确;故选C。
2.学习化学要构建好“宏观-微观-符号”的联系,下列说法正确的是( )
A.带电的微粒一定是离子
B.质子数相同的离子一定属于同种元素
C.“Cu”可表示铜、铜元素、1个铜原子
D.分子是保持物质化学性质的唯一粒子
【答案】C
【解析】A、带电的微粒不一定是离子,例如质子、电子,错误;
B、质子数相同的离子不一定属于同种元素,例如氢氧根离子和氟离子,错误;
C、铜属于金属是由原子直接构成的,“Cu”可表示铜、铜元素、1个铜原子,正确;
D、分子是保持物质化学性质的基本粒子,还有些物质是由原子、离子构成的,错误。故选C。
3.推理是学习化学的一种方法。以下推理正确的是( )
A.原子是不带电的粒子,所以不带电的粒子一定是原子
B.金属元素有正化合价,因此非金属元素一定没有正化合价
C.物质都是由元素组成的,同种元素可以组成纯净物,所以不同种元素也可以组成纯净物
D.元素是具有相同质子数的一类原子的总称,所以具有相同质子数的粒子一定属于同种元素
【答案】C
【解析】A、原子是不带电的粒子,但是不带电的粒子不一定是原子,例如:中子不带电,故错误
B、金属元素有正化合价,但是非金属元素不一定没有正化合价,例如:氢元素一般显+1价,故错误;
C、物质都是由元素组成的,同种元素可以组成纯净物,所以不同种元素也可以组成纯净物,正确;
D、元素是具有相同质子数的一类原子的总称,但是具有相同质子数的粒子不一定属于同种元素,例如:H2O和NH3都含有10个质子,故错误;故选:C
4.下列说法不正确的是( )
①分子可以分成原子,原子不能再分
②二氧化碳比一氧化碳多一个氧原子,由于它们的分子构成不同所以化学性质不同
③质子数相同的粒子不一定属于同种元素
④由同种分子构成的物质是纯净物,所以纯净物一定是由同种分子构成的
⑤含有氧元素的物质一定是含氧化合物
⑥Fe3+:表示一个亚铁离子带3个单位的正电荷
⑦热胀冷缩是因为分子间的间隔受热时增大,遇冷时缩小
A.③⑦ B.①④⑤⑥ C.①②⑤⑥ D.①②④⑤⑥
【答案】B
【解析】①在化学变化中,分子可以分成原子,原子不能再分,故错误;
②每个二氧化碳分子比一氧化碳分子多一个氧原子,由于它们的分子构成不同所以化学性质不同,正确;
③质子数相同的粒子不一定属于同种元素,如Ne和H2O都含有10个质子,但不是同种元素,故正确;
④由同种分子构成的物质是纯净物,但纯净物不一定是由同种分子构成的,如铁是由同种原子构成的,故错误;
⑤含有氧元素的物质不一定是含氧化合物,如氧气是单质,故错误;
⑥Fe3+:表示一个铁离子带3个单位的正电荷,故错误;
⑦热胀冷缩是因为分子间的间隔受热时增大,遇冷时缩小,正确;故选:B
5.X, Y, Z, W四种元素的质子数如图所示。下列说法正确的是( )
A.Z是地壳中含量最多的元素
B.W原子的最外层电子数是第1层的2倍
C.X、Z均能与Y形成两种不同的化合物
D.Y与W原子化学性质都不稳定,都容易得电子形成稳定结构
【答案】C
【解析】A、Z质子数是6,是碳元素,地壳中含量最多的元素是氧元素,故错误;
B、W的质子数是11,是钠元素,钠原子第1层电子数是2,最外一层电子数是1,第1层电子数是最外层的2倍,故错误;
C、X质子数是1,是氢元素,Y的质子数是8,是氧元素,Z质子数是6,是碳元素,氢元素和氧元素能形成水和过氧化氢两种化合物,碳元素和氧元素能形成一氧化碳和二氧化碳两种化合物,故正确;
D、Y的质子数是8,是氧元素,氧原子的最外层有6个电子,容易得到电子,W的质子数是11,是钠元素,钠原子的最外一层电子数是1,容易失去电子,故错误。故选C。
6.某同学梳理归纳了以下知识,其中正确的个数有( )
①元素周期表共有七个周期18个族
②电解水实验中负极与正极收集到的气体体积比约为1:2
③具有相同质子数的粒子不一定是同种元素的粒子
④同种元素组成的物质一定是单质
⑤含有氧元素的化合物一定是氧化物
⑥镁原子和氦原子最外层电子数均为2,因此镁元素和氦元素具有相似的化学性质。
A.1个 B.2个 C.3个 D.4个
【答案】A
【解析】①元素周期表共有七个周期14个族,该选项说法错误,因为第八、九、十三列是一族;
②电解水实验中负极与正极收集到的气体体积比约为2:1,该选项说法不正确;
③具有相同质子数的粒子不一定是同种元素的粒子,例如1个水分子和1个甲烷分子都含有10个质子,不属于同种元素,该选项说法正确;
④同种元素组成的物质不一定是单质,例如磷元素可以组成红磷和白磷,白磷和红磷混合组成混合物,该选项说法不正确;
⑤含有氧元素的化合物不一定是氧化物,例如高锰酸钾中含有氧元素,不属于氧化物,该选项说法不正确;
⑥镁原子和氦原子最外层电子数均为2,但是镁元素和氦元素化学性质不同,这是因为氦元素属于稀有气体元素,化学性质极不活泼,该选项说法不正确。故选A。
7.2015年年底,国际纯粹与应用化学联合会(IUPAC)确认了原子序数分别为113、115、117和118的元素的存在。以下说法正确
A.118号元素一定含有118个中子 B.这些元素都是金属元素
C.117号元素含有117个质子 D.人们不可能再发现新元素了
【答案】C
【详解】原子序数在数值上等于原子内的质子数。A. 118号元素一定含有118个质子,错误;B. 原子序数为113、115的元素属于金属元素,原子序数为118的元素属于非金属元素,错误;C. 117号元素含有117个质子,正确;D. 人们还可能再发现新元素,错误。故选C。
8.下列推理中,正确的是( )
A.单质中只含有一种元素,则有一种元素组成的纯净物一定时单质。
B.离子都带有电荷,则带有电荷的粒子中一定是离子。
C.化合反应一定生成化合物,则有化合物生成的反应一定是化合反应。
D.氧化物一定含有氧元素,则含有氧元素的化合物一定时氧化物。
【答案】A
【解析】A、单质中只含有一种元素,所以由一种元素组成的纯净物一定是单质,正确;B、离子都带有电荷,但带有电荷的粒子不一定是离子,例如:电子、质子等也带电荷,却不是离子,错误;C、化合反应一定生成化合物,有化合物生成的反应不一定是化合反应,例如:蜡烛在氧气中燃烧生成水和二氧化碳,水和二氧化碳都是化合物,蜡烛在氧气中燃烧却不是化合反应,错误;D、氧化物一定含有氧元素,含有氧元素的化合物不一定时氧化物,例如:高锰酸钾含氧元素,但不是氧化物,错误。故选A
9.根据下图有关信息判断,下列说法错误的是 ( )
A.镁离子核内有12个质子
B.硫的相对原子质量为32.06
C.在化学反应中,硫原子容易失去2个电子
D.镁离子与硫离子的最外层电子数相等
【答案】C
【解析】由题中信息知,A. 镁离子核内有12个质子。故A正确。B. 硫的相对原子质量为32.06。故B正确。C. 在化学反应中,硫原子容易获得2个电子。故C错误。D. 镁离子与硫离子的最外层电子数相等。故D正确。
10.元素周期表是学习化学的重要工具。下表是元素周期表的一部分,请回答下列问题:
(1)地壳中含量最高的金属元素的原子序数是___________。原子序数18是___________元素(填金属元素或者金属元素或者稀有气体元素)。
(2)X2+与Ne的核外电子排布相同,则X2+与的符号是___________。
(3)在第三周期中,随着原子序数的递增,元素原子的核外电子排布的变化是___________。
(4)写出原子序数为17的离子结构示意图是___________。原子序数8和16的元素化学性质相似的原因是___________。
(5)化学符号2OH-表示的意义为___________。
【答案】(1) 13 稀有气体元素(2)(3)最外层电子数依次递增(4) 最外层电子数相同
(5)2个氢氧根离子
【解析】(1)地壳中元素含量较多的元素分别是氧、硅、铝、铁,故含量最高的金属元素是铝,原子序数为13;原子序数18的元素是氩元素,属于稀有气体元素;故填13,稀有气体元素;
(2)氖原子核外有10个电子,X2+离子带两个单位正电荷,且与氖原子核外电子排布相同,说明X原子在形成离子时失去两个电子后核外还有10个电子,故X原子核外总电子数为12,在原子结构中核外电子数=核内质子数=原子序数,所以X原子是镁原子,故离子符号为:Mg2+;
(3)在元素周期表中,同一周期的元素原子,随着原子序数的递增,元素原子核外电子排布的变化规律是最外层电子数依次递增,故填最外层电子数依次递增;
(4)17号元素氯元素核外最外层电子数为7,易得到1个电子,达到8电子稳定结构,故氯离子的结构示意图为:;元素的化学性质与原子结构中最外层电子有关,而8号元素和16号元素按照原子核外电子结构排布最外层电子数都为6,所以化学性质相似;
(5)离子符号前面加阿拉伯数字只具有宏观意义,所以表示2个氢氧根离子;
11.如图是氯元素在元素周期表中的信息及四种粒子的结构示意图。请回答下列问题
(1)氯元素的相对原子质量是 。
(2)A-D中具有相对稳定结构的粒子是 (填字母)
(3)为了缓解二氧化碳过多引起的温室效应加剧,我国科学研究人员成功研制出一种纳米纤维催化剂,将二氧化碳转化为液体燃料甲醇(CH3OH),其反应的微观示意图如下,请写出该反应的化学方程式 。
【答案】(1)35.45(2)D(3)CO2+3H2纳米纤维催化剂===========CH3OH+H2O
【解析】(1)根据信息可知相对原子质量为35.45.(2)相对稳定结构,是原子最外层电子数达到8个电子的结构,D具有最外层电子数是8个电子的结构。(3)根据微观示意图可知,参加反应的氢分子个数是3,二氧化碳分子个数是1故化学方程式为CO2+3H2纳米纤维催化剂===========CH3OH+H2O
12.碘是一种由碘分子构成的非金属,某同学利用碘进行了如下的实验:
a.把少量的固体碘放在湿润的馒头上,发现馒头会变蓝色;
b.再取少量的碘溶解在水中,用馒头去沾取碘液,发现馒头也会变蓝色.则:
(1)取少量的碘放入烧杯中,用酒精灯加热,碘升华变成碘蒸气,把湿润的馒头放在碘蒸气中,馒头 变蓝色(填“会”或“不会”).
(2)把碘溶解在酒精中,可以得到用来消毒用的碘酒,用馒头去沾取少量的碘酒,馒头 (填“会”或“不会”)变蓝色.
(3)请用分子的观点解释实验中的现象 。
(4)现在市场上买来的食盐都是加碘盐,用馒头沾取少量的食盐水,馒头不变蓝色,由此可知,食盐中
(存在或不存在)碘分子.
【答案】(1)会(2)会(3)碘是由碘分子构成的,分子是保持物质的化学性质的一种微粒.在上述实验中碘分子都没有发生改变,所以都能使淀粉变蓝色(4)不存在
【解析】(1)碘升华变成碘蒸汽,把湿润的馒头放在碘蒸汽中,馒头会变色,是因为碘蒸汽中含有碘分子。(20碘酒中有碘单质,馒头会变色(3)碘是由碘分子构成的,分子是保持物质的化学性质的一种微粒.在上述实验中碘分子都没有发生改变,所以都能使淀粉变蓝色.(4)馒头不变色,可知食盐不存在碘分子
13.根据下列材料回答问题
材料1:法国科学家利用特种显微仪器,让一个分子做出各种动作,这一成果使人类能精确控制单个分子运动,进而开发出分子机器人。
材料2:中科院上海硅酸盐研究所研制出了“药物分子运输车”.这种分子装载药物后,被引导到疾病靶点释放药物,对疾病进行高效治疗。
(1)材料1和2研究的粒子是______;构成物质的粒子还有______和______.
(2)分析上述材料,谈谈你对“分子总是在不断运动着”的新认识:______.
(3)在阿西莫夫所写的科幻小说《梦幻航行》中,人被缩小到细胞般大小,在人体内经历了梦幻般的体验.试想,如果你被缩小到一个原子般大小,把你放到水里,你会看到的景象是(请至少写两点)
。
【答案】(1)分子,原子,离子(2)着研究的深入,人也可以控制分子的定向移动;
(3)我在水分子之间穿行,不断运动的水分子有时可以撞到我.
【解析】(1)构成物质的基本微粒有三种,即分子、原子和离子,故填:分子,原子,离子;
(2)微观粒子总是在不断运动的,人类已经能够控制分子的定向运动,故填:随着研究的深入,人也可以控制分子的定向移动;
(3)水分子很小,分子与分子之间有一定的间隔,分子在不断的运动,故填:我在水分子之间穿行,不断运动的水分子有时可以撞到我.
原子
元素
定义
化学变化中的最小粒子
具有相同质子数相同的一类原子的总称
区别
①是微观概念
②既讲 种类 又讲 个数
③直接构成分子,也可直接构成 物质
①是宏观 概念
②只讲种类 不讲 个数
③只能组成物质
相互关系
元素是质子数相同的一类原子的总称,原子是元素 的个体
元素
名称
元素
符号
相对原
子质量
元素
名称
元素
符号
相对原
子质量
元素
名称
元素
符号
相对原
子质量
元素
名称
元素
符号
相对原
子质量
氢
H
1
氟
F
19
氯
Cl
35.5
铝
Al
27
碳
C
12
硅
Si
28
碘
I
127
钾
K
39
氮
N
14
磷
P
31
钠
Na
23
钙
Ca
40
氧
O
16
硫
S
32
镁
Mg
24
锰
Mn
55
元素
名称
元素
符号
相对原
子质量
元素
名称
元素
符号
相对原
子质量
元素
名称
元素
符号
相对原
子质量
铁
Fe
56
钡
Ba
137
氦
He
4
铜
Cu
64
铂
Pt
195
氖
Ne
20
锌
Zn
65
金
Au
197
氩
Ar
40
银
Ag
108
汞
Hg
201
选项
物质
分类
不同类
A
蒸馏水、白酒、加碘盐、稀有气体
混合物
蒸馏水
B
CaO、H2O、P2O5、K2CO3
氧化物
H2O
C
HgO、NaOH、KCl、P4(白磷)
化合物
P4(白磷)
D
O3、Cu、He、CO
单质
CO
相关试卷
这是一份人教版九年级上册课题1 分子和原子精练,共26页。
这是一份初中化学人教版九年级上册第二单元 我们周围的空气课题2 氧气练习题,共27页。
这是一份初中化学人教版九年级上册第二单元 我们周围的空气课题2 氧气综合训练题,共19页。