

2024届高考化学一轮复习练习第四章非金属及其化合物第17讲卤素的性质及提取
展开
这是一份2024届高考化学一轮复习练习第四章非金属及其化合物第17讲卤素的性质及提取,共14页。
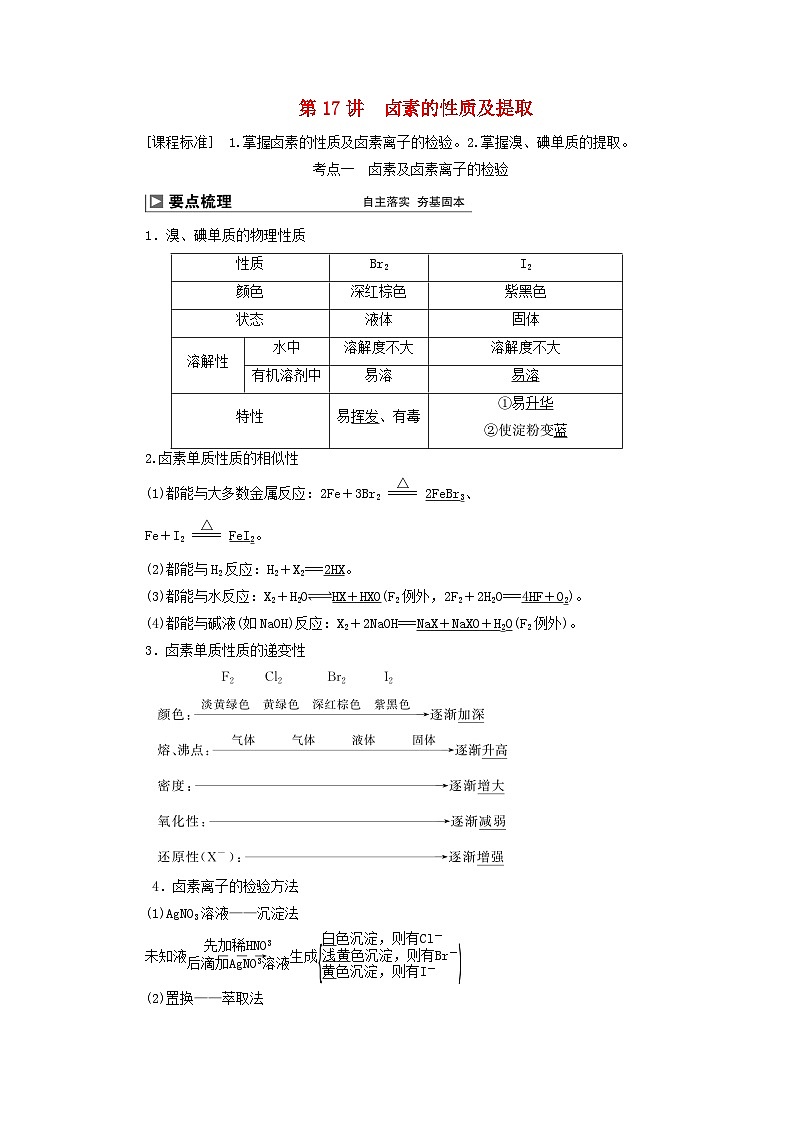
考点一 卤素及卤素离子的检验
1.溴、碘单质的物理性质
2.卤素单质性质的相似性
(1)都能与大多数金属反应:2Fe+3Br2 eq \(=====,\s\up7(△)) 2FeBr3、
Fe+I2 eq \(=====,\s\up7(△)) FeI2。
(2)都能与H2反应:H2+X2===2HX。
(3)都能与水反应:X2+H2OHX+HXO(F2例外,2F2+2H2O===4HF+O2)。
(4)都能与碱液(如NaOH)反应:X2+2NaOH===NaX+NaXO+H2O(F2例外)。
3.卤素单质性质的递变性
4.卤素离子的检验方法
(1)AgNO3溶液——沉淀法
未知液 eq \(――→,\s\up7(先加稀HNO3),\s\d5(后滴加AgNO3溶液)) 生成 eq \b\lc\{(\a\vs4\al\c1(白色沉淀,则有Cl-,浅黄色沉淀,则有Br-,黄色沉淀,则有I-))
(2)置换——萃取法
eq \(\s\up7(无色),\s\d5(未知液)) eq \(――→,\s\up7(加适量新制饱和氯水),\s\d5(振荡)) eq \(――→,\s\up7(加入CCl4(下层)或汽油(上层)),\s\d5(振荡))
有机层呈 eq \b\lc\{(\a\vs4\al\c1(红棕色或橙红色,表明有Br-,紫色、浅紫色或紫红色,表明有I-))
(3)氧化——淀粉法检验I-
未知液 eq \(――→,\s\up7(加入适量新制饱和氯水(或双氧水)),\s\d5(振荡)) eq \(――→,\s\up7(淀粉溶液),\s\d5(振荡)) 蓝色溶液,表明有I-。
[正误辨析]
(1)海水提溴的过程中不发生氧化还原反应( )
(2)可以用淀粉溶液检验加碘食盐中的KIO3( )
(3)用CCl4萃取碘水中的碘,先振荡,后静置,液体分层,下层呈无色( )
(4)碘易升华,可用加热升华法除去NH4Cl中混有的I2( )
(5)实验室保存少量液溴时常加少量水液封,并用玻璃塞密封,不能用橡胶塞( )
(6)类比Fe与Cl2反应,可知Fe与I2反应产物为FeI3( )
(7)I-可使淀粉溶液变蓝( )
答案: (1)× (2)× (3)× (4)× (5)√ (6)× (7)×
eq \a\vs4\al(归纳总结)
卤素单质及其化合物的特殊性质
学生用书第79页
一、卤素离子的检验与鉴别
1.下列叙述中正确的是( )
A.能使湿润的淀粉KI试纸变成蓝色的物质一定是Cl2
B.用硝酸酸化的硝酸银溶液能一次鉴别NaCl、NaBr、KI三种失去标签的溶液
C.某溶液加入CCl4,CCl4层显紫色,证明原溶液中存在I-
D.某浅黄色的溴水,加入CCl4振荡静置后,上层显橙红色
B [还有很多氧化剂(如HNO3、O3等)能将I-氧化为I2,A项错误;碘单质的CCl4溶液显紫色, C项错误;CCl4的密度比水大,应下层显橙红色,D项错误。]
2.鉴别NaCl、NaBr、NaI可以选用的试剂是( )
①碘水、淀粉溶液 ②氯水、CCl4 ③溴水、苯
④稀硝酸、AgNO3溶液 ⑤氯水、苯 ⑥FeCl3溶液、CCl4
A.①②④ B.②③⑥
C.②④⑤ D.④⑤⑥
C [①NaCl、NaBr、NaI中加碘水和淀粉溶液均变蓝色;②氯水加入NaBr、NaI中后,再加CCl4萃取,下层分别为橙红色和紫红色,加入NaCl中不发生反应,可以鉴别;③溴水与NaCl、NaBr不反应,与NaI反应生成I2,用苯萃取后,前两种上层均为橙红色,无法鉴别;④NaCl、NaBr、NaI与AgNO3溶液反应分别生成AgCl、AgBr、AgI沉淀,且均不溶于稀HNO3,沉淀颜色依次为白色、淡黄色、黄色;⑤与②的原理相似,只是有色层在上层;⑥FeCl3溶液只能氧化I-生成I2,不能鉴别。]
二、卤素单质氧化性强弱的实验探究
3.为验证卤素单质氧化性的相对强弱,某小组用如图所示装置进行实验(夹持仪器已略去,气密性已检查)。
实验过程:
Ⅰ.打开弹簧夹,打开活塞a,滴加浓盐酸。
Ⅱ.当B和C中的溶液都变为黄色时,夹紧弹簧夹。
Ⅲ.当B中溶液由黄色变为红棕色时,关闭活塞a。
Ⅳ.……
(1)A中产生黄绿色气体,其电子式是________________________________________。
(2)验证氯气的氧化性强于碘的实验现象是____________________________________
________________________________________________________________________。
(3)B中溶液发生反应的离子方程式是_____________________________________
________________________________________________________________________。
(4)为验证溴的氧化性强于碘,过程Ⅳ的操作和现象是______________________________
________________________________________________________________________。
(5)过程Ⅲ实验的目的是__________________________________________________
________________________________________________________________________。
(6)氯、溴、碘单质的氧化性逐渐减弱的原因:同主族元素从上到下____________________,得电子能力逐渐减弱。
解析: A中滴加浓盐酸后,发生反应:2KMnO4+16HCl(浓)===2KCl+2MnCl2+5Cl2↑+8H2O,生成黄绿色气体Cl2,在A、B、C中分别发生反应:Cl2+2KI===2KCl+I2,Cl2+2NaBr===2NaCl+Br2,Cl2+2NaBr===2NaCl+Br2,由于B、C中生成了Br2而使溶液变为黄色,打开活塞b,C中生成的Br2在D中发生反应:Br2+2KI===2KBr+I2。过程Ⅲ,当B中黄色溶液继续通入过量Cl2时,溶液变为红棕色,以此为对照,说明C中黄色溶液无Cl2,从而排除Cl2对Br2置换I2实验的干扰。
答案: (1)
(2)湿润的淀粉KI试纸变蓝
(3)Cl2+2Br-===Br2+2Cl-
(4)打开活塞b,将少量C中溶液滴入D中,关闭活塞b,取下D振荡,静置后CCl4层变为紫红色
(5)确认C的黄色溶液中无Cl2,排除Cl2对Br2置换I2实验的干扰
(6)原子半径逐渐增大
三、拟卤素和卤素互化物
4.氰[(CN)2]的结构简式为N≡C—C≡N,其化学性质与卤素(X2)很相似,化学上称之为拟卤素,其氧化性质介于Br2和I2之间。
(1)写出(CN)2的电子式: ____________________________________________________。
(2)写出(CN)2在常温下与烧碱溶液反应的化学方程式: __________________________。
(3)在KBr、KI、KCN的混合溶液中通入少量氯气,发生反应的离子方程式为________________________________________________________________________。
答案: (1)
(2)(CN)2+2NaOH===NaCN+NaCNO+H2O
(3)2I-+Cl2===I2+2Cl-
5.一氯化碘(ICl)、三氯化碘(ICl3)是卤素互化物,它们的性质与卤素单质相似。
(1)ICl3与水反应的产物可能为______________________________________(填化学式)。
(2)ICl在常温下与烧碱溶液反应的离子方程式为________________________________,该反应是否是氧化还原反应?________(填“是”或“否”)。
答案: (1)HCl、HIO2
(2)ICl+2OH-===Cl-+IO-+H2O 否
考点二 提取卤素单质的化工流程
1.海水提取溴
(1)流程
(2)主要过程及反应原理
学生用书第80页
2.海带中提取碘
(1)流程
(2)发生反应的离子方程式:Cl2+2I-===I2+2Cl-。
1.从淡化海水中提取溴的流程如下:
eq \x(\a\al(淡化,海水)) eq \(――→,\s\up7(通入Cl2),\s\d5(Ⅰ)) eq \x(\a\al(低浓,度Br2)) eq \(――→,\s\up7(通入空气吹出Br2),\s\d5(用X吸收 Ⅱ)) eq \x(\a\al(含Br-等,的溶液)) eq \(――→,\s\up7(通入Cl2),\s\d5(Ⅲ)) eq \x(\a\al(Br2的,浓溶液)) →…→Ⅳ eq \x(液溴)
下列有关说法不正确的是( )
A.X试剂可用Na2SO3饱和溶液
B.步骤Ⅲ的离子反应方程式:2Br-+Cl2===2Cl-+Br2
C.工业上每获得1 ml Br2,需要消耗Cl2 44.8 L
D.步骤Ⅳ包含萃取、分液和蒸馏
C [Na2SO3+Br2+H2O===Na2SO4+2HBr,A正确;步骤Ⅲ利用氯的非金属性比溴的强,利用置换反应制取Br2,B正确;反应Ⅰ和反应Ⅲ均使用到Cl2,但未标明氯气所处的温度和压强,且反应过程中有损耗,故消耗Cl2的体积未知,C错误;从浓溴水中提取溴,可利用有机溶剂(如苯)萃取溴,然后分液得到溴的有机溶液,再经蒸馏可得纯净的溴,D正确。]
2.从海带中提取碘单质,成熟的工艺流程如下。下列关于海水制碘的说法,不正确的是( )
干海带 eq \(――→,\s\up7(灼烧)) 海带灰 eq \(――→,\s\up7(沸水),\s\d5(浸泡)) 悬浊液 eq \(――→,\s\up7(过滤)) 滤液 eq \(――→,\s\up7(H+),\s\d5(H2O2)) 碘水 eq \(――→,\s\up7(CCl4)) I2的CCl4溶液 eq \(――→,\s\up7(蒸馏)) I2
A.实验室在蒸发皿中灼烧干海带,并且用玻璃棒搅拌
B.含I-的滤液中加入稀硫酸和双氧水后,碘元素发生氧化反应
C.在碘水中加入几滴淀粉溶液,溶液变蓝色
D.碘水加入CCl4得到I2的CCl4溶液,该操作为“萃取”
A [灼烧固体时应在坩埚中,A项不正确;H2O2能将I-氧化为I2,B项正确。]
真题演练 明确考向
1.正误判断,正确的打“√”,错误的打“×”
(1)(2022·海南卷1A) 使用含氟牙膏能预防龋齿( )
(2)(2022·全国乙卷10A)向NaBr溶液中滴加过量氯水,再加入淀粉KI溶液,现象为先变橙色,后变蓝色,则氧化性:Cl2>Br2>I2( )
(3)(2022·江苏卷11C)向盛有淀粉KI溶液的试管中滴加几滴溴水,振荡,观察溶液颜色变化,则Br2的氧化性比I2的强( )
答案: (1)√ (2)× (3)√
2.(2022·辽宁卷)镀锌铁钉放入棕色的碘水中,溶液褪色;取出铁钉后加入少量漂白粉,溶液恢复棕色;加入CCl4,振荡,静置,液体分层。下列说法正确的是( )
A.褪色原因为I2被Fe还原
B.液体分层后,上层呈紫红色
C.镀锌铁钉比镀锡铁钉更易生锈
D.溶液恢复棕色的原因为I-被氧化
D [A.Zn比Fe活泼,更容易失去电子,还原性更强,先与I2发生氧化还原反应,故溶液褪色原因为I2被Zn还原,A项错误;B.液体分层后,I2在CCl4层,CCl4的密度比水大,则下层呈紫红色,B项错误;C.若镀层金属活泼性大于Fe,则Fe不易生锈,反之,若Fe活泼性大于镀层金属,则Fe更易生锈,由于活泼性:Zn>Fe>Sn,则镀锡铁钉更易生锈,C项错误;D.漂白粉的有效成分为Ca(ClO)2,其具有强氧化性,可将I-氧化,D项正确。]
3.(2022·河北卷)LiBr溶液可作为替代氟利昂的绿色制冷剂。合成LiBr工艺流程如下:
下列说法错误的是( )
A.还原工序逸出的Br2用NaOH溶液吸收,吸收液直接返回还原工序
B.除杂工序中产生的滤渣可用煤油进行组分分离
C.中和工序中的化学反应为Li2CO3+2HBr===CO2↑+2LiBr+H2O
D.参与反应的n(Br2)∶n(BaS)∶n(H2SO4)为1∶1∶1
A [由流程可知,氢溴酸中含有少量的溴,加入硫化钡将溴还原生成溴化钡和硫,再加入硫酸除杂,得到的滤渣为硫酸钡和硫;加入碳酸锂进行中和,得到的溴化锂溶液经浓缩等操作后得到产品溴化锂。A.还原工序逸出的Br2用NaOH溶液吸收,吸收液中含有溴化钠和次溴酸钠等物质,若直接返回还原工序,则产品中会有一定量的溴化钠,导致产品的纯度降低,A说法错误;B.除杂工序中产生的滤渣为硫酸钡和硫,硫属于非极性分子形成的分子晶体,而硫酸钡属于离子晶体,根据相似相溶原理可知,硫可溶于煤油,而硫酸钡不溶于煤油,因此可用煤油进行组分分离,B说法正确;C.中和工序中,碳酸锂和氢溴酸发生反应生成溴化锂、二氧化碳和水,该反应的化学方程式为 Li2CO3+2HBr===CO2↑ +2LiBr +H2O,C说法正确;D.根据电子转移守恒可知,溴和硫化钡反应时物质的量之比为1∶1;根据硫酸钡的化学组成及钡元素守恒可知,n(BaS)∶n(H2SO4)为1∶1,因此,参与反应的n(Br2)∶n(BaS)∶n(H2SO4)为1∶1∶1,D说法正确。]
课时精练(十七) 卤素的性质及提取 eq \a\vs4\al(\f(对应学生,用书P362))
(本栏目内容,在学生用书中以独立形式分册装订!)
1.下列关于卤族元素的比较中不正确的是( )
A.卤族元素的原子半径:F<Cl<Br<I
B.氢化物的熔沸点:HCl<HBr<HI<HF
C.单质与氢气化合的难易:F2>Cl2>Br2>I2
D.氢卤酸的酸性:HF>HCl>HBr>HI
D [A项:卤族元素从上到下,随着原子序数的增大,原子半径逐渐增大,所以原子半径:F<Cl<Br<I,不选A;B项:卤族元素从上到下,随着原子序数的增大,卤族元素氢化物的熔沸点逐渐升高,但是HF的熔沸点反常,由于分子间有氢键,HF的熔沸点较高,不选B;C项:卤族元素从上到下,随着原子序数的增大,非金属性减弱,与氢气化合越来越难,所以单质与氢气化合的难易:F2>Cl2>Br2>I2,不选C;D项: 卤族元素从上到下,随着原子序数的增大,非金属性减弱,气态氢化物越来越不稳定,在水中越来越容易电离,氢卤酸的酸性:HF
相关试卷
这是一份2025版高考化学一轮总复习提升训练第四章非金属及其化合物第十一讲氯及其重要化合物考点三卤素的性质及卤素离子的检验微考点二卤素单质的提取及分析,共3页。
这是一份2024届高考化学复习讲义第四章非金属及其化合物第二讲卤素的性质及提取卤素离子的检验考点二海水资源的综合利用__卤素的提取含答案,共4页。试卷主要包含了从海水中提取溴的流程,从海带中提取碘的流程等内容,欢迎下载使用。
这是一份2024届高考化学复习讲义第四章非金属及其化合物第二讲卤素的性质及提取卤素离子的检验考点一卤素的性质及卤素离子的检验含答案,共8页。试卷主要包含了卤素单质的相似性和递变性,卤素离子的检验方法等内容,欢迎下载使用。









