






还剩26页未读,
继续阅读
所属成套资源:全套人教版九年级化学全册单元过关训练课件
成套系列资料,整套一键下载
- 人教版九年级化学第七单元过关训练课件 课件 0 次下载
- 人教版九年级化学第八单元过关训练课件 课件 0 次下载
- 人教版九年级化学第十单元过关训练课件 课件 0 次下载
- 人教版九年级化学上册过关训练课件 课件 0 次下载
- 人教版九年级化学下册过关训练课件 课件 0 次下载
人教版九年级化学第九单元过关训练课件
展开
这是一份人教版九年级化学第九单元过关训练课件,共34页。
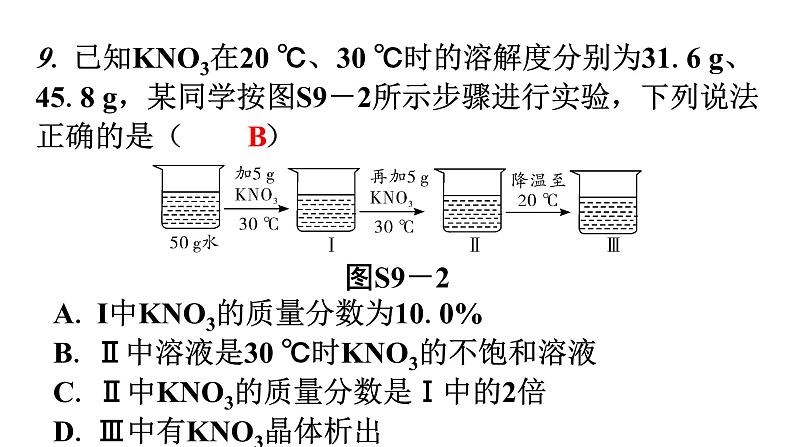
过关训练第九单元过关训练可能用到的相对原子质量:C—12 O—16 Cl—35.5Ca—40 Fe—56 Zn—65 Ag—108一、选择题:本大题共15小题,每小题3分,共45分。在每小题给出的四个选项中,只有一项是符合题目要求的。1. 把少量下列物质分别放入水中,充分搅拌,可得到溶液的是( D )D2. 20 ℃时,向10 g水中加入20.2 g蔗糖,恰好形成饱和溶液,则20 ℃时蔗糖的溶解度为( A )3. 下列溶液中,溶剂是酒精的是( C )AC4. 如图S9-1所示,在盛冷水的烧杯中放入甲、乙两支试管(试管中都有未溶解的该溶液的溶质),若使甲试管中晶体减少,乙试管中晶体增加,需向烧杯中加入的物质是( B )图S9-1B5. 下列有关溶液的叙述正确的是( C )C6. 在70℃时,73g氯化铵饱和溶液中含有氯化铵23g,则70℃时氯化铵溶解度S的计算式错误的是( B )7. 要使某固体物质的不饱和溶液变为饱和溶液,一定可行的方法( A )BA8. 下列说法不正确的是( C )C9. 已知KNO3在20 ℃、30 ℃时的溶解度分别为31.6 g、45.8 g,某同学按图S9-2所示步骤进行实验,下列说法正确的是( B )图S9-2B 专家提示在新冠肺炎疫情防控中,84消毒液可以使新冠病毒灭活。84消毒液有一定的刺激性与腐蚀性,必须稀释以后才能使用,回答10~11题。10. 若用高浓度84消毒液配制一定溶质质量分数的稀84消毒液,下列描述正确的是( )A. 实验的主要步骤是计算、称量、量取、溶解B. 量筒量取所需的水,注入盛有高浓度84消毒液的量筒中C. 实验中用到的玻璃仪器只有烧杯、量筒和胶头滴管D. 量取84消毒液时仰视读数,会使配制的溶液溶质量分数偏大D11. 84消毒液存放处应张贴的标志是( )D12. NaCl和KNO3的溶解度曲线如图S9-3所示,下列说法正确的是( D )图S9-3A13. 下列实验方案中,能达到实验目的的是(C )C14. 如图S9-4是硝酸钠的溶解度曲线,下列说法正确的是( C )图S9-4C15. 下列图像能正确反映其对应操作的是( C ) C二、非选择题:本大题共6小题,第16小题7分,第17小题8分,第18~21小题各10分,共55分。16. 日常生活中,物质溶解的现象广泛存在。(1)蔗糖溶液上半部分的甜度 等于 (填“大于”“小于”或“等于”)下半部分的甜度。 (2)打开碳酸饮料的瓶盖时有大量气泡逸出。请从不同角度加以解释。物理变化角度: 压强减小,CO2气体在水中的溶解度减小 ;化学变化角度: H2CO3 H2O+CO2↑ (写化学方程式)。 等于 压强减小,CO2气体在水中的溶解度减小 H2CO3 (3)根据如图S9-5所示的实验回答问题。图S9-5①甲实验的目的是 探究不同物质在同一溶剂中的溶解性 ; 探究不同物质在同一溶剂中的溶解性 ②观察乙实验,分析产生上述现象的原因: 碘在汽油中的溶解性比在水中的强,且汽油的密度比水小 ; ③向丙实验的试管中加入硝酸铵固体,片刻后,U形管中左侧液面 上升 (填“上升”“不变”或“下降”)。 碘在汽油中的溶解性比在水中的强,且汽油的密度比水小 上升 图S9-517. 如图S9-6所示为NaCl、Na2CO3在水中的溶解度曲线,请回答下列问题。图S9-6(1)NaCl溶液中的溶剂是 H2O (填化学式)。 H2O (2)图中P点所表示的是含义是 30℃时,NaCl和Na2CO3的溶解度相等 。 (3)10℃时,把8gNa2CO3放入50g水中,得到溶液的质量为 55 g,所得溶液溶剂与溶质的质量比为 10∶1 。 (4)Na2CO3溶液中不小心混入了NaCl溶液,想要提纯Na2CO3可以进行的操作是 降温结晶 (填“降温结晶”和“蒸发结晶”)。 30℃时,NaCl和Na2CO3的溶解度相等 55 10∶1 降温结晶 (5)10℃时,向两只盛有100g水的烧杯中,分别加入NaCl、Na2CO3两种物质,至不再溶解为止,所得溶液的溶质质量分数较大的是 NaCl (填化学式);在不改变溶质质量分数的前提下,想把Na2CO3溶液转化为不饱和溶液可以采取的方法是 升温 。 (6)把10 ℃等质量的NaCl和Na2CO3饱和溶液升温到30 ℃,所得溶液的溶质质量分数NaCl溶液 > (填“>”“<”或“=”)Na2CO3溶液。 NaCl 升温 > 18. 农业上需要用16%的氯化钠溶液来选种。如图S9-7是配制100g16%的氯化钠溶液的操作示意图。图S9-7(1)仪器a的名称是 托盘天平 。 托盘天平 (2)操作中存在的错误是 步骤④中瓶塞正放 。请写出正确的操作步骤顺序: ④⑤①②③ (填序号)。 步骤④中瓶塞正放 ④⑤①②③ (3)步骤③中玻璃棒的作用是 搅拌,加速溶解 。 (4)要配制此溶液,需用托盘天平称取NaCl 16 g。将托盘天平调零后,分别在左右托盘放上质量相同的纸片,先 在右盘加16g砝码,然后 往左盘加NaCl固体 ,至托盘天平恰好平衡。若操作均正确,但砝码锈蚀,所配制溶液的质量分数会 偏大 (填“偏大”或“偏小”)。量取水应选择 100 mL(填“10”“50”或“100”)的量筒。 搅拌,加速溶解 16 在右盘加16g砝码 往左盘加NaCl固体偏大 100 (5)实验室要用400g0.9%的NaCl溶液做实验,若用上述配好的溶液稀释配制,需加入水的体积为 377.5 mL。 377.5 【发现问题】滤液中的溶质是什么?Fe+2AgNO3 【提出猜想】猜想Ⅰ:溶质是Fe(NO3)2;猜想Ⅱ:溶质是Zn(NO3)2、Fe(NO3)2;猜想Ⅲ:溶质是 Zn(NO3)2、Fe(NO3)2、AgNO 3 。 猜想Ⅰ一定不成立,理由是 Zn比Fe活泼,Zn会先与AgNO3溶液反应生成Zn(NO3)2,溶液中一定有Zn(N 。 Zn(NO3)2、Fe(NO3)2、AgNO3 Zn比Fe活泼,Zn会先与AgNO3溶液反应生成Zn(NO3)2,溶液中一定有Zn(NO3)2 【分析和结论】(1)猜想 Ⅲ 成立;取滤渣于试管中,加入稀盐酸,实验现象为 无明显现象 。 (2)反应后所得滤渣质量 大于 (填“大于”“等于”或“小于”)原锌粉和铁粉的混合物质量。 【交流反思】判断反应后的混合物中含有哪些物质,除了考虑生成物外,还需考虑 反应物是否过量 。 Cu+ Ⅲ 无明显现象 大于 反应物是否过量 20. 【基础实验与跨学科实践】 利用海水提取粗盐的过程如图S9-8所示,回答下列有关问题。图S9-8(1)一定质量的海水,通过贮水池引入到蒸发池,在没有引入结晶池之前的蒸发过程中,蒸发池中NaCl的质量会 不变 (填“增大”“不变”或“减小”)。 不变 (2)由图中可知海水是 混合物 (填“纯净物”或“混合物”),此过程中没有涉及的实验方法是 D (填字母)。 混合物 D 图S9-8(3)在蒸发池中,经过风吹日晒使水分部分蒸发,蒸发的水分子构成 不变(填“不变”或“改变”)。在结晶池中,继续风吹日晒,海水逐渐成为NaCl的 饱和 (填“饱和”或“不饱和”)溶液。 (4)粗盐中含有的难溶性杂质,在实验室里可以通过溶解、过滤、蒸发等操作将其去除,这些操作中都会用到玻璃棒,其中在过滤和蒸发操作中玻璃棒的作用分别是 引流、 搅拌,防止受热不均,液滴飞溅 。 不变 饱和 引流 搅拌,防止受热不均,液滴飞溅 (5)晒盐过程中得到粗盐和母液。母液的主要成分及其溶解度的变化如图S9-9所示,t1 ℃时KCl的溶解度 < (填“>”或“<”)MgSO4的溶解度。t2 ℃时MgCl2的溶解度为 100g 。t2 ℃时,将等质量的MgCl2、KCl和MgSO4三种物质的饱和溶液分别降温至t1 ℃时,无晶体析出的是 MgSO4 (填化学式)。 < 100 g MgSO4 图S9-921. 某补钙剂的主要成分是CaCO3,欲测定补钙剂中CaCO3的质量分数,某同学进行了如图S9-10所示的操作。已知:其他成分不参与反应且不溶于水。图S9-10(1)生成CO2的质量为 4.4 g。 (2)计算该补钙剂中CaCO3的质量分数。(根据化学方程式计算,写出完整步骤)4.4 (2)计算该补钙剂中CaCO3的质量分数。(根据化学方程式计算,写出完整步骤) 答:该补钙剂中CaCO3的质量分数为50%。(1分)(3)反应后,向烧杯中再加入5.4 g水,所得溶液中溶质的质量分数为 10% 。 10%
过关训练第九单元过关训练可能用到的相对原子质量:C—12 O—16 Cl—35.5Ca—40 Fe—56 Zn—65 Ag—108一、选择题:本大题共15小题,每小题3分,共45分。在每小题给出的四个选项中,只有一项是符合题目要求的。1. 把少量下列物质分别放入水中,充分搅拌,可得到溶液的是( D )D2. 20 ℃时,向10 g水中加入20.2 g蔗糖,恰好形成饱和溶液,则20 ℃时蔗糖的溶解度为( A )3. 下列溶液中,溶剂是酒精的是( C )AC4. 如图S9-1所示,在盛冷水的烧杯中放入甲、乙两支试管(试管中都有未溶解的该溶液的溶质),若使甲试管中晶体减少,乙试管中晶体增加,需向烧杯中加入的物质是( B )图S9-1B5. 下列有关溶液的叙述正确的是( C )C6. 在70℃时,73g氯化铵饱和溶液中含有氯化铵23g,则70℃时氯化铵溶解度S的计算式错误的是( B )7. 要使某固体物质的不饱和溶液变为饱和溶液,一定可行的方法( A )BA8. 下列说法不正确的是( C )C9. 已知KNO3在20 ℃、30 ℃时的溶解度分别为31.6 g、45.8 g,某同学按图S9-2所示步骤进行实验,下列说法正确的是( B )图S9-2B 专家提示在新冠肺炎疫情防控中,84消毒液可以使新冠病毒灭活。84消毒液有一定的刺激性与腐蚀性,必须稀释以后才能使用,回答10~11题。10. 若用高浓度84消毒液配制一定溶质质量分数的稀84消毒液,下列描述正确的是( )A. 实验的主要步骤是计算、称量、量取、溶解B. 量筒量取所需的水,注入盛有高浓度84消毒液的量筒中C. 实验中用到的玻璃仪器只有烧杯、量筒和胶头滴管D. 量取84消毒液时仰视读数,会使配制的溶液溶质量分数偏大D11. 84消毒液存放处应张贴的标志是( )D12. NaCl和KNO3的溶解度曲线如图S9-3所示,下列说法正确的是( D )图S9-3A13. 下列实验方案中,能达到实验目的的是(C )C14. 如图S9-4是硝酸钠的溶解度曲线,下列说法正确的是( C )图S9-4C15. 下列图像能正确反映其对应操作的是( C ) C二、非选择题:本大题共6小题,第16小题7分,第17小题8分,第18~21小题各10分,共55分。16. 日常生活中,物质溶解的现象广泛存在。(1)蔗糖溶液上半部分的甜度 等于 (填“大于”“小于”或“等于”)下半部分的甜度。 (2)打开碳酸饮料的瓶盖时有大量气泡逸出。请从不同角度加以解释。物理变化角度: 压强减小,CO2气体在水中的溶解度减小 ;化学变化角度: H2CO3 H2O+CO2↑ (写化学方程式)。 等于 压强减小,CO2气体在水中的溶解度减小 H2CO3 (3)根据如图S9-5所示的实验回答问题。图S9-5①甲实验的目的是 探究不同物质在同一溶剂中的溶解性 ; 探究不同物质在同一溶剂中的溶解性 ②观察乙实验,分析产生上述现象的原因: 碘在汽油中的溶解性比在水中的强,且汽油的密度比水小 ; ③向丙实验的试管中加入硝酸铵固体,片刻后,U形管中左侧液面 上升 (填“上升”“不变”或“下降”)。 碘在汽油中的溶解性比在水中的强,且汽油的密度比水小 上升 图S9-517. 如图S9-6所示为NaCl、Na2CO3在水中的溶解度曲线,请回答下列问题。图S9-6(1)NaCl溶液中的溶剂是 H2O (填化学式)。 H2O (2)图中P点所表示的是含义是 30℃时,NaCl和Na2CO3的溶解度相等 。 (3)10℃时,把8gNa2CO3放入50g水中,得到溶液的质量为 55 g,所得溶液溶剂与溶质的质量比为 10∶1 。 (4)Na2CO3溶液中不小心混入了NaCl溶液,想要提纯Na2CO3可以进行的操作是 降温结晶 (填“降温结晶”和“蒸发结晶”)。 30℃时,NaCl和Na2CO3的溶解度相等 55 10∶1 降温结晶 (5)10℃时,向两只盛有100g水的烧杯中,分别加入NaCl、Na2CO3两种物质,至不再溶解为止,所得溶液的溶质质量分数较大的是 NaCl (填化学式);在不改变溶质质量分数的前提下,想把Na2CO3溶液转化为不饱和溶液可以采取的方法是 升温 。 (6)把10 ℃等质量的NaCl和Na2CO3饱和溶液升温到30 ℃,所得溶液的溶质质量分数NaCl溶液 > (填“>”“<”或“=”)Na2CO3溶液。 NaCl 升温 > 18. 农业上需要用16%的氯化钠溶液来选种。如图S9-7是配制100g16%的氯化钠溶液的操作示意图。图S9-7(1)仪器a的名称是 托盘天平 。 托盘天平 (2)操作中存在的错误是 步骤④中瓶塞正放 。请写出正确的操作步骤顺序: ④⑤①②③ (填序号)。 步骤④中瓶塞正放 ④⑤①②③ (3)步骤③中玻璃棒的作用是 搅拌,加速溶解 。 (4)要配制此溶液,需用托盘天平称取NaCl 16 g。将托盘天平调零后,分别在左右托盘放上质量相同的纸片,先 在右盘加16g砝码,然后 往左盘加NaCl固体 ,至托盘天平恰好平衡。若操作均正确,但砝码锈蚀,所配制溶液的质量分数会 偏大 (填“偏大”或“偏小”)。量取水应选择 100 mL(填“10”“50”或“100”)的量筒。 搅拌,加速溶解 16 在右盘加16g砝码 往左盘加NaCl固体偏大 100 (5)实验室要用400g0.9%的NaCl溶液做实验,若用上述配好的溶液稀释配制,需加入水的体积为 377.5 mL。 377.5 【发现问题】滤液中的溶质是什么?Fe+2AgNO3 【提出猜想】猜想Ⅰ:溶质是Fe(NO3)2;猜想Ⅱ:溶质是Zn(NO3)2、Fe(NO3)2;猜想Ⅲ:溶质是 Zn(NO3)2、Fe(NO3)2、AgNO 3 。 猜想Ⅰ一定不成立,理由是 Zn比Fe活泼,Zn会先与AgNO3溶液反应生成Zn(NO3)2,溶液中一定有Zn(N 。 Zn(NO3)2、Fe(NO3)2、AgNO3 Zn比Fe活泼,Zn会先与AgNO3溶液反应生成Zn(NO3)2,溶液中一定有Zn(NO3)2 【分析和结论】(1)猜想 Ⅲ 成立;取滤渣于试管中,加入稀盐酸,实验现象为 无明显现象 。 (2)反应后所得滤渣质量 大于 (填“大于”“等于”或“小于”)原锌粉和铁粉的混合物质量。 【交流反思】判断反应后的混合物中含有哪些物质,除了考虑生成物外,还需考虑 反应物是否过量 。 Cu+ Ⅲ 无明显现象 大于 反应物是否过量 20. 【基础实验与跨学科实践】 利用海水提取粗盐的过程如图S9-8所示,回答下列有关问题。图S9-8(1)一定质量的海水,通过贮水池引入到蒸发池,在没有引入结晶池之前的蒸发过程中,蒸发池中NaCl的质量会 不变 (填“增大”“不变”或“减小”)。 不变 (2)由图中可知海水是 混合物 (填“纯净物”或“混合物”),此过程中没有涉及的实验方法是 D (填字母)。 混合物 D 图S9-8(3)在蒸发池中,经过风吹日晒使水分部分蒸发,蒸发的水分子构成 不变(填“不变”或“改变”)。在结晶池中,继续风吹日晒,海水逐渐成为NaCl的 饱和 (填“饱和”或“不饱和”)溶液。 (4)粗盐中含有的难溶性杂质,在实验室里可以通过溶解、过滤、蒸发等操作将其去除,这些操作中都会用到玻璃棒,其中在过滤和蒸发操作中玻璃棒的作用分别是 引流、 搅拌,防止受热不均,液滴飞溅 。 不变 饱和 引流 搅拌,防止受热不均,液滴飞溅 (5)晒盐过程中得到粗盐和母液。母液的主要成分及其溶解度的变化如图S9-9所示,t1 ℃时KCl的溶解度 < (填“>”或“<”)MgSO4的溶解度。t2 ℃时MgCl2的溶解度为 100g 。t2 ℃时,将等质量的MgCl2、KCl和MgSO4三种物质的饱和溶液分别降温至t1 ℃时,无晶体析出的是 MgSO4 (填化学式)。 < 100 g MgSO4 图S9-921. 某补钙剂的主要成分是CaCO3,欲测定补钙剂中CaCO3的质量分数,某同学进行了如图S9-10所示的操作。已知:其他成分不参与反应且不溶于水。图S9-10(1)生成CO2的质量为 4.4 g。 (2)计算该补钙剂中CaCO3的质量分数。(根据化学方程式计算,写出完整步骤)4.4 (2)计算该补钙剂中CaCO3的质量分数。(根据化学方程式计算,写出完整步骤) 答:该补钙剂中CaCO3的质量分数为50%。(1分)(3)反应后,向烧杯中再加入5.4 g水,所得溶液中溶质的质量分数为 10% 。 10%
相关资料
更多









