


专题17 化学反应原理综合题-【专题强化】2024年高考化学二轮专题强化训练
展开第一,用什么资料,怎样使用资料;第二,在那些核心考点上有所突破,准备采取什么样的措施;第三,用时多长,怎样合理分配。
二、怎样查漏。
第一,教师根据一轮复习的基本情况做出预判;第二,通过检测的方式了解学情。
三、怎样补缺。
1、指导学生针对核心考点构建本专题的知识网络;
2、针对学生在检测或考试当中出现的问题,教师要做好系统性讲评;
3、教育学生在对待错题上一定要做到:错题重做,区别对待,就地正法。
4、抓好“四练”。练基本考点,练解题技巧,练解题速度,练答题规范。
2024年高考二轮专题强化训练(非选择题)
专题17 化学反应原理综合题
考情分析:
该题型一般取材于能源、环境保护、化工生产等情景,或者以元素化合物知识为载体,以工业生产为背景,通过某个气相或者溶液中的可逆反应切入。题目围绕一个主题,以“拼盘”的形式呈现,结合图像、表格、数据、装置等信息,综合考查化学反应速率、化学平衡及其影响因素、化学反应中的能量转化、盖斯定律及其应用、热化学方程式的书写、原电池、电解池原理及其电极反应式的书写、水溶液中的离子平衡等知识,甚至还融合考查氧化还原反应、离子反应,涉及知识点较多,但各个小题又比较相对独立。题目的综合性强,化学信息较多,设问角度灵活多变,侧重考查考生接受、整合信息的能力、应用化学知识解决实际问题的能力。
解题策略:
解答基本理论综合题型要坚持审题“三读”,审慎作答。
1.泛读:浏览全题,明确已知和待求解的问题。
2.细读:把握关键字、词、数量关系、图表中信息含义等。
3.精读:深入思考,注意挖掘隐含信息。
认真审题后,根据题目中所给出的文字、图像、数据等提炼出重要的信息,联系相关理论解题,组织答案。书写答案时要“细心、规范、整洁”,避免无谓失分。
由于试题篇幅较长,情境、取材较新,同时联系生产、生活实际进行考查,难度较大,可以理解为高考化学的压轴题型。所以解题时要采用逐个分析、各个击破的方法,认真分析每个小题考查的知识点,迅速转变思路,防止在一个知识点、一个思路上“走到底”。平常训练应注重计算能力(重点训练平衡常数以及转化率的计算)、语言表述能力(利用平衡原理解释实际问题)的培养,提高解读图像的能力,掌握解题技巧。电化学应重点掌握电极反应式的书写技巧以及有关电池参数方面的计算,应用盖斯定律解题时要先确定热化学方程式的组合关系,再确定ΔH间的计算关系。
典题体验,提升素养:(本题共30大题)
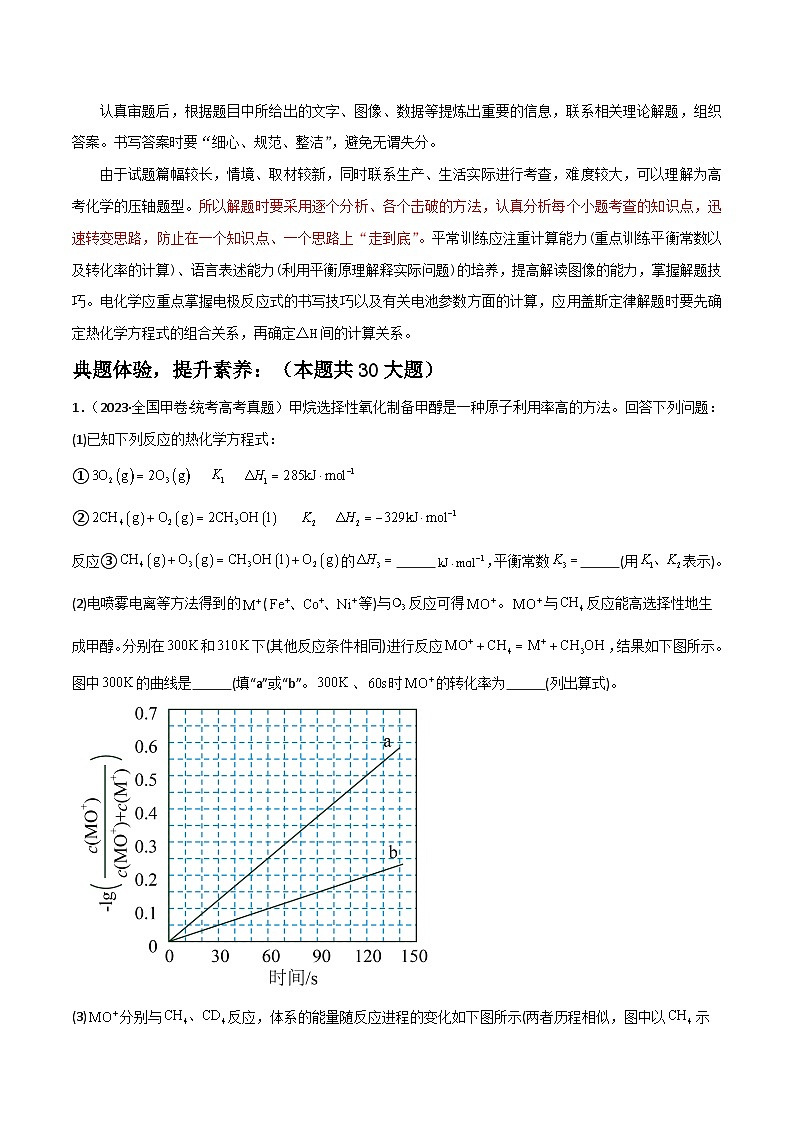
1.(2023·全国甲卷·统考高考真题)甲烷选择性氧化制备甲醇是一种原子利用率高的方法。回答下列问题:
(1)已知下列反应的热化学方程式:
①
②
反应③的 ,平衡常数 (用表示)。
(2)电喷雾电离等方法得到的(等)与反应可得。与反应能高选择性地生成甲醇。分别在和下(其他反应条件相同)进行反应,结果如下图所示。图中的曲线是 (填“a”或“b”。、时的转化率为 (列出算式)。
(3)分别与反应,体系的能量随反应进程的变化如下图所示(两者历程相似,图中以示例)。
(ⅰ)步骤Ⅰ和Ⅱ中涉及氢原子成键变化的是 (填“Ⅰ”或“Ⅱ”)。
(ⅱ)直接参与化学键变化的元素被替换为更重的同位素时,反应速率会变慢,则与反应的能量变化应为图中曲线 (填“c”或“d”)。
(ⅲ)与反应,氘代甲醇的产量 (填“>”“<”或“=”)。若与反应,生成的氘代甲醇有 种。
2.(2023·全国乙卷·统考高考真题)硫酸亚铁在工农业生产中有许多用途,如可用作农药防治小麦黑穗病,制造磁性氧化铁、铁催化剂等。回答下列问题:
(1)在气氛中,的脱水热分解过程如图所示:
根据上述实验结果,可知 , 。
(2)已知下列热化学方程式:
则的 。
(3)将置入抽空的刚性容器中,升高温度发生分解反应:(Ⅰ)。平衡时的关系如下图所示。时,该反应的平衡总压 、平衡常数 。随反应温度升高而 (填“增大”“减小”或“不变”)。
(4)提高温度,上述容器中进一步发生反应(Ⅱ),平衡时 (用表示)。在时,,则 , (列出计算式)。
3.(2023·全国新课标卷·统考高考真题)氨是最重要的化学品之一,我国目前氨的生产能力位居世界首位。回答下列问题:
(1)根据图1数据计算反应的 。
(2)研究表明,合成氨反应在催化剂上可能通过图2机理进行(*表示催化剂表面吸附位,表示被吸附于催化剂表面的)。判断上述反应机理中,速率控制步骤(即速率最慢步骤)为 (填步骤前的标号),理由是 。
(3)合成氨催化剂前驱体(主要成分为)使用前经还原,生成包裹的。已知属于立方晶系,晶胞参数,密度为,则晶胞中含有的原子数为 (列出计算式,阿伏加德罗常数的值为)。
(4)在不同压强下,以两种不同组成进料,反应达平衡时氨的摩尔分数与温度的计算结果如下图所示。其中一种进料组成为,另一种为。(物质i的摩尔分数:)
①图中压强由小到大的顺序为 ,判断的依据是 。
②进料组成中含有惰性气体的图是 。
③图3中,当、时,氮气的转化率 。该温度时,反应的平衡常数 (化为最简式)。
4.(2023·河北·统考高考真题)氮是自然界重要元素之一,研究氮及其化合物的性质以及氮的循环利用对解决环境和能源问题都具有重要意义。
已知:物质中的化学键断裂时所需能量如下表。
回答下列问题:
(1)恒温下,将空气(和的体积分数分别为0.78和0.21,其余为惰性组分)置于容积为的恒容密闭容器中,假设体系中只存在如下两个反应:
i
ii
① 。
②以下操作可以降低上述平衡体系中浓度的有 (填标号)。
A.缩小体积 B.升高温度 C.移除 D.降低浓度
③若上述平衡体系中,则 (写出含a、b、V的计算式)。
(2)氢气催化还原作为一种高效环保的脱硝技术备受关注。高温下氢气还原反应的速率方程为为速率常数。在一定温度下改变体系中各物质浓度,测定结果如下表。
表中第4组的反应速率为 。(写出含r的表达式)
(3)①以空气中的氮气为原料电解合成氨时,在 (填“阴”或“阳”)极上发生反应,产生。
②氨燃料电池和氢燃料电池产生相同电量时,理论上消耗和的质量比为,则在碱性介质中氨燃料电池负极的电极反应式为 。
③我国科学家研究了水溶液中三种催化剂(a、b、c)上电还原为(图1)和电还原为(图2)反应历程中的能量变化,则三种催化剂对电还原为的催化活性由强到弱的顺序为 (用字母a、b、c排序)。
5.(2023·福建·统考高考真题)探究甲醇对丙烷制丙烯的影响。丙烷制烯烃过程主要发生的反应有
ⅰ.
ⅱ.
ⅲ.
已知:为用气体分压表示的平衡常数,分压=物质的量分数×总压。在下,丙烷单独进料时,平衡体系中各组分的体积分数见下表。
(1)比较反应自发进行(∆G=∆H-T∆S<0)的最低温度,反应 ⅰ 反应 ⅱ(填“>”或“<”)。
(2)①在该温度下,Kp2远大于 Kp1,但φ(C3H6)和φ(C2H4)相差不大,说明反应 ⅲ 的正向进行有利于反应 ⅰ 的 反应和反应 ⅱ 的 反应(填“正向”或“逆向”)。
②从初始投料到达到平衡,反应 ⅰ、ⅱ、ⅲ 的丙烷消耗的平均速率从大到小的顺序为: 。
③平衡体系中检测不到,可认为存在反应:,下列相关说法正确的是 (填标号)。
a.
b.
c.使用催化剂,可提高丙烯的平衡产率
d.平衡后再通入少量丙烷,可提高丙烯的体积分数
④由表中数据推算:丙烯选择性 (列出计算式)。
(3)丙烷甲醇共进料时,还发生反应:
ⅳ.
在下,平衡体系中各组分体积分数与进料比的关系如图所示。
①进料比n(丙烷)(甲醇)时,体系总反应:
②随着甲醇投料增加,平衡体系中丙烯的体积分数降低的原因是 。
6.(2023·重庆·统考高考真题)银及其化合物在催化与电化学等领域中具有重要应用。
(1)在银催化下,乙烯与氧气反应生成环氧乙烷(EO)和乙醛(AA)。根据图所示,回答下列问题:
①中间体生成吸附态的活化能为 。
②由生成的热化学方程式为 。
(2)一定条件下,银催化剂表面上存在反应:,该反应平衡压强与温度的关系如下:
①时的平衡常数 。
②起始状态Ⅰ中有和,经下列过程达到各平衡状态:
已知状态Ⅰ和Ⅲ的固体质量相等,下列叙述正确的是 (填字母)。
A.从Ⅰ到Ⅱ的过程
B.
C.平衡常数:
D.若体积,则
E.逆反应的速率:
③某温度下,向恒容容器中加入,分解过程中反应速率与压强的关系为,k为速率常数(定温下为常数)。当固体质量减少时,逆反应速率最大。若转化率为,则 (用表示)。
(3)可用作固体离子导体,能通过加热制得。上述两种晶体的晶胞示意图如图所示(为了简化,只画出了碘离子在晶胞中的位置)。
①测定晶体结构最常用的仪器是 (填字母)。
A.质谱仪 B.红外光谱仪 C.核磁共振仪 D.射线衍射仪
②与晶胞的体积之比为 。
③测定中导电离子类型的实验装置如图所示。实验测得支管a中质量不变,可判定导电离子是而不是,依据是 。
7.(2023·广东·统考高考真题)配合物广泛存在于自然界,且在生产和生活中都发挥着重要作用。
(1)某有机物能与形成橙红色的配离子,该配离子可被氧化成淡蓝色的配离子。
①基态的电子轨道表示式为 。
②完成反应的离子方程式:
(2)某研究小组对(1)中②的反应进行了研究。
用浓度分别为的溶液进行了三组实验,得到随时间t的变化曲线如图。
①时,在内,的平均消耗速率= 。
②下列有关说法中,正确的有 。
A.平衡后加水稀释,增大
B.平衡转化率:
C.三组实验中,反应速率都随反应进程一直减小
D.体系由橙红色转变为淡蓝色所需时间:
(3)R的衍生物L可用于分离稀土。溶液中某稀土离子(用M表示)与L存在平衡:
研究组配制了L起始浓度与L起始浓度比不同的系列溶液,反应平衡后测定其核磁共振氢谱。配体L上的某个特征H在三个物种中的化学位移不同,该特征H对应吸收峰的相对峰面积S(体系中所有特征H的总峰面积计为1)如下表。
【注】核磁共振氢谱中相对峰面积S之比等于吸收峰对应H的原子数目之比;“”表示未检测到。
①时, 。
②时,平衡浓度比 。
(4)研究组用吸收光谱法研究了(3)中M与L反应体系。当时,测得平衡时各物种随的变化曲线如图。时,计算M的平衡转化率 (写出计算过程,结果保留两位有效数字)。
8.(2023·北京·统考高考真题)尿素合成的发展体现了化学科学与技术的不断进步。
(1)十九世纪初,用氰酸银与在一定条件下反应制得,实现了由无机物到有机物的合成。该反应的化学方程式是 。
(2)二十世纪初,工业上以和为原料在一定温度和压强下合成尿素。反应分两步:
ⅰ.和生成;
ⅱ.分解生成尿素。
结合反应过程中能量变化示意图,下列说法正确的是 (填序号)。
a.活化能:反应ⅰ<反应ⅱ
b.ⅰ为放热反应,ⅱ为吸热反应
c.
(3)近年研究发现,电催化和含氮物质(等)在常温常压下合成尿素,有助于实现碳中和及解决含氮废水污染问题。向一定浓度的溶液通至饱和,在电极上反应生成,电解原理如图所示。
①电极是电解池的 极。
②电解过程中生成尿素的电极反应式是 。
(4)尿素样品含氮量的测定方法如下。
已知:溶液中不能直接用溶液准确滴定。
①消化液中的含氮粒子是 。
②步骤ⅳ中标准溶液的浓度和消耗的体积分别为和,计算样品含氮量还需要的实验数据有 。
9.(2023·浙江·统考高考真题)水煤气变换反应是工业上的重要反应,可用于制氢。
水煤气变换反应:
该反应分两步完成:
请回答:
(1) 。
(2)恒定总压和水碳比[]投料,在不同条件下达到平衡时和的分压(某成分分压=总压×该成分的物质的量分数)如下表:
①在条件1下,水煤气变换反应的平衡常数 。
②对比条件1,条件2中产率下降是因为发生了一个不涉及的副反应,写出该反应方程式 。
(3)下列说法正确的是______。
A.通入反应器的原料气中应避免混入
B.恒定水碳比,增加体系总压可提高的平衡产率
C.通入过量的水蒸气可防止被进一步还原为
D.通过充入惰性气体增加体系总压,可提高反应速率
(4)水煤气变换反应是放热的可逆反应,需在多个催化剂反应层间进行降温操作以“去除”反应过程中的余热(如图1所示),保证反应在最适宜温度附近进行。
①在催化剂活性温度范围内,图2中b-c段对应降温操作的过程,实现该过程的一种操作方法是 。
A.按原水碳比通入冷的原料气 B.喷入冷水(蒸气) C.通过热交换器换热
②若采用喷入冷水(蒸气)的方式降温,在图3中作出平衡转化率随温度变化的曲线 。
(5)在催化剂活性温度范围内,水煤气变换反应的历程包含反应物分子在催化剂表面的吸附(快速)、反应及产物分子脱附等过程。随着温度升高,该反应的反应速率先增大后减小,其速率减小的原因是 。
10.(2023·山东·统考高考真题)一定条件下,水气变换反应的中间产物是。为探究该反应过程,研究水溶液在密封石英管中的分解反应:
Ⅰ.
Ⅱ.
研究发现,在反应Ⅰ、Ⅱ中,仅对反应Ⅰ有催加速作用;反应Ⅰ速率远大于反应Ⅱ,近似认为反应Ⅰ建立平衡后始终处于平衡状态。忽略水电离,其浓度视为常数。回答下列问题:
(1)一定条件下,反应Ⅰ、Ⅱ的焓变分别为、,则该条件下水气变换反应的焓变 (用含的代数式表示)。
(2)反应Ⅰ正反应速率方程为:,k为反应速率常数。温度下,电离平衡常数为,当平衡浓度为时,浓度为 ,此时反应Ⅰ的反应速率 (用含和k的代数式表示)。
(3)温度下,在密封石英管内完全充满水溶液,使分解,分解产物均完全溶于水。含碳物种浓度与反应时间的变化关系如图所示(忽略碳元素的其他存在形式)。时刻测得的浓度分别为,反应Ⅱ达平衡时,测得的浓度为。体系达平衡后 (用含y的代数式表示,下同),反应Ⅱ的平衡常数为 。
相同条件下,若反应起始时溶液中同时还含有盐酸,则图示点中,的浓度峰值点可能是 (填标号)。与不含盐酸相比,达浓度峰值时,浓度 (填“增大”“减小”或“不变”),的值 (填“增大”“减小”或“不变”)。
11.(2023·湖南·统考高考真题)聚苯乙烯是一类重要的高分子材料,可通过苯乙烯聚合制得。
Ⅰ.苯乙烯的制备
(1)已知下列反应的热化学方程式:
①
②
③
计算反应④的 ;
(2)在某温度、下,向反应器中充入气态乙苯发生反应④,其平衡转化率为50%,欲将平衡转化率提高至75%,需要向反应器中充入 水蒸气作为稀释气(计算时忽略副反应);
(3)在、下,以水蒸气作稀释气。作催化剂,乙苯除脱氢生成苯乙烯外,还会发生如下两个副反应:
⑤
⑥
以上反应体系中,芳香烃产物苯乙烯、苯和甲苯的选择性S()随乙苯转化率的变化曲线如图所示,其中曲线b代表的产物是 ,理由是 ;
(4)关于本反应体系中催化剂的描述错误的是_______;
A.X射线衍射技术可测定晶体结构
B.可改变乙苯平衡转化率
C.降低了乙苯脱氢反应的活化能
D.改变颗粒大小不影响反应速率
Ⅱ.苯乙烯的聚合
苯乙烯聚合有多种方法,其中一种方法的关键步骤是某(Ⅰ)的配合物促进(引发剂,X表示卤素)生成自由基,实现苯乙烯可控聚合。
(5)引发剂中活性最高的是 ;
(6)室温下,①在配体L的水溶液中形成,其反应平衡常数为K;②在水中的溶度积常数为。由此可知,在配体L的水溶液中溶解反应的平衡常数为 (所有方程式中计量系数关系均为最简整数比)。
12.(2023·湖北·统考高考真题)纳米碗是一种奇特的碗状共轭体系。高温条件下,可以由分子经过连续5步氢抽提和闭环脱氢反应生成。的反应机理和能量变化如下:
回答下列问题:
(1)已知中的碳氢键和碳碳键的键能分别为和,H-H键能为。估算的 。
(2)图示历程包含 个基元反应,其中速率最慢的是第 个。
(3)纳米碗中五元环和六元环结构的数目分别为 、 。
(4)1200K时,假定体系内只有反应发生,反应过程中压强恒定为(即的初始压强),平衡转化率为α,该反应的平衡常数为 (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(5)及反应的(为平衡常数)随温度倒数的关系如图所示。已知本实验条件下,(R为理想气体常数,c为截距)。图中两条线几乎平行,从结构的角度分析其原因是 。
(6)下列措施既能提高反应物的平衡转化率,又能增大生成的反应速率的是 (填标号)。
a.升高温度 b.增大压强 c.加入催化剂
13.(2023·辽宁·统考高考真题)硫酸工业在国民经济中占有重要地位。
(1)我国古籍记载了硫酸的制备方法——“炼石胆(CuSO4·5H2O)取精华法”。借助现代仪器分析,该制备过程中CuSO4·5H2O分解的TG曲线(热重)及DSC曲线(反映体系热量变化情况,数值已省略)如下图所示。700℃左右有两个吸热峰,则此时分解生成的氧化物有SO2、 和 (填化学式)。
(2)铅室法使用了大容积铅室制备硫酸(76%以下),副产物为亚硝基硫酸,主要反应如下:
NO2+SO2+H2O=NO+H2SO4
2NO+O2=2NO2
(ⅰ)上述过程中NO2的作用为 。
(ⅱ)为了适应化工生产的需求,铅室法最终被接触法所代替,其主要原因是 (答出两点即可)。
(3)接触法制硫酸的关键反应为SO2的催化氧化:
SO2(g)+O2(g)SO3(g) ΔH=-98.9kJ·ml-1
(ⅰ)为寻求固定投料比下不同反应阶段的最佳生产温度,绘制相应转化率(α)下反应速率(数值已略去)与温度的关系如下图所示,下列说法正确的是 。
a.温度越高,反应速率越大
b.α=0.88的曲线代表平衡转化率
c.α越大,反应速率最大值对应温度越低
d.可根据不同下的最大速率,选择最佳生产温度
(ⅱ)为提高钒催化剂的综合性能,我国科学家对其进行了改良。不同催化剂下,温度和转化率关系如下图所示,催化性能最佳的是 (填标号)。
(ⅲ)设O2的平衡分压为p,SO2的平衡转化率为αe,用含p和αe的代数式表示上述催化氧化反应的Kp= (用平衡分压代替平衡浓度计算)。
14.(2024届·陕西·校联考模拟预测)甲醇是重要的化学工业基础原料和清洁液体燃料。工业上可利用CO或来生产甲醇燃料。
已知:反应Ⅰ: ;
反应Ⅱ: ;
反应Ⅲ: 。
回答下列问题:
(1)反应Ⅱ的 。
(2)若已知反应Ⅰ、Ⅱ的平衡常数分别为、,则反应Ⅲ的平衡常数 (用、表示)。
(3)250℃时,若在1L恒容密闭容器中充入3ml和1ml发生反应Ⅰ,平衡后,的体积分数为。
①的平衡转化率为 。
②该反应在此温度下的平衡常数 (用分数表示)。
③若要进一步提高甲醇的体积分数。可采取的措施有 。
④若测得在相同时间内不同温度下的转化率如图所示。温度为aK时,图中A点 (填“是”或“不是”)处于平衡状态。在bK之前,转化率随着温度升高而增大的原因是 。
(4)某科研小组研究了反应Ⅲ的速率与反应物浓度的关系,获得其速率方程,k为速率常数(只受温度影响),m为CO的反应级数。在某温度下进行实验,测得各组分初浓度和反应初速率如下:
CO的反应级数m= ;当实验2进行到某时刻,测得,则此时的反速率 (已知:)。
15.(2024届·安徽黄山·统考一模)是重要的化工原料,合理使用能发挥其在工业生产、物质合成、速率分析等领域的重要作用。
(1)已知下列反应的热化学方程式:
①
②
计算燃烧生成反应③的 。
(2)已知下列键能数据,结合反应③数据,计算的键能是 。
(3)650K时,某研究小组测得反应i:的浓度、速率数据如下:
已知k为速率常数,一般情况下只与温度有关,实验测得
,通过以上实验数据可知 , ;650K时,若,, 。
(4)在上述实验过程中,同时发生了如下副反应ii:,650K时,向容积为2L的密闭容器中通入和,10min 后体系达到平衡,此时、的物质的量分别为1.8ml、0.3ml,反应i的平衡常数为 。
(5)已知CO是常见配体,配位时简单认为1个CO提供2个电子,EAN规则认为金属的价电子数加上配体提供的电子数等于18时,配位化合物一般较稳定,下列结构能够稳定存在的有__________。
A.B.C.D.
(6)CO可以用于生产多晶金刚石箔,将一氧化碳和氢气混合,在高温高压下通过催化剂使之沉积在金属基底上,形成金刚石晶体。金刚石的晶胞如图,晶胞参数为bnm,晶胞中C与C间的最大距离为 nm,晶体密度为 (列出计算式,阿伏加德罗常数的值为)。
16.(2024届·四川巴中·统考一模)研究的综合利用、实现资源化,生产高能燃料和高附加值化学品,有利于实现碳资源的有效循环。回答下列问题:
(1)已知下列反应的热化学方程式:
Ⅰ.
Ⅱ.
Ⅲ.
反应Ⅱ中, (用含和的式子表示),该反应在 下能自发进行(填“高温”或“低温”)。
(2)在某刚性容器中投入和仅发生反应Ⅰ和Ⅱ达到平衡,转化率为,为,则平衡时的转化率为 ,反应Ⅰ的平衡常数为 。
(3)在时,向绝热,体积为2L的刚性容器中投入和仅发生反应Ⅲ达到平衡。测得在相同时间内,不同温度下的转化率如图所示。温度大于时,升高温度的转化率下降的原因可能是 。
下列叙述中能说明反应体系达到平衡的是 (填字母序号)。
a.
b.和的物质的量之比不再发生变化
c.混合气体的密度不再发生变化
d.混合气体的平均摩尔质量不变
e.体系温度恒定
(4)采用电化学法还原是一种使资源化的方法,如图是利用此法制备(微溶于水)的示意图(电解液不参与反应)。
①Zn与电源的 相连(填“正极”或“负极”)
②阴极的电极反应式为: 。
17.(2024届·安徽滁州·统考一模)晶体硅主要用于微电子技术。工业上将粗硅经以下两步反应制备高纯硅:
i.
ii.
回答下列问题:
(1)已知:。
写出还原生成的热化学方程式为 。
(2)在、温度下,将、和分别加入体积固定的密闭容器中,在催化条件下发生反应i、ii.测得的转化率及体系内的压强随时间的变化关系如图所示。
① (填“>”、“<”或“=”),理由是 。
②若使用带可移动的活塞的容器进行上述实验,则晶体Si的平衡产率 。(填“增大”、“减小”或“不变”)
③温度下,200min内用的分压变化表示平均反应速率为 Pa∙min-1。
④温度下,反应i的标准平衡常数的计算式为 。(已知:分压=总压×物质的量分数,对于反应的,其中,、、、为各组分的平衡分压)。
18.(2024届·广东汕头·统考一模)铁及其化合物在催化、生产实验中具有重要作用
(1)铁钴催化剂中基态C原子的电子排布式: 。
(2)已知:
①催化乙苯脱氢制得苯乙烯反应Ⅰ:
(用、、表示)。
②下列关于反应Ⅰ说法正确的是 。
A.X射线衍射技术可测得晶体结构
B.可改变乙苯平衡转化率
C.升高温度,正、逆反应速率均加快
D.仅从平衡移动角度分析,生产苯乙烯选择恒容条件优于恒压条件
③某温度下,向2.0L恒容密闭容器中充入,在催化剂作用下发生反应Ⅰ,测得乙苯脱氢反应时间(t)与容器内气体总压强(p)的数据见下表:
用单位时间内气体分压的变化来表示反应速率,即,则前4h内平均反应速率 。
(3)常温下构建Fe(Ⅲ)溶液体系,已知为某邻苯二酚类配体,其电离平衡常数,,其中,。体系中含Fe物种的组分分布系数δ与pH的关系如图所示(分布系数):
①当pH=1时,体系中发生主要反应:,此时该反应的K≈ 。
②当pH=4时,参与配位的 ml/L。
③pH在9.5~10.5之间,含L的物种主要为 (填“”、“”、“”),列出相关计算式进行说明: 。
19.(2024届·海南·校联考模拟预测)1868年狄肯和洪特发明了用氯化铜作催化剂,在加热时,用空气中的氧化气体制取的方法,称为“地康法”。其反应原理为。回答下列问题:
(1)已知部分共价键的键能如表所示。
根据键能数据计算上述反应的= ,该反应在 (填“较高”“较低”或“任何”)温度下能自发进行。
(2)在反应器中充入一定量和,发生上述反应,测得的平衡转化率与压强、温度关系如图1所示。
①其他条件相同时,增大压强,的平衡转化率增大的原因是 。
②下列物理量中,点大于点的是 (填字母)。
A.正反应速率 B.体积分数 C.混合气体的平均摩尔质量
③若对P点体系升温,同时扩大容器体积使压强减小,达到新平衡时P点可能达到图中 点(填“”“”“”或“”)。
(3)一定温度下,向恒容密闭容器中充入和发生上述反应,测得平衡体系中体积分数与起始投料比关系如图2所示。在、、三点中,的平衡转化率最大的点是 。若点对应体系压强为,则该点平衡常数= (列出计算式)。
20.(2024届·四川德阳·校联考二模)资源化利用是实现减排的首要途径。已知加氢制甲醇反应体系中,主要反应有
Ⅰ.
Ⅱ.
Ⅲ.
回答下列问题:
(1) 。
(2)在一定温度范围和压强范围内,只发生反应Ⅰ和Ⅱ,为了增大甲醇产率,理论上可采取的措施是 (写2点);
(3)已知反应Ⅰ和Ⅱ的,随温度的变化如图所示:
①300K时,、、由大到小的顺序为 。
②在600K、3MPa下,向密闭容器中充入2ml和1ml,只发生反应Ⅰ和Ⅱ,开始时甲醇与CO的生成速率之比为6∶1,达到平衡时,生成速率之比为3∶1,甲醇的生成速率方程,CO的生成速率方程,、为速率方程常数、为常数。体系达到平衡时, ,的平衡转化率为 。
(4)电池的研究取得了新的进展,在TAPP-Mn(Ⅱ)作用下,其电池结构和正极反应历程如下:
①该正极反应历程中有 种中间产物;
②放电时,该电池的正极反应式为 。
21.(2024届·贵州贵阳·统考一模)以NOx为主要成分的雾霾综合治理是当前重要的研究课题,其中汽车尾气的处理尤为重要。
已知:
回答下列问题:
(1)汽车尾气中的NO和CO在催化转换器中发生以下反应可减少尾气污染:
△H。则△H= kJ∙ml-1(用含a、b、c的表达式表示)。已知该反应低温时为自发反应,则该反应的反应热△H 0(填“>”、“<”或“=”)。
(2)某温度时,向2L恒容密闭体系中通入2ml CO和1ml NO发生反应:
①下列能说明反应达到平衡状态的是 。
a.
b.体系中混合气体密度不再改变
c.CO与NO转化率的比值不再改变
d.该温度下,的值不再改变
②某温度下,该反应达平衡时CO与CO2体积分数之比为3:2,则平衡常数为 。该反应中的,,则该反应达到平衡时, (填“>”、“<”或“=”)。
③平衡时CO2的体积分数与温度、压强的关系如图所示。则温度:T1 T2(填“>”或“<”),理由是 。
④若在D点对反应容器升温的同时扩大体积使体系压强减小,重新达到的平衡状态可能是图中A~G点中的 (填字母序号)点。
22.(2024届·吉林延边·统考一模)利用催化加氢制二甲醚,可以实现的再利用,涉及以下主要反应:
I.
Ⅱ.
相关物质及能量变化的示意图如图1所示。
回答下列问题:
(1)反应Ⅱ的 ,该反应在 (填“高温”、“低温”或“任何温度”)下能自发进行。
(2)恒压条件下,、起始量相等时,的平衡转化率和的选择性随温度变化如图2所示。已知:的选择性
①时,通入、各,平衡时的选择性、的平衡转化率都为,平衡时生成的物质的量为 ,此温度下反应I的平衡常数 (保留2位有效数字。用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
②区间,平衡转化率随温度变化的曲线如图2所示,分析曲线变化的原因: 。
(3)如图所示是绿色电源“二甲醚()燃料电池”的工作原理示意图(a、b均为多孔性电极)。负极是 (填写“a”或“b”),该电极的电极反应式是 ,若有氢离子通过质子交换膜,则b电极在标准状况下吸收 氧气。
23.(2024届·河南南阳·校联考一模)某科研团队利用和反应使之转化为水煤气,对争取2060年前实现“碳中和”、减缓燃料危机和减轻温室效应具有重要的意义。请回答下列问题:
(1)已知:①
②
③
则 (用含的式子表示)。
(2)均为的恒容密闭容器,向容器中充入和,向容器中充入和,在催化剂存在下发生反应:,测得的平衡转化率随温度的变化如图甲所示.
①容器中在温度为时,到达点,用表示内的化学反应速率为 ,此时的化学平衡常数为 (保留两位小数),若在此温度下时向容器的平衡体系中再充入各各,重新达到平衡前, (填““”或)。
②点时该反应的平衡常数为,则 (填“>”“<”或“=”)。
③两点处容器内气体总压强分别是,则的大小顺序为 。
(3)对于反应③:,在使用不同催化剂时,相同时间内测得的转化率随温度的变化如图乙所示.
则催化效果最佳的是催化剂 (填“Ⅰ”“Ⅱ”或“Ⅲ”).如果点已经达到平衡状态,则点的 (填“>”“<”或“=”),点转化率比点低的原因是 。
24.(2024届·广西柳州·南宁三中校联考一模)二氧化碳催化加氢制甲醇,能助力“碳达峰”,涉及反应有:
反应①
反应②
反应③
(1)反应②自发进行的条件是 (填“高温”、“低温”或“任意温度”),反应③ 。
(2)反应③在热力学上趋势大于反应①,其原因是 。
(3)反应③有催化剂和无催化剂作用下的反应机理如图所示(其中标有*的为吸附在催化剂表面上的物种,TS为过渡态),催化剂可使反应历程中决速步骤的活化能降低 eV(eV为能量单位)。
(4)在下,和按物质的量之比为进行投料,只发生反应①和反应③,平衡时CO和在含碳产物中的物质的量分数及转化率随温度的变化如图所示。
①图中a代表的物质是 。
②q曲线在250℃之后随温度升高而增大的原因是 。
③250℃时,反应①的平衡常数 (为以分压表示的平衡常数,分压=总压×物质的量分数)。
(5)向一定浓度的溶液通入至饱和,在电极上反应生成,电解原理如图所示(阴、阳极区溶液均为溶液)。电解过程中生成尿素的电极反应式为 。
25.(2024届·陕西安康·统考一模)达成“双碳”目标的重要途径是实现碳的固定。利用CO、和可以合成生物质能源甲醇:
反应1:
反应2:
反应3:
回答下列问题:
(1)反应1在 (填“较高温度”“较低温度”或“任何温度”)下能自发进行。
(2) 。
(3)T℃时,向一恒容密闭容器中仅充入1mlCO(g)和,仅发生反应2。下列叙述错误的是___________(填标号)。
A.加入催化剂,反应速率增大
B.CO体积分数不变时,反应达到平衡状态
C.平衡后,充入氩气,平衡正向移动
D.平衡后,充入,CO平衡转化率增大
(4)在某催化剂作用下,反应2的历程如图所示(图中数据表示微粒的相对能量,*表示吸附在催化剂表面上)。
控速反应方程式为 。
(5)在某催化剂作用下,只发生反应:。该反应的速率方程式为,(k为速率常数,只与温度、催化剂有关)。830℃时该反应的平衡常数K=1,达到平衡后, (填“>”“<”或“=”,下同),900℃时 。
(6)时,在密闭容器甲、乙中,分别充入和,它们分别在有水分子筛(只允许水分子透过)和无水分子筛条件下仅发生反应1.测得平衡转化率与压强关系如图所示。
①使用了水分子筛的容器是 (填“甲”或“乙”)。
②平衡常数 (填“>”“<”或“=”),M点 kPa。
(7)时,向一体积为1L的恒容密闭容器中充入1mlCO、和,在一定条件下发生上述3个反应,达到平衡时得到和,此时平衡转化率为50%。该温度下,反应1的平衡常数K= 。(列出计算式)
26.(2024届·四川南充·统考一模)丙烯是一种重要化工原料,工业上丙烷制丙烯的相关反应如下:
ⅰ.
ⅱ.
ⅲ.
回答下列问题:
Ⅰ.单独投料(副反应抑制法):
时,单独加入至后达到平衡,体系中部分组分(仅考虑表内转化)的体积分数见下表。
(1)反应: kJ/ml。
(2)若只考虑体系中反应ⅱ(),以下操作有利于减小平衡转化率的是 (填字母标号)。
a.通入少量 b.使用高选择性催化剂 c.降温 d.减压
(3)内消耗的平均速率反应ⅰ 反应ⅱ(填“小于”、“大于”或“等于”)。
(4)由表中数据推算:丙烯选择性 (列出计算式)。
Ⅱ.共进料投料(耦合反应法):
工业上也常采用与共进料投料,通过发生耦合反应制丙烯,反应如下:
(5)表示反应的平衡常数,一定温度下:
ⅰ.
ⅳ.
则体系中反应 (用含的代数式表示)。
(6)实际工艺生产中按进料,平衡体系中部分组分的体积分数与温度的关系如图所示,综合反应分析:
①由图可知反应ⅰ是 反应。(填写“吸热”或“放热”)
②生产中温度须不低于原因是 。
27.(2024届·辽宁·校联考模拟预测)乙腈又名甲基氰,是重要的化工产品。乙醇氨化还原制乙腈的总反应为 。
已知:Ⅰ. ;
Ⅱ. 。
(1)① 。
②在 (填“较低”或“较高”)温度下,有利于总反应正向自发进行。
(2)保持压强不变,向恒温密闭容器中按体积比1:3充入CH3CH2OH(g)和NH3(g)发生反应,通过实验测得体系中某有机物占总有机物的物质的量分数w%[比如CH3CH2OH的]随时间t的变化如图所示。
则反应Ⅱ达平衡时的 (用物质的量分数表示平衡常数)。
(3)保持其他条件不变,科研小组在探究使用铜系催化剂(能较好地吸附NH3等小分子)反应的最佳条件时,通过调整物料氨醇比,得到其对单位时间内乙醇转化率的影响如图所示:
试说明氨醇比大于7,乙醇单位时间转化率急剧下降的可能原因: 。
(4)科学工作者对反应Ⅱ进行了深入研究,发现其反应过程如下:
①X的结构简式为 ,X→Z的化学方程式为 。
②结合反应过程,提出一种可有效减少副产物Y平衡产率的方法: 。
③计算显示Z→W(产物异构化反应)是一个明显的吸热过程,试从活化能的角度说明该生产过程Z是优势产物的原因: 。
28.(2024届·吉林·校联考模拟预测)氢能是一种重要的绿色能源,在实现“碳中和”与“碳达峰”目标中起到重要作用。乙醇与水催化重整制氢发生以下反应:
反应Ⅰ:
反应Ⅱ:
回答下列问题:
(1)①已知反应Ⅲ:,,
则 。
②反应Ⅰ能自发进行的条件为 。
(2)压强为100,的平衡产率与温度、起始时的关系如图所示,每条曲线表示相同的平衡产率。
①反应Ⅱ的平衡常数: (填“>”、“=”或“<”)
②的产率:C点 B点(填“>”、“=”或“<”);
③A、B两点产率相等的原因是 。
(3)压强为100下,1和3发生上述反应,平衡时和的选择性、乙醇的转化率随温度的升高曲线如图所示。[已知:的选择性]
①573K时,10分钟反应达到平衡,则乙醇的物质的量的变化量 。
②表示选择性的曲线是 (填标号)。
③573K时,反应Ⅱ的 (保留到小数点后两位)。
29.(2024届·广东茂名·统考模拟预测)甲醇的用途十分广泛,主要用于有机合成、作燃料、生成农药、作良好的有机溶剂等。催化CO和H2反应可以合成甲醇,反应化学方程式为CO(g)+2H2(g)CH3OH(g)。
已知:①CO2 (g)+H2(g)CO(g)+H2O(g) ΔH1=+41 kJ·ml−1
②CO2(g)+3H2(g)CH3OH(g)+H2O(g) ΔH2=-58 kJ·ml−1
(1)催化CO和H2合成甲醇反应:CO(g)+2H2(g)CH3OH(g)的ΔH= 。
(2)对于催化CO和H2合成甲醇的反应,增大压强,平衡 (填“向左”“向右”或“不”)移动;温度升高平衡常数 (填“变大”“变小”或“不变”)。
(3)在相同条件下研究催化剂I、催化剂Ⅱ对反应CO(g)+2H2(g)CH3OH(g)的影响,在密闭容器内充入一定量CO和H2,部分物质的浓度c随反应时间t 的变化曲线如图所示。
①a曲线表示 。
②催化剂I比催化剂Ⅱ催化效率 (填“高”“低”或“相同”),原因是 。
(4)523K时,在1 L恒容密闭容器中充入2 ml CO和4 ml H2,在催化剂作用下反应合成甲醇,容器内的压强变化如下。
反应从开始到20 min时,以H2浓度表示平均反应速率v(H2)= ;此温度下,压强平衡常数Kp = (MPa)-2。
(5)一定条件下,在3个相同的密闭容器中分别充入CO2 (g)和H2(g),c(CO2):c(H2)分别为1:1、1:2、 1:3,CO2 (g)的转化率随压强的变化关系如图所示,
曲线a的c(CO2):c(H2)= ,原因是 。
30.(2024届·福建厦门·校联考一模)丙烯是重要的化工原料,可用丙烷脱氢制备丙烯。
已知:
回答下列问题:
(1) ;平衡常数 (用和表示)。
(2)不同压强下,在密闭容器中丙烷平衡转化率随温度变化关系如图。
①图中压强曲大到小的顺序为 ,判断的依据是 。
②800K,压强下,若进料组成中加入惰性气体Ar,a点将 (填“上移”或“下移”)。
(3)丙烷直接脱氢存在副反应。一定温度下,丙烷和氢气的混合气体以一定流速通过催化剂表面,丙烷转化率、丙烷平衡转化率、丙烯选择性(曲线a)和丙烯生成速率随变化如图。催化剂反应过程中会有如下转化,且催化活性更强。
①丙烷转化率随变化的曲线为 (填标号)。
②曲线b随的增加而降低的原因是 。丙烯生成速率随增加变化的原因为 。
(4)0.1 Mpa下,时, Mpa(列出计算式即可)。
物质
能量/
945
498
631
组号
1
0.10
0.10
r
2
0.10
0.20
3
0.20
0.10
4
0.05
0.30
?
物质
丙烯
乙烯
甲烷
丙烷
氢气
体积分数(%)
21
23.7
55.2
0.1
0
401
443
463
10
51
100
0
1.00
0
0
a
x
0.64
b
0.40
0.60
条件1
0.40
0.40
0
条件2
0.42
0.36
0.02
实验序号
1
0.100
0.100
2
0.050
0.100
3
0.100
0.200
化学键
键能
496
799
实验编号
①
0.025
0.040
②
0.050
0.040
③
0.025
0.120
时间t/h
0
1
2
4
8
16
20
25
30
总压强p/100kPa
4.91
5.58
6.32
7.31
8.54
9.50
9.52
9.53
9.53
共价键
键能/()
431.8
497.3
242.7
462.8
物质
体积分数
18
20
47
0
反应时间 / min
0
5
10
15
20
25
压强 / MPa
12.4
10.2
8.4
7.0
6.2
6.2
专题16 工艺流程综合题-【专题强化】2024年高考化学二轮专题强化训练: 这是一份专题16 工艺流程综合题-【专题强化】2024年高考化学二轮专题强化训练,文件包含专题16工艺流程综合题-狂飙刷题2024年高考化学二轮专题强化训练原卷版docx、专题16工艺流程综合题-狂飙刷题2024年高考化学二轮专题强化训练解析版docx等2份试卷配套教学资源,其中试卷共95页, 欢迎下载使用。
专题15 化学实验综合题-【专题强化】2024年高考化学二轮专题强化训练: 这是一份专题15 化学实验综合题-【专题强化】2024年高考化学二轮专题强化训练,文件包含专题15化学实验综合题-狂飙刷题2024年高考化学二轮专题强化训练原卷版docx、专题15化学实验综合题-狂飙刷题2024年高考化学二轮专题强化训练解析版docx等2份试卷配套教学资源,其中试卷共98页, 欢迎下载使用。
专题13 化学反应与化学平衡-【专题强化】2024年高考化学二轮专题强化训练: 这是一份专题13 化学反应与化学平衡-【专题强化】2024年高考化学二轮专题强化训练,文件包含专题13化学反应与化学平衡-狂飙刷题2024年高考化学二轮专题强化训练原卷版docx、专题13化学反应与化学平衡-狂飙刷题2024年高考化学二轮专题强化训练解析版docx等2份试卷配套教学资源,其中试卷共46页, 欢迎下载使用。












