




所属成套资源:全套新教材(广西专版)高考化学一轮复习课时教学课件
新教材(广西专版)高考化学一轮复习第5章物质结构与性质 元素周期律第1讲原子结构原子核外电子排布课件
展开
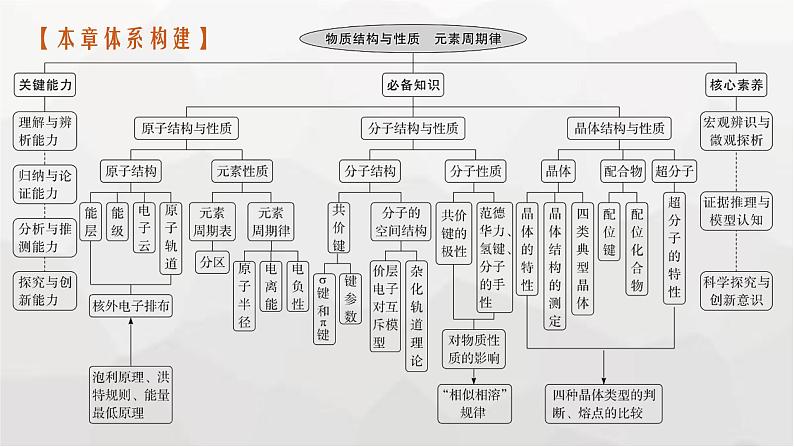
这是一份新教材(广西专版)高考化学一轮复习第5章物质结构与性质 元素周期律第1讲原子结构原子核外电子排布课件,共60页。PPT课件主要包含了内容索引,强基础增分策略,增素能精准突破,研专项前沿命题,明考向真题演练,本章体系构建,课程标准,典例突破,答案B,思路指导等内容,欢迎下载使用。
1.知道元素、核素的含义,了解原子核外电子的排布。认识原子结构呈周期性变化的规律。2.了解有关核外电子运动模型的历史发展过程,认识核外电子的运动特点。3.知道电子运动的能量状态具有量子化的特征(能量不连续),电子可以处于不同的能级,在一定条件下会发生激发与跃迁。4.知道电子的运动状态(空间分布及能量)可通过原子轨道和电子云模型来描述。5.知道原子核外电子的能级高低顺序,了解原子核外电子排布的构造原理。6.认识基态原子中核外电子的排布遵循能量最低原理、泡利不相容原理和洪特规则等。知道1~36号元素基态原子核外电子的排布。
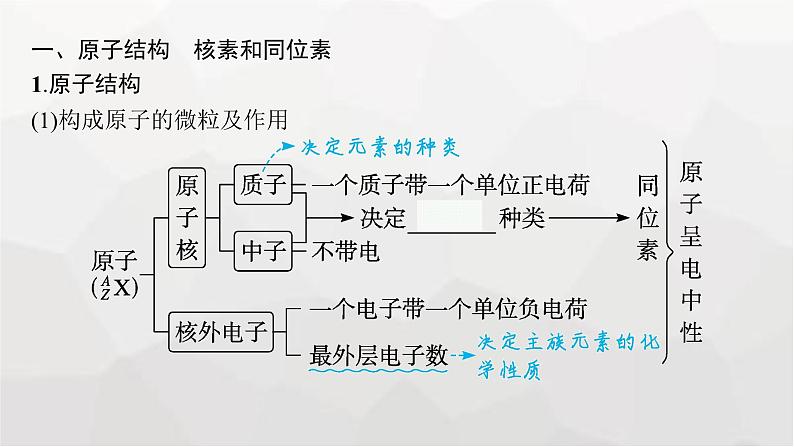
一、原子结构 核素和同位素1.原子结构(1)构成原子的微粒及作用
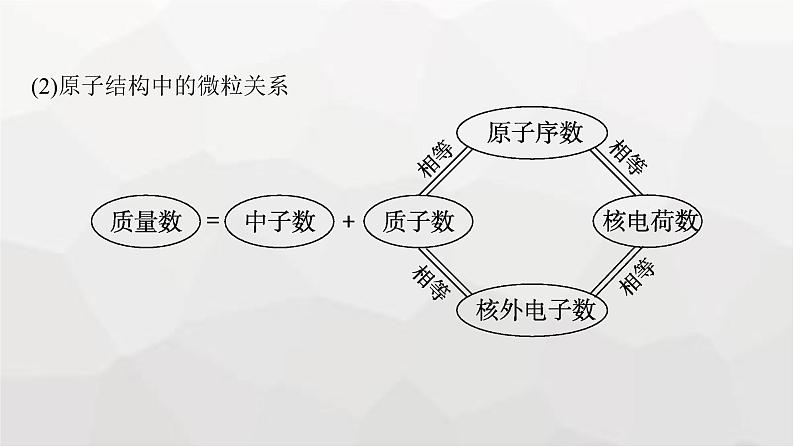
(2)原子结构中的微粒关系
微点拨(1)对于阳离子:核外电子数=质子数-阳离子所带的电荷数;(2)对于阴离子:核外电子数=质子数+阴离子所带的电荷数。(3)微粒符号周围数字的含义:
2.元素、核素和同位素(1)元素、核素和同位素的关系
(2)同位素的特征①同一元素的各种核素的 中子数 不同, 质子数 相同,化学性质几乎完全相同,物理性质差异较大。 ②同一元素的各种稳定核素在自然界中所占的原子百分数(丰度)不变。(3)氢元素的三种核素
(4)四种重要核素的用途
应用提升 关于同位素的“易错点”
不同核素之间的转化属于核反应,原子核发生了变化,该过程不属于化学反应。
易错辨析 判断正误:正确的画“√”,错误的画“×”。(1)所有原子的原子核都由质子和中子构成,所有离子的核外都含有电子。( × )(2)35Cl和37Cl是两种不同的核素,其化学性质几乎完全相同。( √ )(3)H+、D、T2是氢元素的三种不同粒子,三者互为同位素。( × )
二、原子核外电子排布1.能层和能级、电子云和原子轨道(1)能层(用n表示能层序数)核外电子按能量不同分成能层,电子的能层由内向外排序,通常用K、L、M、N……表示,能量依次升高。每层最多容纳电子数为 2n2 ,最外层电子不超过 8 个(K层为最外层时不超过2个),次外层不超过 18 个。 (2)能级同一能层里的电子按能量不同将其分成不同的能级,通常用 s、p、d、f 等表示;同一能层里,各能级的能量按 s、p、 d、f 的顺序依次升高。
(3)电子云①电子云是处于一定空间运动状态的电子在原子核外空间的 概率密度 分布的形象化描述。 ②同一原子的能层越高,s电子云半径 越大 ,是由于电子的能量依次 增高 ,电子在离核更远的区域出现的概率逐渐 增大 ,电子云越来越向更大空间扩展。
(4)原子轨道 空间运动状态种类=原子轨道数目量子力学把电子在原子核外的一个空间运动状态称为一个原子轨道,即电子在核外经常出现的区域,其中电子云轮廓图就是这种区域的描述,故这种电子云轮廓图就是 原子轨道 形象化的描述。
微点拨 原子轨道与能层、能级的关系解读(1)第一能层(K层)只有s能级,有1个原子轨道;第二能层(L层)有s、p两种能级,有4个原子轨道;第三能层(M层)有s、p、d三种能级,共有9个原子轨道。(2)同一能级的不同原子轨道具有相同的能量(如2px、2py、2pz的能量相同)。(3)不同能层的形状相同的原子轨道具有的能量随能层序数(n)增大而升高,如能量:1sE(5p)、E(4f)>E(6s)等,即E(ns)H(W),A项说法错误;W(H)与X(N)可以形成NH3、N2H4等多种化合物,B项说法错误;Y(Al)的氧化物Al2O3是两性氧化物,能与强碱反应,C项说法错误;W(H)、X(N)、Z(S)可以形成既含有离子键又含有共价键的化合物如(NH4)2S、NH4HS,D项说法正确。
针对训练1.W、X、Y、Z均为短周期元素,原子序数依次增加,W原子的最外层电子数是次外层的3倍,X-、Y+具有相同的电子层结构,Z的阴离子不能发生水解反应。下列说法不正确的是( )A.简单离子半径:Z>W>X>YB.简单氢化物的沸点:W>X>ZC.最高价氧化物对应的水化物的酸性:X>ZD.Z元素不同核素的基态原子核外电子排布式、基态原子轨道表示式均相同
答案 C解析 短周期元素W原子的最外层电子数是次外层的3倍,则W是O元素;X-、Y+具有相同的电子层结构,且X、Y原子序数大于W(O),则X是F元素,Y是Na元素;Z的阴离子不能发生水解反应,则Z是Cl元素。简单离子半径:Cl->O2->F->Na+,A正确;H2O和HF都能形成分子间氢键,HCl分子间只存在范德华力,常温下H2O呈液态,HF呈气态,则沸点:H2O>HF>HCl,B正确;X是F元素,非金属性最强,不存在最高价氧化物对应水化物,C错误;Z是Cl,通常有35Cl、37Cl两种核素,其核外均有17个电子,基态原子的核外电子排布相同,D正确。
2.短周期主族元素A、B、C、D、E的原子序数依次增大。A原子的最外层电子数是内层电子数的2倍;B、D同主族且质子数之比为1∶2;元素C是地壳中含量最丰富的金属元素。下列说法不正确的是( )A.简单离子半径:D>E>B>CB.元素B与元素C形成的化合物可作耐火材料C.氢化物的沸点:B>AD.元素A与元素D的单质均存在多种同素异形体
答案 C解析 A原子的最外层电子数是内层电子数的2倍,则A为碳元素;B、D同主族且质子数之比为1∶2,则B为氧元素,D为硫元素;D、E原子序数依次增大且都为短周期主族元素,所以E为氯元素;元素C是地壳中含量最丰富的金属元素,则C为铝元素。电子层数越多,离子半径越大,电子层数相同,质子数越少,半径越大,所以简单离子半径:S2->Cl->O2->Al3+,A正确;氧化铝熔点高,可作耐火材料,B正确;碳元素氢化物种类繁多,沸点不一,不具有可比性,C错误;碳元素有金刚石、石墨等同素异形体,硫有S2、S6等同素异形体,D正确。
归纳总结根据短周期主族元素原子结构特征推断未知元素
考向2.基态原子核外电子排布的表示
典例突破(1)(2023全国乙卷,节选)基态Fe原子的价层电子排布式为 。 (2)(2023浙江卷,节选)基态N原子的价层电子排布式是 。 (3)(2023北京卷,节选)基态S原子的价层电子排布式是 。 (4)(2022全国甲卷,节选)基态F原子的价层电子轨道表示式为 。 (5)(2022全国乙卷,节选)卤素单质及其化合物在科研和工农业生产中有着广泛的应用。氟原子激发态的电子排布式有 (填字母,下同),其中能量较高的是 。 a.1s22s22p43s1 b.1s22s22p43d2 c.1s22s12p5 d.1s22s22p33p2(6)(2022山东卷,节选)基态Ni原子的价层电子排布式为 ,在元素周期表中的位置为 。
答案 (1)3d64s2 (2)2s22p3 (3)3s23p4(4) (5)ad d (6)3d84s2 第四周期、第Ⅷ族
针对训练1.写出下列基态原子或离子的①电子排布式;②价层电子轨道表示式;③电子占据的原子轨道数;④未成对电子数。(1)Cl:① , ② , ③ ,④ 。 (2)Fe2+:① , ② , ③ ,④ 。 (3)Cu:① , ② , ③ ,④ 。 (4)Se:① , ② , ③ ,④ 。 (5)Br-:① , ② , ③ ,④ 。
2.已知A原子的3p轨道上得到1个电子后不能再容纳外来电子;B原子的2p轨道上有1个电子的自旋方向与其他电子的自旋方向相反;C原子的第三电子层上有8个电子,第四电子层上只有1个电子。按要求书写下列图式。(1)A原子的结构示意图: ; (2)B原子的轨道表示式: ;(3)C原子的核外电子排布式: ; (4)A离子的电子式: 。
(3)1s22s22p63s23p64s1(或[Ar]4s1)
归纳总结原子核外电子排布的常见错误(1)在写基态原子的轨道表示式时,常出现以下错误:
(2)当出现d轨道时,虽然电子按ns、(n-1)d、np的顺序填充,但在书写电子排布式时,仍把(n-1)d放在ns前,如Fe的电子排布式:1s22s22p63s23p63d64s2,而失电子时,却先失4s轨道上的电子,如Fe3+的电子排布式:1s22s22p63s23p63d5。(3)注意比较原子核外电子排布式、简化电子排布式、价层电子排布式的区别与联系。如Cu的电子排布式为1s22s22p63s23p63d104s1,简化电子排布式为[Ar]3d104s1,价层电子排布式为3d104s1。
核外电子的运动状态及分层排布
考向1基态原子核外电子的运动状态例1.(1)基态F原子核外电子的运动状态有 种。 (2)对于基态Cr原子,下列叙述正确的是 (填字母)。 A.轨道处于半充满时体系总能量低,核外电子排布应为[Ar]3d54s1B.4s电子能量较高,总是在比3s电子离核更远的地方运动C.电负性比钾大,原子对键合电子的吸引力比钾大
思路指导描述原子核外电子运动状态的四个要素:①能层;②能级;③原子轨道;④自旋状态。 同一原子核外各个电子的运动状态均不相同。
解析 (1)基态F原子核外共有9个电子,则每个电子都有对应的轨道和自旋方向,所以核外电子的运动状态有9种。(2)基态原子满足能量最低原理,Cr有24个核外电子,轨道处于半充满时体系总能量低,核外电子排布应为[Ar]3d54s1,A正确;由于在一定条件下电子会发生跃迁,因此4s电子不一定总是在比3s电子离核更远的地方运动,B错误;电负性可表示原子对键合电子的吸引力,同周期(除0族)原子序数越大电负性越大,钾与铬位于同周期,铬原子序数大于钾,故铬电负性比钾大,铬原子对键合电子的吸引力比钾大,C正确。答案 (1)9 (2)AC
突破方法(1)判断核外电子的空间运动状态
(2)判断核外电子的运动状态原子核外不同电子的运动状态不同,故核外电子的运动状态种类数=核外电子总数。
针对训练1.已知某微粒的核外电子排布式是1s22s22p63s23p4,下列判断错误的是( )A.该元素在元素周期表中的位置是第三周期、第ⅣA族B.该元素最高正价是+6价,最低负价是-2价C.该微粒原子核外有16种运动状态不同的电子D.该微粒原子核外有5种能量不同的电子
答案 A解析 硫元素在第三周期、第ⅥA族,A错误;硫元素最高正价是+6价,最低负价是-2价,B正确;硫原子核外有16个电子,有16种运动状态不同的电子,C正确;该原子的电子占据5个不同电子能级,有5种能量不同的电子,D正确。
2.(1)基态钛原子的价层电子排布式为 ,其原子核外电子的空间运动状态有 种,共有 种运动状态不同的电子。 (2)基态Si原子价层电子的运动状态有 种,若其电子排布式为 违背了 。 (3)基态Cu原子核外电子的空间运动状态有 种。 (4)Fe3+比Fe2+的稳定性更 (填“强”或“弱”),从结构上分析原因是 。
答案 (1)3d24s2 12 22 (2)4 洪特规则 (3)15(4)强 Fe3+的价层电子排布式为3d5,处于“半充满”状态,故Fe3+比Fe2+更稳定
考向2基态原子核外电子的分层排布例2.(1)在KH2PO4的四种组成元素各自所能形成的简单离子中,核外电子排布相同的是 (填离子符号)。 (2)Al在元素周期表中的位置为 ;基态Zn的价层电子排布式为 。 (3)基态Sc原子的核外电子排布式为 。
解析 (1)四种组成元素形成的简单离子分别为K+、H+(或H-)、P3-、O2-,其中K+和P3-的核外电子排布相同,均与Ar原子相同。(2)Al的核外电子排布式为[Ne]3s23p1,故Al在元素周期表中处于第三周期、第ⅢA族。基态Zn核外电子排布式为[Ar]3d104s2,则其价层电子排布式为3d104s2。(3)钪原子核外有21个电子,基态Sc的核外电子排布式为1s22s22p63s23p63d14s2或[Ar]3d14s2。答案 (1)K+和P3-(2)第三周期、第ⅢA族 3d104s2(3)1s22s22p63s23p63d14s2(或[Ar]3d14s2)
针对训练3.(1)A元素基态原子的最外层有3个未成对电子,次外层有2个电子,其元素符号为 ;其价层电子轨道表示式为 。 (2)B元素的-1价离子和C元素的+1价离子的电子层结构都与氩相同,B的元素符号为 ,C离子的结构示意图为 。 (3)D元素的+3价离子的3d能级为半充满,D的元素符号为 ,其基态原子的电子排布式为 ,其原子结构示意图为 。 (4)E元素基态原子的M层全充满,N层只有一个电子,E的元素符号为 ,其基态原子的电子排布式为 。 (5)F元素的原子最外层电子排布式为nsnnpn+2,则n= ;原子中能量最高的是 电子,核外电子轨道表示式为 。
4.(1)以CuSO4、NaOH和抗坏血酸为原料,可制备Cu2O。基态Cu+核外电子排布式为 。 (2) 黄铜矿是主要的炼铜原料,CuFeS2是其中铜的主要存在形式,其中有关元素基态原子或离子的价层电子轨道表示式正确的 (填字母)。
答案 (1)[Ar]3d10(或1s22s22p63s23p63d10) (2)CD解析 (2)铁原子的价层电子排布式为3d64s2,则Fe2+是铁原子失去最外层2个电子形成的阳离子,3d轨道有一个成对电子,4s轨道为空轨道,A错误;铜原子价层电子排布式为3d104s1,轨道表示式不符合,B错误。
2.下列化学用语使用正确的是( )
3.下列说法正确的是( )A.(2023辽宁卷,节选)基态Ni原子价层电子排布式:3d10B.(2023海南卷,节选)Cu基态原子核外电子排布符合构造原理C.(2023北京卷,节选)2pz电子云图为D.(2023北京卷,节选)基态24Cr原子的价层电子轨道表示式为
相关课件
这是一份2025版高考化学一轮总复习第5章物质结构与性质元素周期律第16讲原子结构原子核外电子排布课件,共60页。PPT课件主要包含了质子数核电荷数,最外层电子数,质子数和中子数,“四量”比较,126C原子质量,质子数,中子数,核反应方程示例,=14+0,=7-1等内容,欢迎下载使用。
这是一份备战2025届新高考化学一轮总复习第5章物质结构与性质元素周期律第23讲原子结构原子核外电子排布课件,共43页。PPT课件主要包含了课标指引,目录索引,素养发展进阶,必备知识•梳理,中子数质子数,同位素,质子数,中子数,几乎完全相同,差异较大等内容,欢迎下载使用。
这是一份2024届高考一轮复习 第五章 物质结构与性质 元素周期律 第1讲 原子结构 核外电子排布课件PPT,共60页。PPT课件主要包含了微粒符号及其意义,同位素的两大特征,几乎完全相同,氢元素的三种核素,答案B,构造原理,表示方法,答案A,答案C等内容,欢迎下载使用。








