




甘肃省武威市天祝一中、民勤一中2023-2024学年高一下学期5月期中联考化学试题(学生版+教师版)
展开全卷满分100分,考试时间75分钟
注意事项:
1.答题前,先将自己的姓名、准考证号填写在试卷和答题卡上,并将条形码粘贴在答题卡上的指定位置。
2.请按题号顺序在答题卡上各题目的答题区域内作答,写在试卷、草稿纸和答题卡上的非答题区域均无效。
3.选择题用2B铅笔在答题卡上把所选答案的标号涂黑;非选择题用黑色签字笔在答题卡上作答;字体工整,笔迹清楚。
4.考试结束后,请将试卷和答题卡一并上交。
5.本卷主要考查内容:必修第二册第五章~第六章。
可能用到的相对原子质量:H-1 C-12 N-14 O-16 Mg-24 S-32 Cu-64 Ba-137
一、选择题:本题共14小题,每小题3分,共42分。在每小题给出的四个选项中,只有一项是符合题目要求的。
1. 化学与生活密切相关。下列说法正确的是
A. 太阳能电池的主要材料是高纯度的二氧化硅
B. 二氧化硫是一种有毒气体,不能用作食品添加剂
C. 液氨汽化时放出大量热,故液氨可用作制冷剂
D. 次氯酸钠具有强氧化性,能够起到消毒、杀菌的作用
【答案】D
【解析】
【详解】A.单晶硅能将太阳能转化为电能,则太阳能电池的主要材料是高纯度的单质硅,A错误;
B.为防止红酒中维生素被氧化,并防止细菌滋生,通常往红酒中添加少量二氧化硫,用于红酒的抗氧化和除菌,B错误;
C.液氨汽化时,会吸收大量的热,故液氨可用作制冷剂,C错误;
D.次氯酸钠具有强氧化性,能使蛋白质变性,所以能够起到消毒、杀菌的作用,D正确;
故选D。
2. 下列反应不属于氨的固定的是
A. 雷电时,空气中和生成B. 和在一定条件下生成
C. 豆科植物的根瘤菌将氮气转变成硝酸盐D. 被氧气氧化为
【答案】D
【解析】
【详解】A.雷电时,空气中和生成NO,氮元素由游离态转化为化合态,属于氮的固定,A不符合题意;
B.和在一定条件下生成,氮元素由游离态转化为化合态,属于氮的固定,B不符合题意;
C.豆科植物的根瘤菌将氨气转变成硝酸盐,氮元素由游离态转化为新的化合态,属于氮的固定,C不符合题意;
D.被氧气氧化为,氮元素由化合态转化为新的化合态,不属于氮的固定,D符合题意;
故选D。
3. 硫元素的单质及其化合物在人类生产和生活中发挥着重要的作用。下列说法正确的是
A. 硫在加热的条件下与反应生成Fe2S3
B. SO2能使酸性KMnO4溶液褪色,证明了SO2具有漂白性
C. 常温下,硫化氢是一种有毒、有害的气体,吸入硫化氢可能对呼吸系统产生严重危害
D. 硫酸型酸雨在空气中放置一段时间pH变大
【答案】C
【解析】
【详解】A.硫在加热的条件下与Fe反应生成FeS,A错误;
B.SO2能使酸性KMnO4溶液褪色,是因为二氧化硫具有还原性,B错误;
C.硫化氢是一种有毒气体,会污染大气,人体吸入的硫化氢会严重危害人体的呼吸系统,C正确;
D.硫酸型酸雨产生的历程是SO2和H2O反应生成H2SO3,一段时间后H2SO3被空气中氧气氧化为H2SO4,pH变小,D错误;
故选C。
4. 对于可逆反应,在不同条件下的化学反应速率如下,其中表示的反应速率最快的是
A. B.
C. D.
【答案】A
【解析】
【分析】同一反应在相同条件下,不同物质表示的反应速率可能不同,所以,比较同一反应在不同条件下反应速率快慢时,应将速率转化为同一种物质。
【详解】A.=;
B.,则;
C.,则;
D.,则;
比较以上数据,A选项中NH3表示的反应速率最大,故选A。
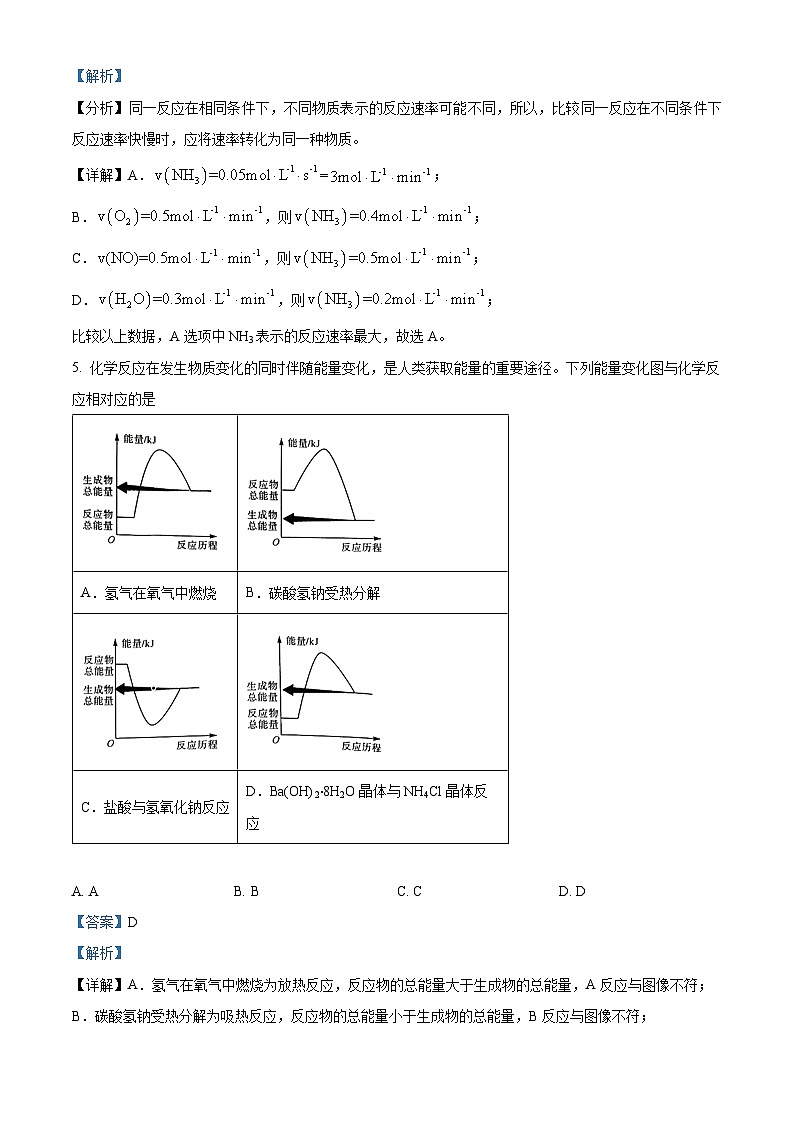
5. 化学反应在发生物质变化的同时伴随能量变化,是人类获取能量的重要途径。下列能量变化图与化学反应相对应的是
A. AB. BC. CD. D
【答案】D
【解析】
【详解】A.氢气在氧气中燃烧为放热反应,反应物的总能量大于生成物的总能量,A反应与图像不符;
B.碳酸氢钠受热分解为吸热反应,反应物的总能量小于生成物的总能量,B反应与图像不符;
C.氢氧化钠与盐酸的反应为放热反应,但是断裂化学键需要吸收能量,形成化学键需要放出能量,C反应与图像不符;
D.Ba(OH)2∙8H2O晶体与NH4Cl晶体的反应为吸热反应,反应物的总能量小于生成物的总能量,D反应与图像相符;
故选D。
6. “九秋风露越窑开,夺得千峰翠色来”是赞誉越窑秘色青瓷的诗句,描绘我国古代精美的青瓷工艺品。下列说法正确的是
A. 陶瓷是人类最早使用的硅酸盐制品
B. 水晶、玛瑙和石英砂的主要成分均为硅酸盐
C. 实验室可以用带玻璃塞的细口瓶盛放溶液
D. 富勒烯、碳纳米管、石墨烯均属于传统无机非金属材料
【答案】A
【解析】
【详解】A.陶瓷是人类最早使用的硅酸盐制品,A正确;
B.水晶、玛瑙和石英砂的主要成分均为二氧化硅,B错误;
C.玻璃中含有二氧化硅,二氧化硅可以和发生反应生成具有黏性的,能够将玻璃塞与玻璃瓶粘到一起,C错误;
D.富勒烯、碳纳米管、石墨烯均属于新型无机非金属材料,D错误;
本题选A。
7. 某兴趣小组想利用原电池的原理判断a、b、c、d四种金属的活动性顺序,具体实验如下:
①将金属a、b用导线连接浸入盛有稀硫酸的烧杯中,电流从b流向a;
②将金属c、b用导线连接浸入CuSO4溶液中,发现c极质量增加;
③将金属a、d用导线连接浸入稀硫酸中,金属d不断溶解。
则四种金属的活动性顺序由强到弱的顺序为
A. B. C. D.
【答案】B
【解析】
【详解】①将金属a和b相连浸入稀硫酸中,电流从b到a,即a为负极,所以金属活动性:a>b;
②将金属b和c相连浸入硫酸铜溶液中,c电极质量增加,则Cu2+在c上得电子转化为铜,则c为正极,所以金属活动性b>c;
③将金属a和d相连浸入稀硫酸中,d不断溶解,则d为负极,所以金属活动性:d>a。
综上所述,四种金属的活动性由强到弱的顺序:d>a>b>c,故选B。
8. 在一定温度下,密闭容器中发生反应:。下列说法正确的是
A. 其他条件不变时,向反应体系中增加碳的量可增大化学反应速率
B. 达到平衡状态时,可全部转化为和
C. 当外界条件发生改变时,原有的平衡状态可能被破坏
D. 单位时间内生成的同时生成,说明该反应已达到平衡状态
【答案】C
【解析】
【详解】A.碳为固体,反应体系中增加碳的量不影响化学反应速率,A错误;
A.该反应为可逆反应,反应物不可能完全转化为生成物,故达到平衡状态时,不可能全部转化为和,B错误;
A.化学平衡状态为一定条件下的动态平衡,当外界条件发生改变时,原有的平衡状态可能被破坏,然后重新达到新的平衡状态,C正确;
A.单位时间内生成的同时生成,反应均向正反应方向进行,无法判断是否达到平衡状态,D错误;
故选C。
9. 工业制备高纯硅的原理示意图如下:
下列说法错误的是
A. 硅在自然界中主要以氧化物和硅酸盐形式存在
B. 反应①为
C. 二氧化硅是酸性氧化物,但不能与水反应生成硅酸
D. 上述流程中能循环利用的物质有
【答案】B
【解析】
【详解】A.硅为亲氧元素,硅在自然界中主要以氧化物和硅酸盐形式存在,A正确;
B.根据原理图,反应①为,B错误;
C.二氧化硅是酸性氧化物,难溶于水,与水不反应,C正确;
D.反应②③方程式分别为:Si+3HClSiHCl3+H2、SiHCl3+H2Si+3HCl,流程②、③中分别会有生成,所以整个流程中能循环利用物质有和,D正确。
答案选B。
10. 下列有关离子方程式的书写正确的是
A. 向硫酸氢铵溶液中加入少量的氢氧化钠溶液并加热:
B. 向碘化亚铁溶液中滴加少量稀硝酸:
C. 向氯水中通入足量气体:
D. 片与稀硝酸反应:
【答案】C
【解析】
【详解】A.向硫酸氢铵溶液中加入少量的氢氧化钠溶液并加热,先与一发生反应,正确的离子方程式为,A错误;
A.还原性:,向碘化亚铁溶液中滴加少量稀硝酸,正确的离子方程式为,B错误;
A.向氯水中通入足量气体,SO2表现还原性,被氯水氧化为硫酸,发生反应的离子方程式:,C正确;
A.与稀硝酸反应的离子方程式中得失电子、电荷都不守恒,正确的离子方程式为,D错误;
故选C。
11. 室温下进行下列实验,根据实验操作和现象所得到的结论正确的是
A. AB. BC. CD. D
【答案】D
【解析】
【详解】A.向溶液中通入,溶液变为浅绿色,则证明被还原为,SO2为还原剂,为还原产物,故还原性:,故A错误;
B.要检验,滴入氢氧化钠溶液后必须加热,若试管口处湿润的红色石蕊试纸变蓝,则说明原溶液中含,故B错误;
C.将含有的废气通入溶液中,和溶液不反应,故C错误;
D.向蔗糖中滴加浓硫酸,蔗糖被浓硫酸脱水生成碳,碳被浓硫酸氧化,观察到蔗糖变黑,并放出刺激性气味的气体,可证明浓硫酸具有脱水性和强氧化性,故D正确;
故选D。
12. 碱性电池具有容量大、放电电流大的特点,因而得到广泛应用。碱性锌锰电池与锌锰干电池在反应过程中锌均会被逐渐消耗,反应不会逆向进行。以氢氧化钾溶液为电解质溶液的碱性锌锰电池,电池总反应式为。下列说法正确的是
A. 电池工作时,锌得到电子,被还原
B. 电池工作时,电子由正极通过外电路流向负极
C. 电池正极的电极反应式为
D. 碱性锌锰电池为二次电池
【答案】C
【解析】
【详解】A.电池工作时,锌失去电子发生氧化反应为负极,A项错误;
B.电池工作时,电子由负极通过外电路流向正极, B项错误;
C.电池正极的电极反应为二氧化锰得到电子发生还原反应生成,, C项正确;
D.碱性锌锰电池与锌锰干电池在反应过程中锌均会被逐渐消耗,反应不会逆向进行,故不是二次电池,D项错误;
故选C。
13. 为了研究外界条件对H2O2分解反应速率的影响,某同学在4支试管中分别加入3mL H2O2溶液,并测量收集VmL气体时所需的时间,实验记录如下:
下列有关说法正确的是
A. 实验①、②可研究温度对化学反应速率的影响
B. 获得相同体积O2所需要的时间:
C. 获得相同体积O2所需要的时间:
D. 实验②、④可研究催化剂对化学反应速率的影响
【答案】A
【解析】
【详解】A.实验①、②中只有温度不同,可研究温度对化学反应速率的影响,A正确;
B.实验①、③中H2O2的浓度不同,浓度越大化学反应速率越快,③中过氧化氢的浓度大,化学反应速率快,则获得相同体积氧气所需的时间,B错误;
C.比较实验③、④可知,③中过氧化氢的浓度大,且使用催化剂,故反应速率快,所需时间短,即,C错误;
D.实验②、④中反应温度、是否使用催化剂均不相同,存在两个变量,不能研究催化剂对化学反应速率的影响,D错误;
故选A。
14. 在一定量的稀硝酸中,加入一定量的镁和铜组成的混合物,充分反应后金属完全溶解(假设还原产物只有),向反应后溶液中加入溶液至沉淀完全,测得生成沉淀质量比原金属质量增加,则下列叙述正确的是
A. 当金属全部溶解时,收集到标准状况下
B. 当生成沉淀的量最多时,消耗溶液体积一定为
C. 反应过程中消耗硝酸的物质的量为
D. 参加反应的金属总质量可能为
【答案】C
【解析】
【分析】由题意可知,向稀硝酸与镁、铜混合物反应后的溶液中加入氢氧化钠溶液至沉淀完全,沉淀为氢氧化镁和氢氧化铜的混合物,生成沉淀质量比原金属质量增加,则氢氧根离子的物质的量为,由原子个数守恒可知,镁和铜的物质的量之和为,由得失电子数目守恒可知,反应生成一氧化氮的物质的量为,则稀硝酸与镁、铜混合物反应消耗硝酸的物质的量为。
【详解】A.由分析得,当金属全部溶解时,收集到标准状况下的体积为,故A错误;
B.向稀硝酸与镁、铜混合物反应后溶液中加入氢氧化钠溶液至生成沉淀的量最多时,所得溶液为硝酸钠溶液,由分析可知,若稀硝酸溶液与镁、铜混合物完全反应,反应消耗氢氧化钠溶液的体积为,若稀硝酸溶液过量,反应消耗氢氧化钠溶液的体积大于,故B错误;
C.反应过程中消耗硝酸的物质的量为,故C正确;
D.镁和铜的物质的量之和为,若金属混合物都是镁,金属的质量为,若金属完全是铜,金属的质量为,则参加反应金属总质量为,故D错误;
故选C。
二、非选择题:本题共4小题,共58分。
15. 合成氨及其相关工业中,部分物质间的转化关系如图所示。回答下列问题:
(1)写出的电子式:___________,反应I的化学方程式为___________。
(2)写出反应Ⅳ的离子方程式:___________。
(3)反应Ⅵ产生的___________(填化学式)可以在流程V中被循环利用。
(4)硝酸是无色、易挥发、有刺激性气味的液体。浓硝酸一般将其保存在棕色试剂瓶中,并放置在阴凉处,说明浓硝酸具有___________性,用化学方程式表示该操作的原因:___________。
(5)乙是污染性气体,可以在催化剂加热条件下用来处理,生成对环境没有污染的产物,写出用处理乙的化学方程式:___________。
【答案】(1) ①. ②.
(2)
(3)(或和)
(4) ①. 不稳定 ②.
(5)
【解析】
【分析】由流程图可以得出,甲为N2;NH3催化氧化生成的乙为NO,NO与O2反应生成的丙为NO2,NO2与水反应生成HNO3和NO,HNO3与NH3反应生成NH4NO3。NH3先通入NaCl饱和溶液中,再通入CO2,制得的丁为NaHCO3,加热分解可制得纯碱Na2CO3。
【小问1详解】
为共价化合物,N、H原子间各形成1个共用电子对,电子式为,反应I中,N2与H2化合生成NH3,化学方程式为。
【小问2详解】
反应Ⅳ中,NO2与水反应生成HNO3和NO,离子方程式:。
【小问3详解】
反应Ⅵ中,NaHCO3加热分解可制得纯碱Na2CO3、CO2气体和水,产生的(或和)可以在流程V中被循环利用。
【小问4详解】
浓硝酸一般将其保存在棕色试剂瓶中,并放置在阴凉处,说明浓硝酸具有不稳定性,用化学方程式表示该操作的原因:。
【小问5详解】
乙为NO,在催化剂加热条件下用来处理,生成N2和H2O,化学方程式:。
【点睛】NO与CO在催化剂作用下反应,生成N2和CO2。
16. 根据原电池原理,回答下列问题:
(1)铜锌原电池的装置如图所示:
①铜作___________(填“正极”或“负极”),溶液中的向___________(填“铁”或“铜”)电极方向移动。
②负极的电极反应式为___________。
③若反应过程中有电子的转移,则生成标准状况下氢气的体积为___________。
(2)某兴趣小组为了探究铝电极在电池中的作用,设计并进行了以下实验,实验结果记录如下:
已知:实验均为常温下完成;电流计指针偏转方向为正极方向。
①实验3中,为___________极,电极反应式为___________。
②实验4中,为___________极,电池总反应的离子方程式是___________。
③根据实验结果总结出影响铝在电池中做正极或负极的因素有___________。
【答案】(1) ①. 正极 ②. 铁 ③. ④. 5.6
(2) ①. 负 ②. ③. 负 ④. ⑤. 金属的活动性和电解质溶液
【解析】
【小问1详解】
①该电池为原电池,活泼金属做负极,即铁为负极,则铜作正极,阳离子向正极移动,阴离子向负极移动,则向铁电极方向移动,故答案为:①正极;②铁;
②负极发生氧化反应,电极反应式:,故答案为;
③正极发生还原反应,电极反应式为:,则反应过程中有0.5ml电子的转移时,设生成氢气的质量为x,
,求得x=0.25ml,V=0.25ml×22.4L/ml=5.6L,则生成标准状况下氢气的体积为5.6L,故答案为5.6L。
【小问2详解】
①实验3中Al和稀盐酸反应,C和稀盐酸不反应,因此Al为负极;电极反应式为Al-3e-=Al3+;故答案为:①负;②Al-3e-=Al3+;
②根据上面总结出电流计指针偏向的极为正极,因此实验4中Mg为正极,Al作负极,Mg和NaOH溶液不反应,Al和NaOH溶液反应,因此Al为负极,电极反应式为:,故答案为:③负;④;
③根据实验结果总结出影响铝在电池中作正极或负极的因素,根据实验1、2、3得出主要因素是金属活泼性,实验4、5得出的因素是电解质溶液;故答案为:⑤金属活泼性和电解质溶液。
17. 化学反应速率和限度与生产、生活密切相关。请回答下列问题。
(1)在一定温度下,4L密闭容器内某一反应中气体M、气体N的物质的量随时间变化的曲线如图:
①比较时刻,正、逆反应速率大小_______(填“>”“=”或“<”)
②若,计算反应开始至时刻用M的浓度变化表示的平均反应速率为_______。
③如果升高温度,则_______(填“增大”“减小”或“不变”)
(2)在2L密闭容器内,800℃时仅发生反应,体系中开始仅含有NO和,随时间的变化如下表所示:
①3s时,生成的物质的量为_______ml,在第5s时,NO的转化率为_______。
②如图中表示变化曲线的是_______(填字母)。
③下列能说明该反应已达到平衡状态的是_______(填字母)。
a.每消耗1ml,生成2ml的
b.各物质组分的物质的浓度不再改变
c.混合气体的平均相对分子质量不变
d.容器内密度保持不变
【答案】(1) ①. > ②. ③. 增大
(2) ①. 0.013 ②. 65% ③. b ④. bc
【解析】
【小问1详解】
①由图可知:时刻,反应物N的物质的量还在减少,生成物M的物质的量还在增加,处于从正反应建立平衡的途中,则正、逆反应速率大小>。
②若,反应开始至时刻用M的浓度变化表示的平均反应速率为。
③升温增大反应速率,如果升高温度,则增大。
【小问2详解】
在2L密闭容器内,800℃时仅发生反应,则:
①由表知,从开始到3s时,NO减少0.020ml -0.007ml= 0.013ml,则生成的物质的量为0.013ml,由表知,到3s时已处于化学平衡状态,则到5s时NO减少0.020ml -0.007ml= 0.013ml, NO的转化率为。
②从开始到5s平衡时,NO减少0.020ml -0.007ml= 0.013ml,NO2从0增加到0.013ml,则平衡时NO2的浓度为0.0065ml/L,图中表示变化曲线的是b。
③a.每消耗1ml,生成2ml的,都表示正反应,因此不能说明该反应已平衡,说法错误;
b.各物质组分的物质的浓度不再改变符合化学平衡状态的特征,能说明已平衡,说法正确;
c.密闭容器中混合气体的物质的量、平均摩尔质量、平均相对分子质量随反应而变,故平均相对分子质量不变,能说明已平衡,说法正确;
d.气体质量、容积体积始终不变,故气体密度始终不变,故气体密度不变不能说明已平衡,说法错误;
选bc。
18. 利用石灰石和烟气中的反应生成石膏,可实现烟气中脱除。某研究性学习小组在实验室利用如图所示装置制备烟气(主要成分为、、、),并测定烟气中的体积分数以及研究烟气通过转化器的脱硫效率(忽略在C、D中的溶解度)。回答下列问题:
I.模拟烟气的制备。
(1)写出装置A中发生反应的化学方程式:___________。
II.测定烟气中体积分数。
(2)将装置A中产生的气体与空气一起通过装置B混合均匀,从而形成模拟烟气。模拟烟气通过装置C时,装置C中发生反应的离子方程式为___________。
(3)装置D中盛放的药品是___________,其作用是___________。
(4)①甲同学认为应该在装置___________(填字母)之间增加一个盛有品红溶液的洗气瓶,目的是___________。
②乙同学根据模拟烟气的流速和5min后测得的量筒内液体增加的体积15mL,计算烟气中二氧化硫的体积分数是___________。
III.模拟烟气通过转化器的脱硫效率研究。
(5)E中溶液可以催化与反应生成,以达到脱硫的目的。丙同学根据模拟烟气的流速,后测得的量筒内液体增加的体积为VmL,若模拟烟气仍以的流速通过转化器E装置,后,向E装置中加入酸化的溶液,得到白色浑浊液,经过滤、洗涤、干燥、称量,得到mg固体。若实验测得的气体体积已折算为标准状况下的体积,则该转化器的脱硫效率是___________()。
【答案】(1)
(2)
(3) ①. 饱和溶液 ②. 测量模拟烟气中除去后剩余气体的体积
(4) ①. CD ②. 检验是否完全被除尽 ③.
(5)
【解析】
【分析】装置A中用木炭和浓硫酸反应,反应的方程式为:,生成的气体含有,在装置B中通入空气,所得气体主要成分为:、、、,再通过酸性高锰酸钾溶液,除去气体,用排液法测量所剩气体的体积,可以求出混合气体中的体积分数。
【小问1详解】
装置A中用木炭和浓硫酸反应,反应的方程式为:;
【小问2详解】
装置C为酸性高锰酸钾溶液用于除去,发生反应的离子方程式为:;
【小问3详解】
排液法测量所剩气体的体积,装置D中盛放的药品是:饱和溶液;
【小问4详解】
应该在装置C、D之间增加一个盛有品红溶液的洗气瓶,目的是:检验是否完全被除尽;模拟烟气的流速,5min后通入的气体为:,剩余气体为,,;
【小问5详解】
根据实验分析,最终得到mg固体为,根据硫元素守恒,,则该转化器中脱硫效率为: 。A.氢气在氧气中燃烧
B.碳酸氢钠受热分解
C.盐酸与氢氧化钠反应
D.Ba(OH)2∙8H2O晶体与NH4Cl晶体反应
选项
实验操作和现象
结论
A
向溶液中通入,溶液变为浅绿色
还原性:
B
向盛有某盐溶液的试管中滴入氢氧化钠溶液后,试管口处湿润的红色石蕊试纸未变蓝
该盐中一定不含
C
将含有的废气(含有少量氨气)通入溶液中,出现白色沉淀
与溶液反应生成沉淀
D
向蔗糖中加入浓硫酸,搅拌得黑色海绵状固体,并放出刺激性气味的气体
浓硫酸体现脱水性和强氧化性
实验序号
H2O2溶液浓度
H2O2溶液温度
催化剂
所用时间
①
2滴
②
2滴
③
2滴
④
/
编号
电极材料
电解质溶液
电流计指针偏转方向
1
稀盐酸
偏向
2
稀盐酸
偏向
3
(石墨)
稀盐酸
偏向石墨
4
溶液
偏向
5
浓硝酸
偏向
时间/s
0
1
2
3
4
/ml
0.020
0.010
0.008
0.007
0.007
18,甘肃省武威市天祝一中、民勤一中联考2023-2024学年高一下学期3月月考化学试题: 这是一份18,甘肃省武威市天祝一中、民勤一中联考2023-2024学年高一下学期3月月考化学试题,共17页。试卷主要包含了本卷主要考查内容, 设为阿伏加德罗常数值, 下列装置不能形成原电池的是等内容,欢迎下载使用。
甘肃省武威市天祝一中、民勤一中2023-2024学年高一下学期5月期中联考化学试题: 这是一份甘肃省武威市天祝一中、民勤一中2023-2024学年高一下学期5月期中联考化学试题,共12页。试卷主要包含了本卷主要考查内容,工业制备高纯硅的原理示意图如下等内容,欢迎下载使用。
甘肃省武威市天祝一中、民勤一中、古浪一中等四校联考2023-2024学年高一上学期11月期中考试化学试题: 这是一份甘肃省武威市天祝一中、民勤一中、古浪一中等四校联考2023-2024学年高一上学期11月期中考试化学试题,共9页。试卷主要包含了本卷主要考查内容等内容,欢迎下载使用。












