




2024年山东省济宁市金乡县中考三模化学试题(学生版+教师版)
展开注意事项:
1.本试卷分第I卷(选择题)和第II卷(非选择题)两部分,共6页。
2.答题前,考生务必将自己的学校、班级、姓名、考场、考号等填写在试卷相应位置。
可能用到的相对原子质量::H-1 C-12 N-14 O-16 Na-23 Zn-65 Cu-64 Ag-108 Fe-56 K-39
第I卷 (选择题共16分)
一、选择题(本大题包括10小题,每小题只有一个正确选项。其中1-4小题,每小题1分,5-10小题,每小题2分,共16分)
1. 重庆火锅备受追捧。下列火锅底料的制作过程中一定涉及化学变化的是
A. 刀切原料B. 清水洗涤C. 大火熬制D. 成品装袋
【答案】C
【解析】
【详解】A、刀切原料过程中只是物质的形状发生改变,并没有新物质生成,属于物理变化,该选项不符合题意;
B、清水洗涤过程中没有新物质生成,属于物理变化,该选项不符合题意;
C、大火熬制过程中有新物质生成,属于化学变化,该选项符合题意;
D、成品装袋过程中没有新物质生成,属于物理变化,该选项不符合题意。
故选C。
2. 下列物质的用途利用其物理性质的是( )
A. 生石灰用作干燥剂
B. 铁粉用作食品保鲜吸氧剂
C. 铜用于制作导线
D. 液氧用作火箭助燃剂
【答案】C
【解析】
【详解】A、生石灰用作干燥剂是利用生石灰的化学性质,故选项错误;
B、铁粉用作食品保鲜吸氧剂是利用铁易生锈,属于化学性质,故选项错误;
C、铜用于制作导线是利用铜的导电性,属于物理性质,故选项正确;
D、液氧用作火箭助燃剂是利用液氧的助燃性,属于化学性质,故选项错误。
故选C。
3. 下列有关实验操作“先”与“后”的说法中正确的是
A. 测定溶液的 pH,先将试纸用水湿润,后用干净的玻璃棒蘸取待测液点在试纸上
B. 稀释浓硫酸时,先将浓硫酸取好,后将水沿玻璃棒慢慢注入浓硫酸中,并不断搅拌
C. 一氧化碳还原氧化铁时,先加热氧化铁粉末至红热,后通入一氧化碳
D. 实验室制取气体时,先检查装置的气密性,后加入药品进行反应。
【答案】D
【解析】
【详解】A、用pH试纸测定未知溶液的pH时,正确的操作方法为用玻璃棒蘸取少量待测液滴在干燥的pH试纸上,与标准比色卡对比来确定pH,不能用水湿润pH试纸,否则稀释了待测溶液,使溶液的酸碱性减弱,测定结果不准确,故A错误;
B、稀释浓硫酸时,要把浓硫酸缓缓地沿器壁注入水中,同时用玻璃棒不断搅拌,以使热量及时地扩散;一定不能把水注入浓硫酸中,故B错误;
C、一氧化碳还原氧化铁时,先通入一氧化碳,再加热氧化铁粉末至红热,以防止发生爆炸,故C错误;
D、实验室制取气体时,组装好装置后,应在向容器中装入药品前检查装置气密性,然后再装入药品,以避免装入药品后发现装置气密性不好,更换部分仪器而浪费药品,故D正确。
故选D。
【点睛】浓硫酸稀释操作可简记为:酸入水,缓慢倒,并搅拌。
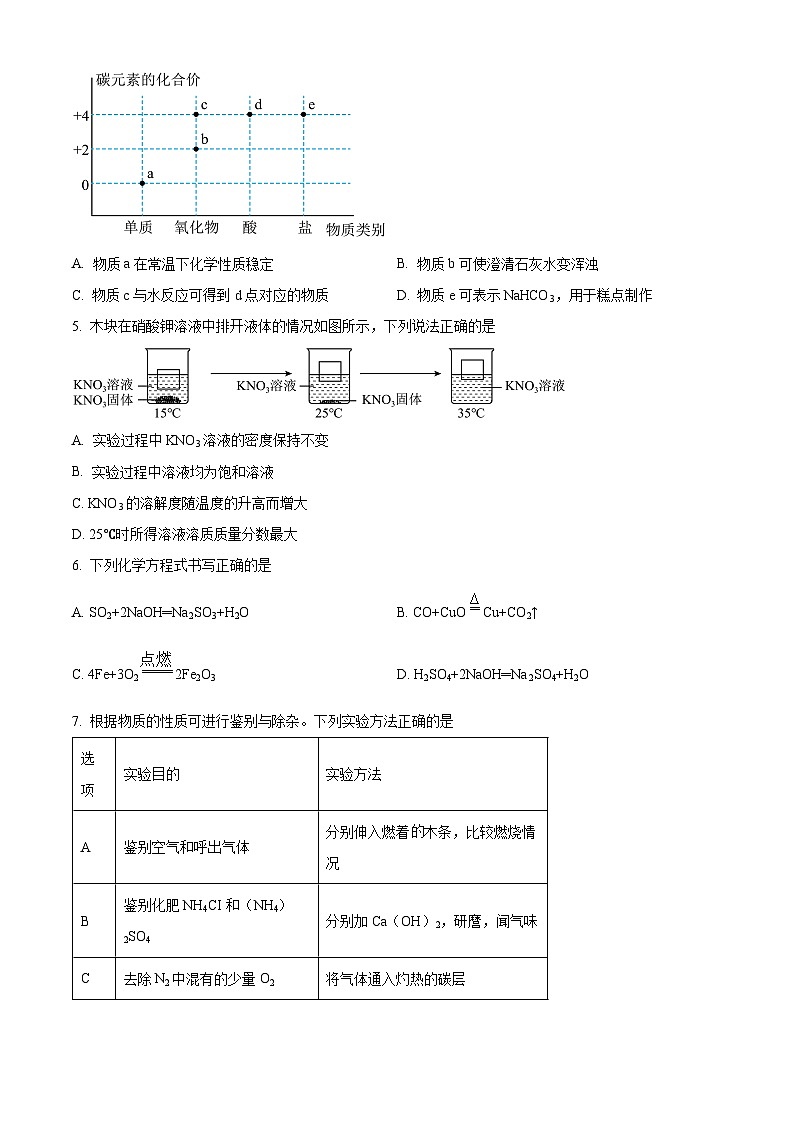
4. 元素化合价和物质类别是研究物质的两个重要维度。如图是碳元素的部分“价类二维图”,下列有关说法错误的是
A. 物质a在常温下化学性质稳定B. 物质b可使澄清石灰水变浑浊
C. 物质c与水反应可得到d点对应的物质D. 物质e可表示NaHCO3,用于糕点制作
【答案】B
【解析】
【详解】A、a点对应的物质是由碳元素组成的单质,在常温下化学性质稳定,故选项说法正确;
B、b点对应的物质是一氧化碳,不能使澄清石灰水变浑浊,故选项说法错误;
C、c点对应的物质是二氧化碳,d点对应的物质是碳酸,二氧化碳与水反应生成碳酸,故选项说法正确;
D、e点对应的物质可为NaHCO3,能用于糕点制作,故选项说法正确;
故选:B。
5. 木块在硝酸钾溶液中排开液体的情况如图所示,下列说法正确的是
A. 实验过程中KNO3溶液的密度保持不变
B. 实验过程中溶液均为饱和溶液
C. KNO3的溶解度随温度的升高而增大
D. 25℃时所得溶液溶质质量分数最大
【答案】C
【解析】
【详解】A、实验过程中溶质质量增加,溶剂质量不变,且由图可知,木块在三种烧杯种的排开液体不同,则说明实验过程中KNO3溶液的密度增大,该选项说法错误;
B、由图可知,35℃时烧杯中没有未溶解的固体,可能是恰好饱和的溶液,也可能是不饱和溶液,该选项说法错误;
C、实验过程中温度升高,等质量的溶剂中溶解的硝酸钾的质量增加,则KNO3的溶解度随温度的升高而增大,该选项说法正确;
D、实验过程中溶剂质量不变,35℃时溶质的质量最多,则35℃时所得溶液溶质质量分数最大,该选项说法错误。
故选C。
6. 下列化学方程式书写正确的是
A. SO2+2NaOH═Na2SO3+H2OB. CO+CuOCu+CO2↑
C. 4Fe+3O22Fe2O3D. H2SO4+2NaOH═Na2SO4+H2O
【答案】A
【解析】
【详解】A、该化学方程式书写完全正确,故选项正确;
B、一氧化碳和氧化铜在加热的条件下生成铜和二氧化碳,正确的化学方程式应为:CO+CuOCu+CO2,故选项错误;
C、铁在氧气中燃烧生成四氧化三铁,正确的化学方程式应为:3Fe+2O2Fe3O4,故选项错误;
D、氢氧化钠和硫酸反应生成硫酸钠和水,正确的化学方程式应为:H2SO4+2NaOH═Na2SO4+2H2O,故选项错误。
故选A。
7. 根据物质的性质可进行鉴别与除杂。下列实验方法正确的是
A. AB. BC. CD. D
【答案】A
【解析】
【详解】A、分别伸入燃着的木条,燃着的木条在空气中继续燃烧,呼出气体能使燃着的木条熄灭,现象不同,可以区分,故选项实验方法正确;
B、氯化铵和硫酸铵均属于铵态氮肥,与氢氧化钙混合研磨,均能发生反应,生成有刺激性气味的气体,现象相同,不能鉴别,故选项实验方法错误;
C、将气体通入灼热的碳层,氮气和碳不反应,氧气和碳反应生成二氧化碳气体,虽然除去了杂质,但是引入了新的杂质二氧化碳气体,不符合除杂原则,故选项实验方法错误;
D、粗盐的主要成分是氯化钠,氯化钠易溶于水,加水溶解、过滤、洗涤、干燥可得难溶性杂质,应再对滤液蒸发结晶分离出氯化钠,故选项实验方法错误;
故选:A。
8. 甲、乙、丙三种物质的转化关系如图所示(“→”表示反应能一步实现,部分物质和反应条件已略去),则下列物质中不符合转化关系的是
A. C、CO2、CO
B. CuO、CuSO4、Cu(OH)2
C. NaOH、NaCl、NaNO3
D. H2O2、H2O、H2
【答案】C
【解析】
【详解】A、碳充分燃烧生成二氧化碳,二氧化碳和碳高温下反应生成一氧化碳,一氧化碳和氧气点燃生成二氧化碳,故选项A符合转化关系;
B、氧化铜和硫酸反应生成硫酸铜和水,硫酸铜和氢氧化钠反应生成氢氧化铜沉淀和硫酸钠,氢氧化铜和硫酸反应生成硫酸铜和水,故选项B符合转化关系;
C、氢氧化钠和盐酸反应生成氯化钠和水,氯化钠和硝酸银反应生成氯化银沉淀和硝酸钠,但是硝酸钠不能转化为氯化钠,故选项C不符合转化关系;
D、过氧化氢在二氧化锰的催化下分解生成氧气和水,水通电分解生成氢气和氧气,氢气和氧气点燃生成水,故选项D符合转化关系;
故选:C。
9. 向含有硝酸银和硝酸铜的废液中加入—定质量的锌粉,充分反应后过滤,将滤渣洗涤、干燥、称量,所得滤渣的质量与加入锌粉的质量相等。下列说法不正确的是
A. 滤液可能呈蓝色B. 滤渣中至少含有两种物质
C 向滤渣中滴加稀盐酸,一定没有气泡产生D. 向滤液中滴加稀盐酸,一定没有白色沉淀生成
【答案】C
【解析】
【分析】由于金属活动性Zn>Cu>Ag,向含有硝酸银和硝酸铜的废液中加入—定质量的锌粉,锌先与AgNO3反应生成硝酸锌和银,AgNO3反应完,若还有锌粉,锌才能与Cu(NO3)2反应生成硝酸锌和铜。根据Zn+2AgNO3═Zn(NO3)2+2Ag可知,每65份质量的锌可置换出216份质量的银;根据Zn+Cu(NO3)2═Zn(NO3)2+Cu,每65份质量的锌可置换出64份质量的铜,充分反应后过滤,将滤渣洗涤、干燥、称量,所得滤渣的质量与加入锌粉的质量相等,说明同时发生了上述两个反应。
详解】A、根据分析可知,硝酸铜溶液可能有剩余,滤液可能呈蓝色,说法正确;
B、根据分析可知,同时发生了锌与AgNO3反应生成硝酸锌和银,锌与Cu(NO3)2反应生成硝酸锌和铜,滤渣中至少银、铜含有两种物质,说法正确;
C、根据分析可知,锌可能有剩余,向滤渣中滴加稀盐酸,可能会有气泡产生,说法错误;
D、根据分析可知,同时发生了锌与AgNO3反应生成硝酸锌和银,锌与Cu(NO3)2反应生成硝酸锌和铜,滤液中一定不含硝酸银,则向滤液中滴加稀盐酸,一定没有白色沉淀生成,说法正确。
故选C。
10. 某无色气体可能含有CO2、CO、H2、N2中的一种或几种,依次进行以下实验(假设每步反应均完全进行):①通过炽热的碳层后,恢复到原状态,气体体积不变;② 通过灼热的CuO时,固体变成红色;③通入澄清石灰水中,石灰水变浑浊;④通过白色CuSO4粉末时,粉末变为蓝色晶体。下列判断正确的是( )
A. 原混合气体中一定含有CO2、CO,可能含有H2
B. 原混合气体中一定含有H2和CO,无法确定是否含有CO2、N2
C. 原混合气体一定含有H2、CO和CO2,可能含有N2
D. 若实验④后还有气体剩余,则原混合气体一定含有N2、CO
【答案】D
【解析】
【分析】碳和二氧化碳反应会生成一氧化碳,会使气体体积增大一倍,根据①可知,混合气通过碳后气体体积不变,可以知道混合气中一定不含二氧化碳;通过氧化铜后,固体变成红色,说明混合气中存在还原性气体,无水硫酸铜变蓝,不能说明通过氧化铜后生成了水,也可能是澄清石灰水中带出水蒸气,不能确定原混合气中有氢气;澄清石灰水变浑浊,说明生成了二氧化碳,可以确定原混合气中有一氧化碳,由于氮气不参加反应,可能含有,也可能没有,所以可以确定原混合气中一定没有二氧化碳,一定含一氧化碳,可能含有氢气或氮气或二者皆有。
【详解】A、原混合气中一定没有二氧化碳,一定含有氢气和一氧化碳,故错误;
B、原混合气中一定没有二氧化碳,一定有一氧化碳,可能含有氢气和氮气,故错误;
C、原混合气中一定没有二氧化碳,一定含有一氧化碳,可能含有氢气和氮气,故错误;
D、若实验④后还有气体剩余,说明是氮气,因此一定含有氮气、一氧化碳,故正确。
故选D。
第II卷 (非选择题共34分)
二、填空与简答(共17分)
11. 请用化学用语填空:
(1)两个甲烷分子______。
(2)氖气______。
(3)五个铵根离子______。
(4)标出氧化铁中铁元素的化合价______。
【答案】(1)2CH4
(2)Ne (3)5
(4)
【解析】
【小问1详解】
1个甲烷分子由1个碳原子与4个氢原子构成,则甲烷分子的符号为CH4,表示多个分子时,在相应的分子符号前面写出分子数目即可,故2个甲烷分子的符号写为2CH4。
【小问2详解】
氖气是氖原子直接构成的单质,其化学式直接由元素符号表示,故氖气的化学式写为Ne。
【小问3详解】
书写离子符号时,先写出相应的元素符号,然后在元素符号的右上角先写出离子所带电荷的数目,再写出电荷的电性,电荷数为1时,1省略不写,1个铵根离子带1个单位的正电荷,则铵根离子的符号为,表示多个离子时,在相应的离子符号前面写出离子数目即可,故五个铵根离子的符号写为5。
【小问4详解】
标化合物中某元素的化合价时,先写出化合物的化学式,然后在化学式中相应的元素符号的正上方先写出化合价的符号,再写出化合价的数值,氧化铁中,铁元素显+3价,故氧化铁中,铁元素的化合价标为。
12. 化学材料为信息技术发展保驾护航,芯片是信息技术的核心部件,硅是芯片的重要材料。请回答下列问题。
(1)如图1为硅在元素周期表中的部分信息,硅原子的电子数为______。
(2)如图2是硅的原子结构示意图,n的数值为______。
(3)如图3为工业生产中粗硅提纯涉及的反应微观示意图。写出图示反应的化学方程式:______。
【答案】(1)14 (2)4
(3)
【解析】
【小问1详解】
在元素周期表中,元素名称左上角的数字表示原子序数,在原子中,原子序数=质子数=核外电子数,故硅原子的电子数为14;
【小问2详解】
在原子中,质子数=核外电子数,故14=2+8+n,n=4;
【小问3详解】
由图可知,该反应为SiHCl3和氢气在高温下反应生成硅和氯化氢,该反应的化学方程式为:。
13. 2024年4月25日神舟十八号载人飞船发射成功,中国探月工程四期开启新征程。中国航天行稳致远,太空探索永无止境。请回答下列问题:
(1)航天员舱外航天服使用的聚氨酯橡胶______有机高分子材料(选填“是”或“不是”)。
(2)太阳能电池板需要使用的铝合金箔片,在加工时利用了金属的______性。
(3)氢氧化锂(LiOH)化学性质与氢氧化钠相似,如图是两种不同吸收剂吸收CO2的最大质量的关系图。空间站中选用LiOH作为吸收剂的理由是______。
【答案】(1)是 (2)延展
(3)吸收剂质量相同时,氢氧化锂吸收CO2效果更好
【解析】
【小问1详解】
聚氨酯橡胶是一种合成橡胶,是有机高分子材料;
小问2详解】
金属具有良好的延展性,物体在外力作用下能延伸成细丝而不断裂的性质叫延性;在外力(锤击或滚轧)作用能碾成薄片而不破裂的性质叫展性;太阳能电池板需要使用的铝合金箔片,在加工时利用了金属的延展性;
【小问3详解】
当吸收剂的质量相同时,氢氧化锂吸收的二氧化碳的质量多,即氢氧化锂吸收CO2效果更好,所以选用LiOH作吸收剂。
14. 高纯碳酸钙广泛应用于医药、生活、生产中,工业上用石灰石(含杂质SiO2)制备高纯碳酸钙,工艺流程如图所示。
(1)“酸溶”过程中,为了提高反应速率可以采取的措施有______(写一条)。
(2)操作1和操作2都要用到玻璃棒,其作用是______。
(3)可循环利用的物质是______(填化学式)。
(4)操作2完成后,将滤渣洗涤、干燥得到高纯碳酸钙。要检验碳酸钙是否洗涤干净,可向最后一次洗涤液中加入下列试剂中的______(填字母)进行检验。
A. AgNO3溶液B. BaCl2溶液C. 稀盐酸
【答案】(1)将固体粉碎(搅拌或升温或者提高酸浓度)
(2)引流 (3)CO2 (4)A
【解析】
【小问1详解】
“酸溶”过程中,将固体粉碎(搅拌或升温或者提高酸的浓度),这些措施都可以提高反应速率。故填:将固体粉碎(搅拌或升温或者提高酸的浓度)。
【小问2详解】
操作1和操作2都是将固体和液体分开的操作,都属于过滤,所以操作1和操作2都要用到玻璃棒,其作用是引流。故填:引流。
【小问3详解】
据流程图可知,由于“酸溶”过程中产生二氧化碳,转化过程中二氧化碳又参与反应,所以可循环利用的物质是二氧化碳。故填:CO2。
【小问4详解】
据流程图可知,若碳酸钙没有洗涤干净,则洗涤液中含有氯化铵溶液,氯化铵与硝酸银反应生成白色沉淀,氯化铵与氯化钡、稀盐酸都不发生反应。故填:A。
15. pH=12的溶液中可能含有Fe3+、K+、、、等离子中的一种或几种,为了检验该溶液中含有的离子,进行如下实验并分析:
(1)该溶液pH=12,证明不存在的离子是______。
(2)取少量该溶液于试管中,滴加适量氯化钡溶液,产生白色沉淀,再加入过量的稀盐酸,沉淀部分溶解。该溶液中一定存在的离子是______,可能存在的离子是______。
【答案】(1)Fe3+
(2) ①. K+、、 ②.
【解析】
【小问1详解】
该溶液pH=12,说明溶液显碱性,含有氢氧很离子,和氢氧根离子不能共存的离子不能存在,氢氧化铁属于沉淀,所以不存在Fe3+;
【小问2详解】
滴加适量BaCl2溶液,产生白色沉淀,再加入过量的稀盐酸,沉淀部分溶解,说明有溶于酸的碳酸钡沉淀,也有不溶于酸的硫酸钡沉淀,所以沉淀溶解的化学方程式是碳酸钡与盐酸反应,反应物是碳酸钡和盐酸,生成物是氯化钡、水和氧化碳,所以一定存在硫酸根离子和碳酸根离子,由于pH=12,还含有OH-离子,溶液中还需要含有阳离子,所以一定存在钾离子,可能存在的是硝酸根离子。
三、实验与探究(共11分)
16. 根据如图,回答问题。
图一中:
(1)仪器①的名称是_______。
(2)实验室B装置制取氧气的化学方程式为_______。
(3)实验室制取和收集二氧化碳气体,应选用的装置组合是_______(填字母序号)。
图二中:
(4)利用过氧化氢分解产生氧气的原理,小玲自制了一个家庭简易制氧机。
①利用可以上下抽拉的线绳,可以实现二氧化锰与过氧化氢溶液的接触与分离,这样设计的优点是_______(答一点)。
②若想利用B装置监测产生氧气的速度,B中有一处不足之处,你的改进措施是_______。
【答案】(1)分液漏斗
(2)2H2O22H2O+O2↑
(3)B和C (4) ①. 可以控制发生的发生与停止 ②. 将a导管口伸入到水面以下
【解析】
【小问1详解】
仪器①的名称是分液漏斗;
【小问2详解】
实验室B装置制取氧气,装置B为固液常温型,即为过氧化氢在二氧化锰的催化下分解生成氧气和水,化学方程式为:;
【小问3详解】
实验室利用石灰石或大理石(主要成分碳酸钙)和稀盐酸制取二氧化碳,该反应为固液常温型,发生装置可选择B,二氧化碳能溶于水且能与水反应,二氧化碳密度比空气大,可选择C向上排空气法收集,故制取和收集二氧化碳气体,应选用的装置组合是BC;
【小问4详解】
①利用可以上下抽拉的线绳,可以实现二氧化锰与过氧化氢溶液的接触与分离,这样可以控制反应的发生和停止;
②氧气不易溶于水,氧气密度比水小,若想利用乙装置监测产生氧气的气流速度,则可将a导管口伸入到水面以下,通过观察产生气泡的快慢,监测产生氧气的气流速度。
17. 诚信超市出现了一种名为“污渍爆炸盐”的洗涤新产品,能在瞬间去除洗衣粉难以除去的多种顽固污渍。某校兴趣小组的同学在老师的指导下对该产品开展探究活动。
【查阅资料】“污渍爆炸盐”的主要成分是过碳酸钠(Na2CO4),它是一种白色结晶颗粒,易溶于水,能与水反应,生成碳酸盐和一些化合物起到去除污渍的作用。
【提出问题】
“污渍爆炸盐”与水反应后,生成物是什么呢
(1)【作出猜想】
猜想一:Na2CO3和H2O2
猜想二:Na2CO3和NaOH
猜想三:Na2CO3、______。
(2)【实验探究】
【小结】
(3)实验中加入足量CaCl2溶液的目的是______。
【拓展延伸】
(4)“洁厕灵”的有效成分是稀盐酸,“污渍爆炸盐”与洁厕灵不能混用,原因用化学方程式表示______。
【答案】(1)H2O2、NaOH
(2) ①. 二 ②. 白色沉淀 ③. 硫酸铜溶液
(3)将碳酸钠完全除去,防止对氢氧化钠的检验造成干扰
(4)
【解析】
【小问1详解】
根据猜想一、二的内容及后续实验探究步骤验证是否存在过氧化氢、碳酸钠、氢氧化钠,则猜想三为:Na2CO3、H2O2、NaOH;
【小问2详解】
步骤②:取适量①的溶液于试管中,先向其中加入少量二氧化锰粉末,再将带火星的木条置于试管口,产生气泡,木条复燃,是因为过氧化氢在二氧化锰催化作用下分解生成了氧气,所以猜想二不成立;
步骤③、④:结论是猜想一成立,存在Na2CO3和H2O2,不存在NaOH;取适量①的溶液于试管,向其中加入足量CaCl2溶液,振荡、静置,氯化钙和碳酸钠反应生成碳酸钙沉淀和氯化钠,观察到有白色沉淀产生;步骤④是检验氢氧化钠的存在,依据无蓝色沉淀产生,可知加入的是硫酸铜溶液,氢氧化钠和硫酸铜反应生成氢氧化铜沉淀和硫酸钠,无蓝色沉淀生成说明没有氢氧化钠;
【小问3详解】
碳酸钠也能和硫酸铜等反应生成铜的沉淀,实验中加入足量CaCl2溶液除去碳酸钠,防止干扰氢氧化钠的检验;
【小问4详解】
碳酸钠会和稀盐酸反应生成氯化钠、水和二氧化碳,所以“污渍爆炸盐”与洁厕灵不能混用,化学方程式为:。
四、分析与计算(共6分)
18. 高铁酸钾(K2FeO4)是一种新型高效水处理剂。如图是制备K2FeO4的流程(已知:K2FeO4在中性和酸性条件下易分解):
(1)K2FeO4净水时生成的胶状物具有疏松多孔的网状结构,推测其具有的性质是______。
(2)K2FeO4应保存在______(选填“酸”、“中”或“碱”)性环境,防止其分解。
(3)Na2FeO4由______种元素组成,其中铁、氧元素的质量比为______。
(4)操作X是______。
(5)Na2FeO4与KOH发生的是复分解反应(Na2FeO4+2KOH═K2FeO4↓+2NaOH)。要制取19.8gK2FeO4需要KOH的质量为______。
【答案】(1)吸附性 (2)碱
(3) ①. 三 ②. 7:8
(4)过滤 (5)11.2g
【解析】
【小问1详解】
K2FeO4净水时生成的胶状物具有疏松多孔的网状结构,根据其具有“疏松多孔的网状结构”且能用来净水,可推测其具有吸附性。故填:吸附性。
【小问2详解】
由题给信息可知,K2FeO4在中性和酸性条件下易分解,所以需加入过量的碱溶液,使之充分反应,并提供碱性环境,防止K2FeO4分解。故填:碱。
【小问3详解】
Na2FeO4由三种元素组成,分别为钠元素、铁元素和氧元素;Na2FeO4中铁、氧元素的质量比为56:(16×4)=7:8。故填:①三;②7:8。
【小问4详解】
操作X是将固液分离,所以操作X为过滤。故填:过滤。
【小问5详解】
设需要KOH的质量为x,
=11.2g
则要制取19.8gK2FeO4需要KOH的质量为11.2g。
故填:11.2g。
【点睛】本题难度不大,主要考查物质的制备,掌握过滤的原理、物质的结构与性质、化学方程式的计算等,结合学过的知识和题中的信息进行分析解答。选项
实验目的
实验方法
A
鉴别空气和呼出气体
分别伸入燃着的木条,比较燃烧情况
B
鉴别化肥NH4CI和(NH4)2SO4
分别加Ca(OH)2,研麿,闻气味
C
去除N2中混有的少量O2
将气体通入灼热的碳层
D
去除粗盐中的难溶性杂质
溶解、过滤、洗涤、干燥
序号
步骤
现象
结论
1.
取少量“污渍爆炸盐”于烧杯中加入足量的蒸馏水充分搅拌
固体完全溶解形成无色溶液
2.
取①少量的溶液于试管中,先向其中加入少量二氧化锰粉末,再伸入带火星的木条
产生大量气泡,木条复燃
猜想______不成立
3.
取适量①的溶液于试管,向其中加入足量CaCl2溶液,振荡、静置
有______产生
猜想一成立
4.
取适量③的上层清液于试管向其中滴加______,振荡
无蓝色沉淀产生
203,2024年山东省济宁市金乡县中考二模化学试题(1): 这是一份203,2024年山东省济宁市金乡县中考二模化学试题(1),共6页。
2023年山东省济宁市金乡县中考三模化学试题: 这是一份2023年山东省济宁市金乡县中考三模化学试题,共6页。
2023年山东省济宁市金乡县中考五模化学试题(含答案): 这是一份2023年山东省济宁市金乡县中考五模化学试题(含答案),共8页。试卷主要包含了下列物质所对应的用途错误的是,下列对实验现象的描述正确的是,0g碳酸钠的饱和溶液中含有49等内容,欢迎下载使用。












