




初中化学沪教版九年级下册第3节 几种重要的盐示范课ppt课件
展开1、认识盐的分类。2、认识盐的性质。3、能用金属活动性顺序判断金属与盐溶液 能否发生置换反应。4、初步学会判断复分解反应能否发生。
日常生活中我们接触过很多种盐。如调味用的食盐,建筑、雕塑用的大理石、汉白玉的主要成分(碳酸钙)是盐,用于净水的明矾(含硫酸铝)是盐,常用的小苏打(主要成分碳酸氢钠)是盐,消毒用的高锰酸钾是盐,大多数化肥(如硫酸铵、碳酸氢铵等)也是盐……
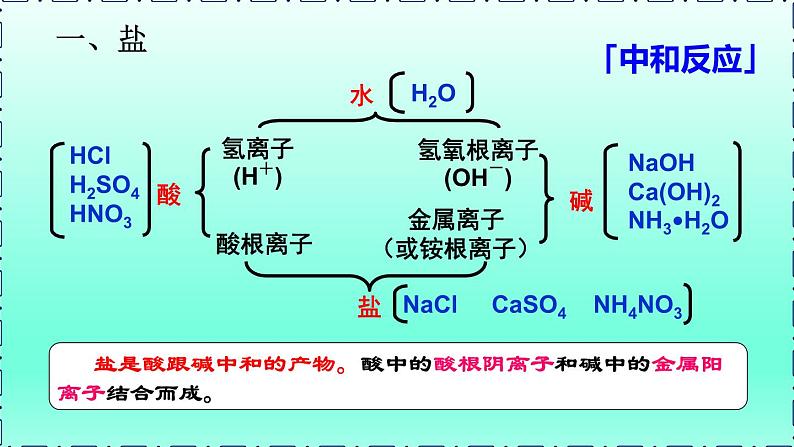
根据酸碱中和生成盐和水的事实,盐在组成上的相同之处是什么?
盐是电离时生成金属离子(或铵根离子)和酸根离子的化合物。
理解:(1)盐是一类化合物的总称,氯化钠是盐类中的一种,不能认为 “盐就是氯化钠”。(2)盐类物质不一定都含有金属元素,如NH4NO3、(NH4)2CO3(3)NaHCO3、Cu2(OH)2CO3等物质中除含有金属离子和酸根离子外,还会有氢元素或氢氧根,也属于盐类物质。
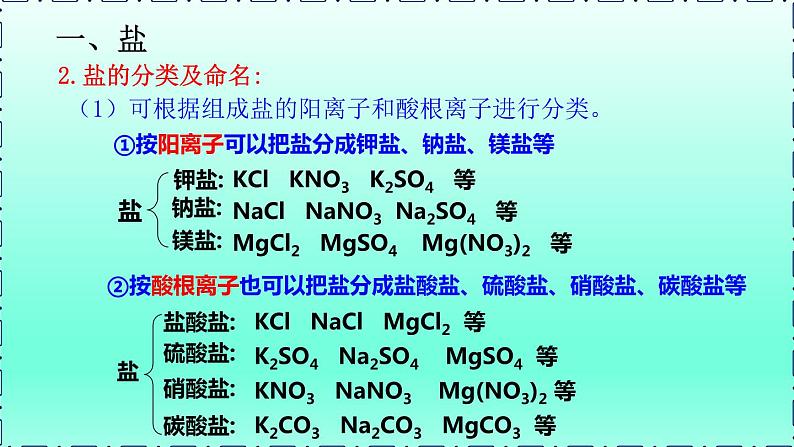
(1)可根据组成盐的阳离子和酸根离子进行分类。
②按酸根离子也可以把盐分成盐酸盐、硫酸盐、硝酸盐、碳酸盐等
①按阳离子可以把盐分成钾盐、钠盐、镁盐等
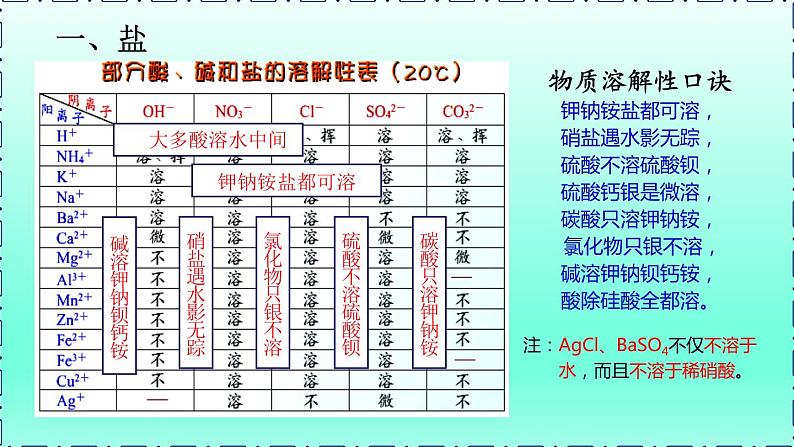
查阅课本附录四,说明:①钾盐、钠盐、铵盐、硝酸盐的溶解性;②碳酸盐、磷酸盐的溶解性;③钙盐、钡盐、银盐的溶解性;④BaSO4(钡餐主要成分)、CaSO4(石膏主要成分)和KNO3的溶解性。
(2)可根据盐的溶解性分类:可溶性盐、难溶性盐。
物质溶解性口诀钾钠铵盐都可溶, 硝盐遇水影无踪,硫酸不溶硫酸钡, 硫酸钙银是微溶,碳酸只溶钾钠铵, 氯化物只银不溶,碱溶钾钠钡钙铵, 酸除硅酸全都溶。
注:AgCl、BaSO4不仅不溶于 水,而且不溶于稀硝酸。
CaCO3 BaCO3 Mg(OH)2 BaSO4 AgCl
根据溶解性口诀,判断下列物质的溶解性?
MgSO4 (NH4)2SO4 Ba(OH)2 AgNO3
Cu(OH)2 Fe(OH)3
金属活动性由强逐渐减弱
1.盐与某些金属反应 (置换反应)
盐溶液+金属→新盐溶液+新金属(须遵守金属活动性顺序)
1.金属的位置越靠前,它的活动性就越强。
2.位于氢前的金属能置换出盐酸、稀硫酸(不能用浓硫酸、硝酸) 中的氢。
3.位于前面的金属能把位于后面的金属从它们的盐溶液中置换出来。 (钾、钙、钠除外)
金属与盐溶液中的金属活动性差距越大,反应越易进行。
BaCO3 + H2SO4 BaCl2 + H2SO4AgNO3 + HClBaCO3 + 2HCl
= BaCl2+H2O+CO2↑
= BaSO4↓+H2O+CO2↑
= BaSO4↓+ 2HCl
= AgCl↓+ HNO3
盐 + 酸 → 新盐 + 新酸
除AgCl、BaSO4
判断以下反应能否发生?
ZnCO3+HNO3AgCl+HClHCl+MgSO4
Mg(NO3)2 + Ba(OH)2 Na2CO3 + Ca(OH)2 CuSO4 + Ba(OH)2
= BaSO4 ↓+ Cu(OH)2↓
= CaCO3↓ + 2NaOH
= Ba(NO3)2+Mg(OH)2↓
盐 + 碱 → 新盐 + 新碱
Na2SO4 + KOHMg(OH)2 + FeCl3K2CO3 + Ba(OH)2
Ba(NO3)2 + Na2SO4Ba(NO3)2 + Na2CO3BaCl2 + Na2SO4BaCl2 + Na2CO3Ba(NO3)2 + AgNO3
= 2NaNO3+BaSO4↓
= 2NaNO3+BaCO3↓
= 2NaCl+BaCO3↓
= 2NaCl+BaSO4↓
= Ba(NO3)2+2AgCl↓
盐1 + 盐2 → 盐3 + 盐4
CuSO4+Mg(NO3)2 BaCO3+Na2SO4NH4Cl+Na2CO3 AgCl+Fe(NO3)2
三、复分解反应发生的条件
CuSO4溶液中含有离子
Mg(NO3)2溶液中含有离子
为什么CuSO4和Mg(NO3)2不发生复分解反应?
Cu2+ +SO42- +Mg2+ +2NO3- = Mg2+ +SO42- + Cu2++2NO3-
AB + CD = AD + CB
(大多数在水溶液中进行)
(1)看头——反应物满足“无酸皆须溶”“有酸除钡(BaSO4)银(AgCl)”(2)看尾——生成物满足双交换,价不变,生成水、气体或沉淀
下列物质能发生化学反应吗?为什么?
1、NaOH+BaCl2 = Ba(OH)2+NaCl2、2NaCl+Cu(NO3)2 = 2NaNO3+CuCl23、2Fe(OH)3+3MgCl2 = 2FeCl3+3Mg(OH)2 ↓4、Na2CO3+CaCl2 = CaCO3 ↓ +2NaCl5、Na2CO3+2HCl = 2NaCl+H2O+CO2↑6、Ba(OH)2+H2SO4 = BaSO4↓ + 2H2O
1、检验Cl-的方法:
(Cl-+Ag+=AgCl ↓)
取少许待检液于试管中, 加入AgNO3溶液,产生白色沉淀,再加入稀硝酸,若沉淀不消失,则证明原溶液中一定含Cl-。
如: BaCl2+2AgNO3 =2AgCl ↓+Ba(NO3)2 HCl+AgNO3 = AgCl ↓+HNO3
如:Na2SO4+Ba(NO3)2 =BaSO4 ↓+2NaNO3 H2SO4+Ba(NO3)2 = BaSO4 ↓+2HNO3
取少许待检液于试管中, 加入Ba(NO3) 2溶液,产生白色沉淀,再滴加稀硝酸,若沉淀不消失,则证明原溶液中一定含SO42-。
2、检验SO42-的方法:
(SO42-+Ba2+=BaSO4↓)
注意: 既不溶于水,又不溶于稀硝酸的白色沉淀有AgCl和BaSO4
化学九年级下册第7章 应用广泛的酸、碱、盐第3节 几种重要的盐习题课件ppt: 这是一份化学九年级下册第7章 应用广泛的酸、碱、盐第3节 几种重要的盐习题课件ppt,共27页。PPT课件主要包含了复合肥料,根瘤菌,灰白色,刺激性,氧化钙或CaO,碳酸氢铵,氯化铵,有刺激性气味气体产生,CO32-,酸银溶液再加等内容,欢迎下载使用。
初中化学沪教版九年级下册第3节 几种重要的盐习题ppt课件: 这是一份初中化学沪教版九年级下册第3节 几种重要的盐习题ppt课件,共24页。PPT课件主要包含了氯化钠,小苏打,碳酸钙,建筑材料,补钙剂,CaCO3,NaCl,Na2CO3,NaHCO3,大量气泡等内容,欢迎下载使用。
沪教版九年级下册第3节 几种重要的盐习题ppt课件: 这是一份沪教版九年级下册第3节 几种重要的盐习题ppt课件,共23页。PPT课件主要包含了金属阳离子,酸根离子,NaCl,CaCO3,Na2CO3,NaHCO3,硫酸盐,硝酸盐,①②④⑥⑦,K2CO3等内容,欢迎下载使用。













