





还剩10页未读,
继续阅读
所属成套资源:2025年高中化学鲁科版选择性必修2课件(30份)
成套系列资料,整套一键下载
2025年高中化学第2章教考衔接2分子或离子中的键角比较课件鲁科版选择性必修2
展开
这是一份2025年高中化学第2章教考衔接2分子或离子中的键角比较课件鲁科版选择性必修2,共18页。
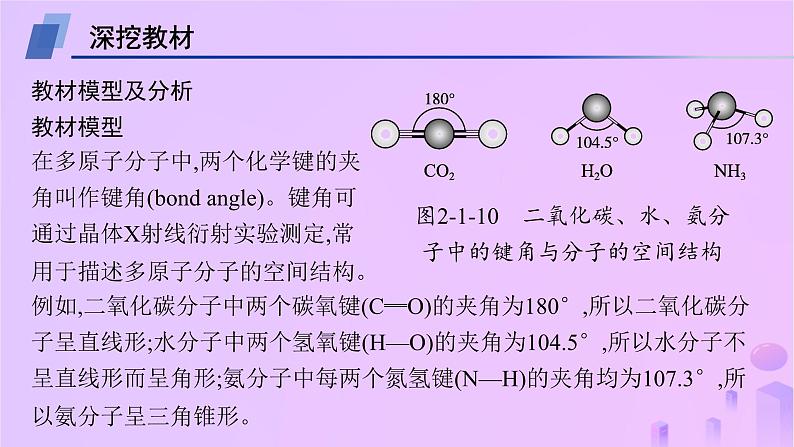
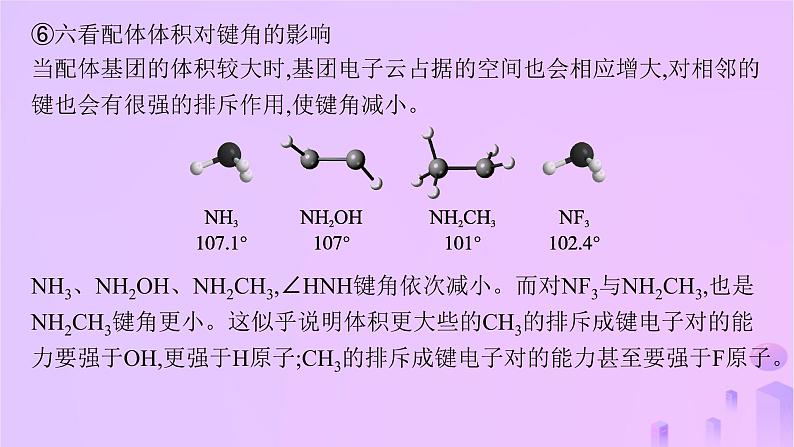
教考衔接2 分子或离子中的键角比较深挖教材教材模型及分析教材模型在多原子分子中,两个化学键的夹角叫作键角(bond angle)。键角可通过晶体X射线衍射实验测定,常用于描述多原子分子的空间结构。例如,二氧化碳分子中两个碳氧键(C═O)的夹角为180°,所以二氧化碳分子呈直线形;水分子中两个氢氧键(H—O)的夹角为104.5°,所以水分子不呈直线形而呈角形;氨分子中每两个氮氢键(N—H)的夹角均为107.3°,所以氨分子呈三角锥形。模型分析在多原子分子中,相邻的两个化学键的夹角叫作键角。影响共价化合物分子中键角大小的因素有:①中心原子的杂化类型;②中心原子的孤电子对数;③中心原子的电负性;④配原子的电负性;⑤单键与多重键;⑥配体体积等。因此在比较判断共价化合物分子键角大小时,应该考虑到以上几种因素。模型应用与指导——比较分子或者离子的键角大小的方法①一看中心原子的杂化类型——“杂多角小”对于ABn型分子,中心原子采取sp杂化,键角为180°,中心原子采取sp2杂化,键角为120°,采取sp3杂化,键角为109°28'。故键角大小关系:sp>sp2>sp3。②二看中心原子的孤电子对数——“孤多角小”中心原子的杂化类型相同时,比较中心原子的孤电子对数。由于孤电子对与孤电子对之间的斥力>孤电子对与成键电子对之间的斥力>成键电子对与成键电子对之间的斥力,故中心原子的孤电子对数越多,键角越小。例如键角大小关系:CH4>NH3>H2O。③三看中心原子的电负性——“中负大角大”当中心原子的杂化类型相同,孤电子对数相同,配原子也相同,且中心原子的电负性大于配原子电负性时,中心原子电负性越大,成键电子对之间的斥力越大,则键角越大。例如键角大小关系:H2O>H2S>H2Se;NH3>PH3>AsH3。④四看配原子的电负性——“近大远小,配负大角小”a.若中心原子种类、杂化类型相同,而配原子种类不同。当中心原子的电负性大于配原子电负性时,即相邻的两个成键电子对更靠近中心原子时,相互间的斥力会增大,键角会增大。反之,当中心原子的电负性小于配原子,即相邻的两个成键电子对远离中心原子,相互间的斥力会变小,则键角会减小。例如NH3、NF3中N的杂化类型、孤电子对都相同,由于电负性: F>N>H。NH3中相邻的两个成键电子对靠近中心N原子,NF3中相邻的两个成键电子对远离中心原子N,故二者键角大小关系:NH3>NF3。b.若中心原子种类、杂化类型相同,而配原子种类不同。当配原子的电负性大于中心原子时,即相邻的两个成键电子对远离中心原子时,配原子的电负性越大,成键电子对越远离中心原子,使得成键电子对之间的斥力越小,则使键角越小。例如键角大小关系:NCl3>NF3。⑤五看单键与多重键对键角的影响当成键电子对中存在多重键时,由于多重键成键电子数目较多,导致多重键对单键成键电子对的排斥力要大一些,从而多重建与单键之间的键角大一些,单键与单键之间的键角小一些。成键电子对斥力大小可以定性表示如下:t-t>t-d>d-d>d-s>s-s(t-三键,d-双键,s-单键)。如图为甲醛分子结构式,在HCHO分子中,C原子为sp2杂化。虽然等性sp2杂化的键角是120°,但由于C原子与O原子间以双键C═O结合,该双键对C—H键的斥力要更大些,所以α>β。⑥六看配体体积对键角的影响当配体基团的体积较大时,基团电子云占据的空间也会相应增大,对相邻的键也会有很强的排斥作用,使键角减小。NH3、NH2OH、NH2CH3,∠HNH键角依次减小。而对NF3与NH2CH3,也是NH2CH3键角更小。这似乎说明体积更大些的CH3的排斥成键电子对的能力要强于OH,更强于H原子;CH3的排斥成键电子对的能力甚至要强于F原子。链接高考模型应用1——利用分子空间结构判断键角1.(2023海南卷)下列有关元素单质或化合物的叙述正确的是( )A.P4分子呈正四面体,键角为109°28'B.NaCl焰色试验为黄色,与Cl电子跃迁有关C.Cu基态原子核外电子排布符合构造原理D.OF2是由极性键构成的极性分子D解析 P4分子呈正四面体,磷原子在正四面体的四个顶点处,键角为60°,A错误;NaCl焰色试验为黄色,与Na电子跃迁有关,B错误;Cu基态原子核外电子排布不符合构造原理,考虑了半满规则和全满规则,价电子排布式为3d104s1,这样能量更低更稳定,C错误;OF2的空间结构是角形,因此是由极性键构成的极性分子,D正确。关键信息 ①P4呈正四面体;②P4是四原子分子;③P原子位于正四面体的各个顶点。注意:同为正四面体形的CH4与P4的区别,CH4中C原子位于正四面体的体心处,键角为109°28'。模型应用2——利用中心原子的杂化类型比较键角的大小2.(2023山东卷16节选)ClO2中心原子为Cl,Cl2O中心原子为O,二者均为V形结构,但ClO2中存在大π键( )。ClO2中Cl原子的轨道杂化方式为 ;O—Cl—O键角 (填“>”“<”或“=”)Cl—O—Cl键角。 sp2>解析 由ClO2中存在 可以推断,其中Cl原子只能提供1对电子,有一个O原子提供1个电子,另一个O原子提供1对电子,这5个电子处于互相平行的p轨道中形成大π键,Cl提供孤电子对与其中一个O形成配位键,与另一个O形成的是普通的共价键(σ键,这个O只提供了一个电子参与形成大π键),Cl的价电子对数为3,则Cl原子的轨道杂化方式为sp2;Cl2O中心原子为O,根据价电子对的计算公式可知2+ =4,因此,O的杂化方式为sp3,sp2杂化的键角一定大于sp3的。关键信息 ①ClO2中存在大π键;②ClO2的中心原子为Cl;③ClO2中的大π键为 。信息分析:有大π键的分子,中心原子大部分都是sp2杂化。模型应用3——利用中心原子价电子对数比较键角大小3.(2023湖南卷17节选)超纯Ga(CH3)3是制备第三代半导体的支撑原材料之一,近年来,我国科技工作者开发了超纯Ga(CH3)3纯化、超纯分析和超纯灌装一系列高新技术,在研制超纯方面取得了显著成果。比较分子中的C—Ga—C键角大小:Ga(CH3)3 (填“>”“<”或“=”)Ga(CH3)3(Et2O),其原因是 (其中Et2O指乙醚)。Ga(CH3)3中Ga的价电子对数为3,Ga与连接的3个C构成平面正三角形,C—Ga—C夹角为120°;Ga(CH3)3(Et2O)中Ga的价电子对数为4,Ga与连接的3个C、1个O构成四面体形,C—Ga—C夹角接近109°28' >名师点拨 Ga(CH3)3(Et2O)中Ga和氧原子之间应为配位键,氧原子提供孤电子对,Ga提供空轨道来接受氧原子的孤电子对,配位键的键参数与普通共价键相同,Ga的价电子对数为4。模型应用4——利用中心原子的孤电子对数比较键角的大小B.简单氢化物沸点:X>Q>ZC.第一电离能:X>Q>MnD.最高价氧化物对应的水化物酸性:Z>XC沸点顺序为H2O>NH3>PH3,正确顺序为Q>X>Z,B错误;同主族元素从上到下第一电离能减小,同周期从左到右第一电离能有增大的趋势,故第一电离能:N>O>Mn,C正确;Z的最高价氧化物对应的水化物为H3PO4,X最高价氧化物对应的水化物为HNO3,前者为中强酸而后者为强酸,D错误。
教考衔接2 分子或离子中的键角比较深挖教材教材模型及分析教材模型在多原子分子中,两个化学键的夹角叫作键角(bond angle)。键角可通过晶体X射线衍射实验测定,常用于描述多原子分子的空间结构。例如,二氧化碳分子中两个碳氧键(C═O)的夹角为180°,所以二氧化碳分子呈直线形;水分子中两个氢氧键(H—O)的夹角为104.5°,所以水分子不呈直线形而呈角形;氨分子中每两个氮氢键(N—H)的夹角均为107.3°,所以氨分子呈三角锥形。模型分析在多原子分子中,相邻的两个化学键的夹角叫作键角。影响共价化合物分子中键角大小的因素有:①中心原子的杂化类型;②中心原子的孤电子对数;③中心原子的电负性;④配原子的电负性;⑤单键与多重键;⑥配体体积等。因此在比较判断共价化合物分子键角大小时,应该考虑到以上几种因素。模型应用与指导——比较分子或者离子的键角大小的方法①一看中心原子的杂化类型——“杂多角小”对于ABn型分子,中心原子采取sp杂化,键角为180°,中心原子采取sp2杂化,键角为120°,采取sp3杂化,键角为109°28'。故键角大小关系:sp>sp2>sp3。②二看中心原子的孤电子对数——“孤多角小”中心原子的杂化类型相同时,比较中心原子的孤电子对数。由于孤电子对与孤电子对之间的斥力>孤电子对与成键电子对之间的斥力>成键电子对与成键电子对之间的斥力,故中心原子的孤电子对数越多,键角越小。例如键角大小关系:CH4>NH3>H2O。③三看中心原子的电负性——“中负大角大”当中心原子的杂化类型相同,孤电子对数相同,配原子也相同,且中心原子的电负性大于配原子电负性时,中心原子电负性越大,成键电子对之间的斥力越大,则键角越大。例如键角大小关系:H2O>H2S>H2Se;NH3>PH3>AsH3。④四看配原子的电负性——“近大远小,配负大角小”a.若中心原子种类、杂化类型相同,而配原子种类不同。当中心原子的电负性大于配原子电负性时,即相邻的两个成键电子对更靠近中心原子时,相互间的斥力会增大,键角会增大。反之,当中心原子的电负性小于配原子,即相邻的两个成键电子对远离中心原子,相互间的斥力会变小,则键角会减小。例如NH3、NF3中N的杂化类型、孤电子对都相同,由于电负性: F>N>H。NH3中相邻的两个成键电子对靠近中心N原子,NF3中相邻的两个成键电子对远离中心原子N,故二者键角大小关系:NH3>NF3。b.若中心原子种类、杂化类型相同,而配原子种类不同。当配原子的电负性大于中心原子时,即相邻的两个成键电子对远离中心原子时,配原子的电负性越大,成键电子对越远离中心原子,使得成键电子对之间的斥力越小,则使键角越小。例如键角大小关系:NCl3>NF3。⑤五看单键与多重键对键角的影响当成键电子对中存在多重键时,由于多重键成键电子数目较多,导致多重键对单键成键电子对的排斥力要大一些,从而多重建与单键之间的键角大一些,单键与单键之间的键角小一些。成键电子对斥力大小可以定性表示如下:t-t>t-d>d-d>d-s>s-s(t-三键,d-双键,s-单键)。如图为甲醛分子结构式,在HCHO分子中,C原子为sp2杂化。虽然等性sp2杂化的键角是120°,但由于C原子与O原子间以双键C═O结合,该双键对C—H键的斥力要更大些,所以α>β。⑥六看配体体积对键角的影响当配体基团的体积较大时,基团电子云占据的空间也会相应增大,对相邻的键也会有很强的排斥作用,使键角减小。NH3、NH2OH、NH2CH3,∠HNH键角依次减小。而对NF3与NH2CH3,也是NH2CH3键角更小。这似乎说明体积更大些的CH3的排斥成键电子对的能力要强于OH,更强于H原子;CH3的排斥成键电子对的能力甚至要强于F原子。链接高考模型应用1——利用分子空间结构判断键角1.(2023海南卷)下列有关元素单质或化合物的叙述正确的是( )A.P4分子呈正四面体,键角为109°28'B.NaCl焰色试验为黄色,与Cl电子跃迁有关C.Cu基态原子核外电子排布符合构造原理D.OF2是由极性键构成的极性分子D解析 P4分子呈正四面体,磷原子在正四面体的四个顶点处,键角为60°,A错误;NaCl焰色试验为黄色,与Na电子跃迁有关,B错误;Cu基态原子核外电子排布不符合构造原理,考虑了半满规则和全满规则,价电子排布式为3d104s1,这样能量更低更稳定,C错误;OF2的空间结构是角形,因此是由极性键构成的极性分子,D正确。关键信息 ①P4呈正四面体;②P4是四原子分子;③P原子位于正四面体的各个顶点。注意:同为正四面体形的CH4与P4的区别,CH4中C原子位于正四面体的体心处,键角为109°28'。模型应用2——利用中心原子的杂化类型比较键角的大小2.(2023山东卷16节选)ClO2中心原子为Cl,Cl2O中心原子为O,二者均为V形结构,但ClO2中存在大π键( )。ClO2中Cl原子的轨道杂化方式为 ;O—Cl—O键角 (填“>”“<”或“=”)Cl—O—Cl键角。 sp2>解析 由ClO2中存在 可以推断,其中Cl原子只能提供1对电子,有一个O原子提供1个电子,另一个O原子提供1对电子,这5个电子处于互相平行的p轨道中形成大π键,Cl提供孤电子对与其中一个O形成配位键,与另一个O形成的是普通的共价键(σ键,这个O只提供了一个电子参与形成大π键),Cl的价电子对数为3,则Cl原子的轨道杂化方式为sp2;Cl2O中心原子为O,根据价电子对的计算公式可知2+ =4,因此,O的杂化方式为sp3,sp2杂化的键角一定大于sp3的。关键信息 ①ClO2中存在大π键;②ClO2的中心原子为Cl;③ClO2中的大π键为 。信息分析:有大π键的分子,中心原子大部分都是sp2杂化。模型应用3——利用中心原子价电子对数比较键角大小3.(2023湖南卷17节选)超纯Ga(CH3)3是制备第三代半导体的支撑原材料之一,近年来,我国科技工作者开发了超纯Ga(CH3)3纯化、超纯分析和超纯灌装一系列高新技术,在研制超纯方面取得了显著成果。比较分子中的C—Ga—C键角大小:Ga(CH3)3 (填“>”“<”或“=”)Ga(CH3)3(Et2O),其原因是 (其中Et2O指乙醚)。Ga(CH3)3中Ga的价电子对数为3,Ga与连接的3个C构成平面正三角形,C—Ga—C夹角为120°;Ga(CH3)3(Et2O)中Ga的价电子对数为4,Ga与连接的3个C、1个O构成四面体形,C—Ga—C夹角接近109°28' >名师点拨 Ga(CH3)3(Et2O)中Ga和氧原子之间应为配位键,氧原子提供孤电子对,Ga提供空轨道来接受氧原子的孤电子对,配位键的键参数与普通共价键相同,Ga的价电子对数为4。模型应用4——利用中心原子的孤电子对数比较键角的大小B.简单氢化物沸点:X>Q>ZC.第一电离能:X>Q>MnD.最高价氧化物对应的水化物酸性:Z>XC沸点顺序为H2O>NH3>PH3,正确顺序为Q>X>Z,B错误;同主族元素从上到下第一电离能减小,同周期从左到右第一电离能有增大的趋势,故第一电离能:N>O>Mn,C正确;Z的最高价氧化物对应的水化物为H3PO4,X最高价氧化物对应的水化物为HNO3,前者为中强酸而后者为强酸,D错误。
相关资料
更多









