




鲁科版 (2019)选择性必修2第2节 几种简单的晶体结构模型图片课件ppt
展开1.金属晶体:金属原子通过 形成的晶体。 2.金属键:金属 和“ ”之间的强的相互作用。
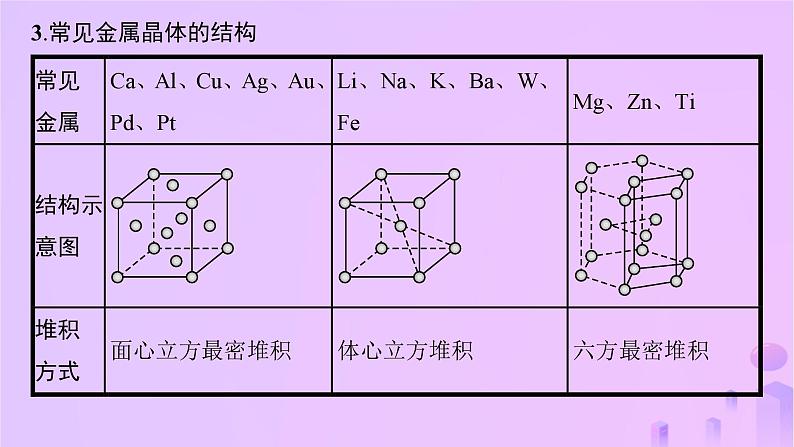
3.常见金属晶体的结构
4.金属晶体的结构与物理性质(1)金属晶体具有良好的延展性、导电性、导热性。这些性质均与 有关。 (2)金属晶体中原子的堆积方式也会影响金属的性质,如具有最密堆积结构的金属的延展性往往比具有其他结构的金属的延展性 。
(3)金属晶体熔点变化规律①同类型的金属晶体的熔点由金属阳离子半径、离子所带的电荷数决定,阳离子半径越小,所带电荷数越多,金属键就越强,晶体熔点就越高。例如熔点:Li Na K Rb Cs,Na Mg Al。 ②金属晶体的熔点差别较大,如Hg熔点很低,碱金属熔点较低,铁等金属熔点很高。这是由于金属晶体密堆积方式、金属阳离子和“自由电子”的作用力不同造成的。③合金的熔点一般低于其成分金属的熔点。
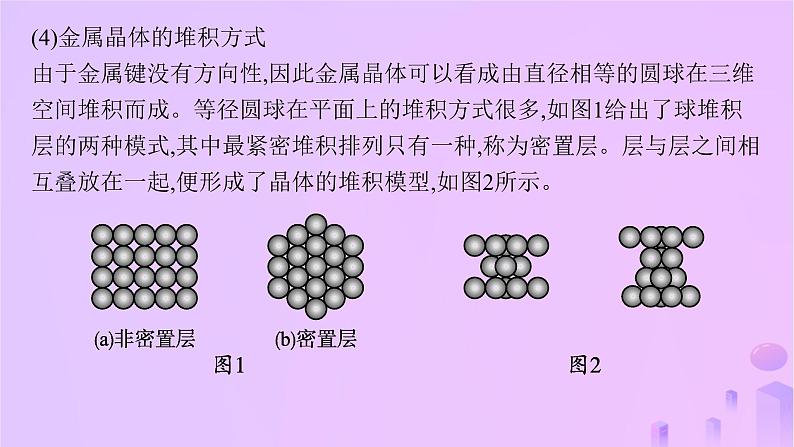
(4)金属晶体的堆积方式由于金属键没有方向性,因此金属晶体可以看成由直径相等的圆球在三维空间堆积而成。等径圆球在平面上的堆积方式很多,如图1给出了球堆积层的两种模式,其中最紧密堆积排列只有一种,称为密置层。层与层之间相互叠放在一起,便形成了晶体的堆积模型,如图2所示。
(5)晶体密度的计算方法①以晶胞为研究对象,运用“切割法”分析每个晶胞中含有的微粒数,计算一个晶胞的质量m= (NA为阿伏加德罗常数的值,N为晶胞中所含微粒个数,M为所含微粒的摩尔质量)。②结合晶胞中的几何关系,计算一个晶胞的体积,用m=ρ·V的关系计算。名师点拨由于“自由电子”为整个金属所共有,所以金属键没有饱和性和方向性。金属晶体可以看作等径圆球的堆积。特别提醒(1)金属通常情况下不一定都是晶体,例如汞在常温常压下是液态,不属于晶体。(2)合金也属于金属晶体。
深度思考(1)为什么组成晶体的金属原子在没有其他因素影响时,在空间的排列大都服从紧密堆积原理?
提示 因为在金属晶体中,金属键没有方向性和饱和性,因此都趋向于使金属原子吸引更多的其他原子分布于周围,并以密堆积方式降低体系的能量,使晶体变得比较稳定。
(2)试用“自由电子”解释为什么金属具有良好的延展性、导电性和导热性?
提示 ①当金属受到外力作用时,晶体中的各原子层就会发生相对滑动,但原来的排列方式不变,而且弥漫在金属原子间的“自由电子”可以起到类似轴承中滚珠之间润滑剂的作用,并且“自由电子”没有被破坏,所以金属有良好的延展性;②金属晶体中的“自由电子”在电场中定向移动而形成电流,呈现良好的导电性;③“自由电子”在热的作用下运动时频繁与金属阳离子碰撞,从而引起能量传递,呈现良好的导热性。
拓展延伸金属晶体的配位数金属晶体的配位数是指一个金属阳离子周围最近且距离相等的金属阳离子的数目。例如体心立方晶系 中原子配位数为8,在面心立方最密堆积和六方紧密堆积结构中,取任一金属阳离子为研究对象,在它的同层最近的金属阳离子有6个,上层和下层距离最近的金属阳离子各有3个,故配位数均为12。
正误判断(1)有阳离子的晶体中一定含有阴离子。( )提示 金属晶体中只含有金属阳离子,不存在阴离子。(2)金属晶体和电解质溶液在导电时均发生化学变化。( )提示 金属晶体导电时发生物理变化。(3)金属晶体只有还原性。( )(4)金属晶体的堆积模型与金属原子的半径有关。( )(5)金属能导电,所以金属晶体是电解质。( )提示 电解质必须是化合物,金属是单质,不属于电解质。
探究角度 金属晶体例题 下列叙述中正确的是( )A.金属晶体所有的性质都由金属晶体中金属阳离子跟“自由电子”间的作用强弱决定B.由于金属晶体中“自由电子”的运动,使金属易导电、导热C.由于金属键没有方向性,金属晶体都采用最密堆积方式D.金属晶体都有银白色的金属光泽
解析 金属键的实质是“自由电子”与金属阳离子之间强烈的相互作用,而金属键的强弱决定金属的熔点、硬度等物理性质,不是决定金属晶体所有的性质,故A错误;当金属受热时,“自由电子”与金属阳离子相互碰撞,把能量由温度高处向温度低处传递,使金属易于导热,在外加电场的作用下,金属晶体中的“自由电子”做定向移动而形成电流,表现出良好的导电性,故B正确;金属晶体的堆积方式有简单立方堆积、体心立方堆积、面心立方最密堆积和六方最密堆积等,故C错误;绝大多数金属都有银白色的金属光泽,而少数金属具有其他颜色,如Au呈金黄色,Cu呈紫红色,Cs略带金色,故D错误。
【变式设问】例题中,B项改为“由于金属晶体中‘自由电子’的运动,使金属通常具有良好的延性、展性和可塑性”,说法是否正确?
提示 不正确。在锻压或捶打金属时,密堆积层的金属原子之间比较容易产生滑动,这种滑动不会破坏密堆积的排列方式,而且在滑动过程中“自由电子”能够维系整个金属键的存在,即各层之间始终保持着金属键的作用,因此金属晶体虽然发生了形变但不致断裂。
名师点拨 金属晶体中原子的堆积方式也会影响金属的性质,如具有最密堆积结构的金属的延展性往往比具有其他结构的金属的延展性好。
[对点训练](2024河北遵化高二期末)铜晶体晶胞特征、原子之间相互位置关系的平面图如图所示。若已知铜的原子半径为d cm,NA代表阿伏加德罗常数的值,铜的相对原子质量为64,请回答:(1)铜位于元素周期表的 区,其核外电子所处的最高电子层符号是 。 (2)晶胞中铜原子的配位数为 ,一个晶胞含铜原子的数目为 。 (3)该晶体的密度为 g·cm-3(用字母表示)。
解析 (1)铜位于元素周期表的ⅠB族,在元素周期表的ds区,Cu的核外电子排布式为1s22s22p63s23p63d104s1,核外电子所处的最高电子层符号为N。(2)以顶点处的铜原子为例,与其等距且最近的Cu位于各面的面心,共有12个这样的铜原子,故其配位数为12。
1.离子晶体(1)定义:阴、阳离子在空间呈现 所形成的晶体。 (2)构成微粒: 和 ,离子晶体中不存在单个分子。 (3)微粒间的作用力:离子键。
3.晶格能(1)定义:将 ml离子晶体完全 为气态阴、阳离子所吸收的能量。晶格能通常取正值,单位:kJ·ml-1。 (2)晶格能越大,表示离子间作用力越 ,离子晶体越 。
(3)影响因素 结构类型相同的离子晶体分析下表中是几种离子晶体的晶格能和熔点,总结规律。
晶格能的大小还与离子晶体的结构类型有关规律:上表晶体中,离子半径越小,离子所带电荷越多,晶格能越 ;反之,晶格能越 。
4.离子晶体的一般性质 一般指易溶于水的离子晶体离子晶体一般具有较高的熔点,硬而脆,晶体不导电,熔融状态或溶于水发生电离,形成自由移动的 ,能够 。一般易溶于水,难溶于非极性溶剂。
5.离子晶体的特殊性构成离子晶体的离子可能不是单原子离子,如 、吡啶阳离子( )等阳离子,以及 、CH3COO-、苯甲酸根离子( )等阴离子。由这些离子构成的离子晶体中,随着离子体积的增大,阴、阳离子间的距离增大,离子间的作用力 ,晶体的熔点也随之 。在许多离子晶体中,微粒间的相互作用不再是典型的离子键,而存在 、 等作用力。
名师点拨(1)离子键没有方向性和饱和性,故离子晶体一般采用密堆积方式。(2)离子晶体中不存在分子,化学式只表示晶体中阴、阳离子的最简整数比。(3)离子晶体区别于其他晶体的突出特点是晶体固体时不导电但熔融状态下能导电。而金属晶体无论在固态还是熔融状态都可以导电。拓展延伸离子晶体中某离子周围距离该离子最近的带相反电荷离子的个数,称为该离子的配位数。
深度思考(1)晶格能与晶体的熔点、硬度有怎样的关系?
(2)分析NaCl晶胞,晶体中Na+、Cl-的配位数分别是多少?
(3)分析CaF2晶胞,晶体中Ca2+、F-的配位数分别是多少?阴、阳离子的配位数与阴、阳离子所带的电荷数有什么关系?
提示 结构相似的离子晶体,晶格能越大,形成的离子晶体越稳定,晶体的熔点越高,硬度越大。
提示 在NaCl晶体中,Na+的配位数为6,Cl-的配位数为6,且每个Cl-(Na+)周围的Na+(Cl-)构成正八面体。
提示 Ca2+的配位数是8,F-的配位数是4。阴、阳离子配位数之比等于二者所带电荷数之比。
知识拓展离子液体(1)定义:离子液体是指在室温和接近室温时呈液态的盐类物质,一般由有机阳离子和无机阴离子组成。(2)应用:有机合成和聚合反应、分离提纯以及电化学研究。
正误判断(1)离子晶体一定是离子化合物。( )(2)离子晶体中只含离子键。( )提示 离子晶体中的原子团离子也可以含有共价键,比如NaOH晶体中含有共价键。(3)含有离子的晶体一定是离子晶体。( )提示 金属晶体中含有金属阳离子,并非离子晶体。(4)由金属与非金属形成的晶体,属于离子晶体。( )提示 AlCl3晶体由金属和非金属形成,却属于分子晶体。(5)离子晶体受热熔化,破坏离子键,属于化学变化。( )提示 离子晶体受热熔化,只有离子键的断裂,没有新化学键的形成,不属于化学变化。
探究角度1 离子晶体的性质与判断例1 下列说法正确的是( )A.固态时能导电的晶体一定是金属晶体B.熔融态能导电的晶体一定是离子晶体C.水溶液能导电的晶体一定是离子晶体D.固态不导电而熔融态导电的晶体一定是离子晶体
解析 石墨晶体固态时能导电,但它不是金属晶体,A错误;金属晶体在熔融态也能导电,B错误;AlCl3的水溶液也能导电,但是它属于分子晶体,C错误;离子晶体是由阴、阳离子构成的,固态时阴、阳离子不能自由移动,不导电,而熔融状态时,离子键被破坏,产生自由移动的离子,能够导电,D正确。
复习巩固 (1)属于离子化合物的物质类别:①强碱,②金属氧化物,③金属氢化物,④大多数盐(AlCl3、FeCl3、BeCl2等除外)。(2)能够导电的物质:①导体(如金属单质与石墨晶体),②熔融的离子化合物,③可溶于水的酸、碱、盐溶液。
[对点训练1]下列说法正确的是( )A.含有金属元素化合物的晶体一定属于离子晶体B.ⅠA族和ⅦA族元素的原子化合时,一定形成离子晶体C.有阴离子存在的晶体一定是离子晶体D.完全由非金属元素形成的晶体,一定不属于离子晶体
解析 含有金属元素化合物的晶体也可能是分子晶体,如AlCl3等,A不正确; H与ⅦA族元素的原子化合时不形成离子晶体,B不正确;由于电荷守恒,有阴离子存在的晶体也存在阳离子,这样的晶体属于离子晶体,C正确;NH4Cl为完全由非金属元素形成的离子晶体,D不正确。
【变式设问】C项改为“有阳离子存在的晶体一定是离子晶体”,这种说法是否正确?
提示 不正确。有阳离子存在的晶体也可以是金属晶体,因为金属晶体中存在金属阳离子和自由电子。
探究角度2 常见的离子晶体例2 在NaCl晶体中,晶胞结构如图所示,下列说法不正确的是( )A.一个NaCl晶胞中有4个Na+和4个Cl-B.一个Na+周围最近的Cl-形成正八面体C.一个Na+周围最近的Na+有12个D.NaCl晶体中Na+的配位数为12
共4个Cl-,A正确;在NaCl晶体中,一个Na+周围最近的Cl-有6个,且这6个Cl-形成正八面体,Na+的配位数为6,B正确、D错误;一个Na+周围最近的Na+有12个,C正确。
名师点拨 由NaCl晶胞可以看出,棱上的Na+与面心上的Cl-可以互换位置,体心上的Na+可以与顶点上的Cl-互换位置。同学们应该熟记NaCl晶胞特点,遇见类似NaCl晶胞的晶胞,直接运用NaCl晶胞解决有关问题。
[对点训练2]CaC2晶体的晶胞结构与NaCl晶体的相似(如图所示),但CaC2晶体中由于哑铃形的 存在,使晶胞沿一个方向拉长。下列关于CaC2晶体的说法中正确的是( )A.该晶体中只存在离子键B.该晶体中的阴离子与F2是等电子体C.晶体中Ca2+的配位数为4D.与每个Ca2+距离相等且最近的Ca2+共有12个
学以致用·随堂检测全达标
题组1 金属晶体1.关于金属晶体的下列说法正确的是( )A.常温下金属单质都属于金属晶体B.合金也属于金属晶体C.有金属光泽的晶体一定是金属晶体D.根据晶体能否导电能判断晶体是否属于金属晶体
解析 常温下汞为液态,并非金属晶体,A错误;合金也属于金属晶体,B正确;有金属光泽的晶体不一定是金属晶体,如晶体硅带有金属光泽,C错误;能导电的晶体不一定是金属晶体,如石墨,D错误。
2.Al的晶体中原子的堆积方式如图甲所示,其晶胞特征如图乙所示,原子之间相互位置关系的平面图如图丙所示。
若已知Al的原子半径为d cm,NA代表阿伏加德罗常数的值,Al的相对原子质量为M,请回答:(1)晶胞中一个Al原子周围最近的Al原子个数为 ,一个晶胞中Al原子的数目为 。 (2)该晶体的密度为 (用字母表示)g·cm-3。
解析 (1)由Al晶胞可以看出Al采取面心立方最密堆积方式,故一个Al原子周围最近的Al原子个数为12,即Al的配位数为12;
题组2 离子晶体3.高温下,超氧化钾晶体(KO2)呈立方体结构。如图为超氧化钾晶体的一个晶胞。下列有关说法不正确的是( )
C.KO2中阴、阳离子个数比为1∶1D.晶体中存在离子键和共价键
和钾离子个数比为4∶4=1∶1,故C正确;超氧化钾晶体是离子化合物,阴、阳离子分别为超氧根离子和钾离子,晶体中钾离子和超氧根离子间形成离子键,超氧根离子中氧氧键为非极性键,故D正确。
4.根据表格数据回答下列有关问题:(1)已知NaBr、NaCl、MgO等离子晶体的核间距离和晶格能如下表所示:
①NaBr晶体比NaCl晶体晶格能 (填“大”或“小”),主要原因是 。 ②MgO晶体比NaCl晶体晶格能大,主要原因是 。③NaBr、NaCl和MgO晶体中,熔点最高的是 。
NaBr的离子核间距比NaCl的大
氧化镁晶体中的阴、阳离子所带电荷数更多,并且离子的核间距更小
高中化学第2节 几种简单的晶体结构模型背景图ppt课件: 这是一份高中化学第2节 几种简单的晶体结构模型背景图ppt课件,共45页。PPT课件主要包含了内容索引,知识铺垫,自主梳理,常见的离子晶体,自我检测,答案D,问题探究,归纳拓展,延展性,导热性等内容,欢迎下载使用。
高中化学鲁科版 (2019)选择性必修2第3章 不同聚集状态的物质与性质第2节 几种简单的晶体结构模型教案配套课件ppt: 这是一份高中化学鲁科版 (2019)选择性必修2第3章 不同聚集状态的物质与性质第2节 几种简单的晶体结构模型教案配套课件ppt
2020-2021学年第2节 几种简单的晶体结构模型教课课件ppt: 这是一份2020-2021学年第2节 几种简单的晶体结构模型教课课件ppt













