


还剩6页未读,
继续阅读
所属成套资源:2025年高中化学新人教版选择性必修1课件(38份)
成套系列资料,整套一键下载
2025年高中化学第2章教考衔接1能量_反应过程图示模型及应用课件新人教版选择性必修1
展开
这是一份2025年高中化学第2章教考衔接1能量_反应过程图示模型及应用课件新人教版选择性必修1,共11页。
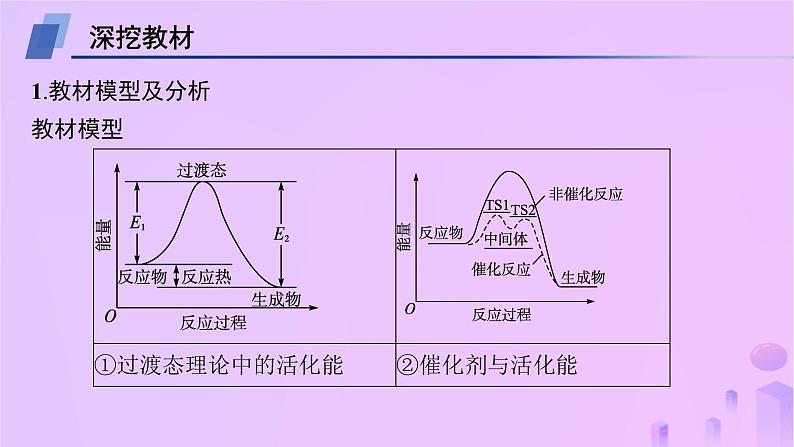
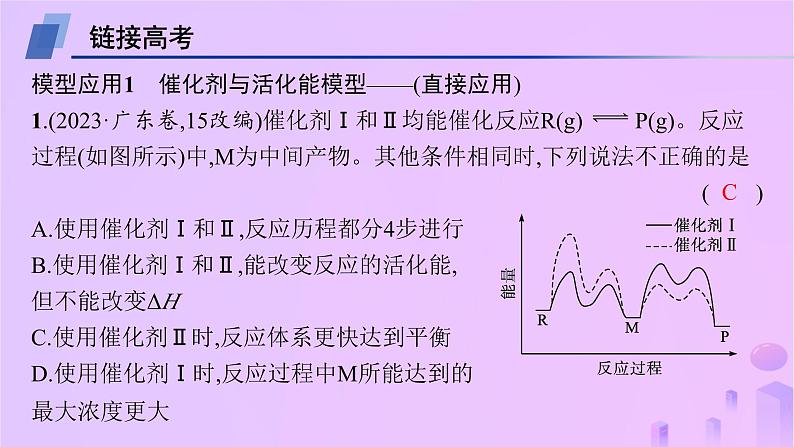
第二章 教考衔接1 能量—反应过程图示模型及应用深挖教材1.教材模型及分析教材模型模型分析(1)过渡态理论中的活化能:①E1为正反应的活化能,E2为逆反应的活化能;②反应热ΔH=E1-E2。(2)催化剂与活化能:①有催化剂参与反应时,活化能较小,反应速率较大;无催化剂参与反应时,活化能较大,反应速率较小;②使用催化剂能降低反应的活化能,但不能改变反应热(ΔH);③TS1、TS2是过渡态,图中包括2个过渡态(“波峰”对应的物质),因此使用催化剂后,反应分两步进行;④图中有1个中间体(“波谷”对应的物质),第一步反应的生成物是第二步反应的反应物。2.模型应用与指导(1)根据过渡态的数目确定使用催化剂时反应历程包含几步反应:过渡态数目(“波峰”对应物质)=分步反应的步数。(2)分步反应中,活化能最大的反应,反应速率最小,是整个反应历程的决速步。(3)可根据物质具有的相对能量判断其稳定性,物质具有的能量越小,该物质越稳定。链接高考模型应用1 催化剂与活化能模型——(直接应用)1.(2023·广东卷,15改编)催化剂Ⅰ和Ⅱ均能催化反应R(g) P(g)。反应过程(如图所示)中,M为中间产物。其他条件相同时,下列说法不正确的是( )A.使用催化剂Ⅰ和Ⅱ,反应历程都分4步进行B.使用催化剂Ⅰ和Ⅱ,能改变反应的活化能,但不能改变ΔHC.使用催化剂Ⅱ时,反应体系更快达到平衡D.使用催化剂Ⅰ时,反应过程中M所能达到的最大浓度更大C解析 两种催化剂均出现四个波峰,故使用催化剂Ⅰ和Ⅱ的反应过程都分4步进行,A正确;使用催化剂Ⅰ和Ⅱ能改变反应的活化能,但不能改变ΔH,B正确;使用催化剂Ⅰ的最高活化能小于使用催化剂Ⅱ的最高活化能,使用催化剂Ⅰ时反应速率更大,反应体系更快达到平衡,C错误;在前两步反应中使用催化剂Ⅰ活化能较低,反应速率较大,后两步反应中使用催化剂Ⅰ活化能较高,反应速率较小,故使用催化剂Ⅰ时,反应过程中M所能达到的最大浓度更大,D正确。解题指导 (1)关键信息:①图中两条曲线均出现4个“波峰”和3个“波谷”;②使用催化剂Ⅱ时,第1步反应的活化能较高;③使用催化剂Ⅰ时,M转化为相邻过渡态时的活化能更大。(2)加工应用:根据过渡态数目确定分步反应的步数,根据活化能大小确定分步反应的速率,再进行相关分析、判断。模型应用2 催化剂与活化能模型——(变形应用)2.(2023·湖北卷,19改编)纳米碗C40H10是一种奇特的碗状共轭体系。高温条件下,C40H10可以由C40H20分子经过连续5步氢抽提和闭环脱氢反应生成。C40H20(g) C40H18(g)+H2(g)的能量变化如下:下列说法不正确的是( )A.反应C40H20(g) ===C40H18(g)+H2(g)的ΔH>0B.图示过程包含3个基元反应C.整个过程的总反应速率由第3步反应决定D解析 由图可知,[C40H20+H·]的能量低于[C40H18+H·+H2]的能量,则反应C40H20(g) ===C40H18(g)+H2(g)是吸热反应,ΔH>0,A正确;图示过程包含3个过渡态,故该反应过程包含3个基元反应,B正确;图中第3步反应的活化能最大,反应速率最小,该反应决定总反应的反应速率,C正确;由于第3步反应速率最小,而前两步反应速率相对较大,可能有大量 聚集,D错误。关键信息 ①图中[C40H20+H·]的能量低于[C40H18+H·+H2]的能量;②图示反应过程中有3个过渡态;③第3步反应的活化能最大,反应速率最小。
第二章 教考衔接1 能量—反应过程图示模型及应用深挖教材1.教材模型及分析教材模型模型分析(1)过渡态理论中的活化能:①E1为正反应的活化能,E2为逆反应的活化能;②反应热ΔH=E1-E2。(2)催化剂与活化能:①有催化剂参与反应时,活化能较小,反应速率较大;无催化剂参与反应时,活化能较大,反应速率较小;②使用催化剂能降低反应的活化能,但不能改变反应热(ΔH);③TS1、TS2是过渡态,图中包括2个过渡态(“波峰”对应的物质),因此使用催化剂后,反应分两步进行;④图中有1个中间体(“波谷”对应的物质),第一步反应的生成物是第二步反应的反应物。2.模型应用与指导(1)根据过渡态的数目确定使用催化剂时反应历程包含几步反应:过渡态数目(“波峰”对应物质)=分步反应的步数。(2)分步反应中,活化能最大的反应,反应速率最小,是整个反应历程的决速步。(3)可根据物质具有的相对能量判断其稳定性,物质具有的能量越小,该物质越稳定。链接高考模型应用1 催化剂与活化能模型——(直接应用)1.(2023·广东卷,15改编)催化剂Ⅰ和Ⅱ均能催化反应R(g) P(g)。反应过程(如图所示)中,M为中间产物。其他条件相同时,下列说法不正确的是( )A.使用催化剂Ⅰ和Ⅱ,反应历程都分4步进行B.使用催化剂Ⅰ和Ⅱ,能改变反应的活化能,但不能改变ΔHC.使用催化剂Ⅱ时,反应体系更快达到平衡D.使用催化剂Ⅰ时,反应过程中M所能达到的最大浓度更大C解析 两种催化剂均出现四个波峰,故使用催化剂Ⅰ和Ⅱ的反应过程都分4步进行,A正确;使用催化剂Ⅰ和Ⅱ能改变反应的活化能,但不能改变ΔH,B正确;使用催化剂Ⅰ的最高活化能小于使用催化剂Ⅱ的最高活化能,使用催化剂Ⅰ时反应速率更大,反应体系更快达到平衡,C错误;在前两步反应中使用催化剂Ⅰ活化能较低,反应速率较大,后两步反应中使用催化剂Ⅰ活化能较高,反应速率较小,故使用催化剂Ⅰ时,反应过程中M所能达到的最大浓度更大,D正确。解题指导 (1)关键信息:①图中两条曲线均出现4个“波峰”和3个“波谷”;②使用催化剂Ⅱ时,第1步反应的活化能较高;③使用催化剂Ⅰ时,M转化为相邻过渡态时的活化能更大。(2)加工应用:根据过渡态数目确定分步反应的步数,根据活化能大小确定分步反应的速率,再进行相关分析、判断。模型应用2 催化剂与活化能模型——(变形应用)2.(2023·湖北卷,19改编)纳米碗C40H10是一种奇特的碗状共轭体系。高温条件下,C40H10可以由C40H20分子经过连续5步氢抽提和闭环脱氢反应生成。C40H20(g) C40H18(g)+H2(g)的能量变化如下:下列说法不正确的是( )A.反应C40H20(g) ===C40H18(g)+H2(g)的ΔH>0B.图示过程包含3个基元反应C.整个过程的总反应速率由第3步反应决定D解析 由图可知,[C40H20+H·]的能量低于[C40H18+H·+H2]的能量,则反应C40H20(g) ===C40H18(g)+H2(g)是吸热反应,ΔH>0,A正确;图示过程包含3个过渡态,故该反应过程包含3个基元反应,B正确;图中第3步反应的活化能最大,反应速率最小,该反应决定总反应的反应速率,C正确;由于第3步反应速率最小,而前两步反应速率相对较大,可能有大量 聚集,D错误。关键信息 ①图中[C40H20+H·]的能量低于[C40H18+H·+H2]的能量;②图示反应过程中有3个过渡态;③第3步反应的活化能最大,反应速率最小。
相关资料
更多









