





初中化学鲁教版九年级下册第八单元 海水中的化学第二节 海水“晒盐“备课ppt课件
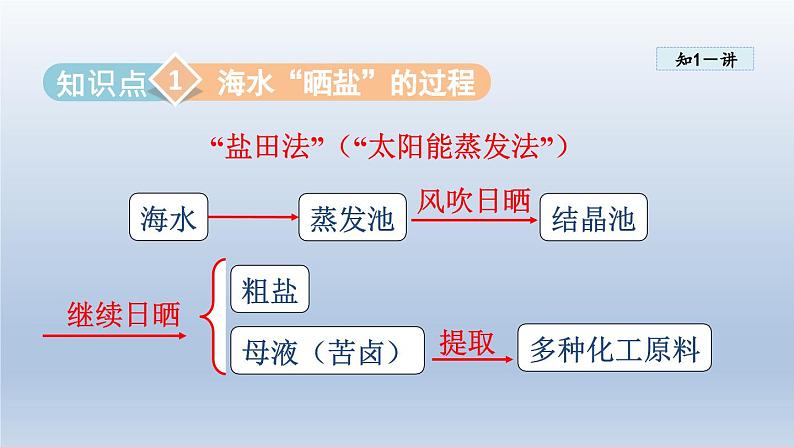
展开海水“晒盐”的过程粗盐的提纯
“盐田法”(“太阳能蒸发法”)
取少许不饱和氯化钠溶液,滴在洁净的玻璃片上, 用电热吹风机向玻璃片上的溶液吹热风,观察现象。
哪些自然条件有利于海水“晒盐”?为什么?
这些条件有利于加速水分的蒸发
气候温和、光照充足、大片平坦的海边滩涂
【节选·天津】(双选)如图所示是利用海水提取粗盐的过程。根据海水晒盐的原理,下列说法中正确的是( )A. 海水进入贮水池, 海水的成分基本不变B. 在蒸发池中, 海水中氯化钠的质量逐渐增加C. 在蒸发池中, 海水中水的质量逐渐增加D. 析出晶体后的母液是氯化钠的饱和溶液
1. 使一杯接近饱和的硝酸钾溶液变饱和,下列措施中错误的是( )A. 加入适量的硝酸钾固体 B. 蒸发掉一部分水C. 降温至有固体析出 D. 升高温度
向盛有20℃水的烧杯中加入NaCl,向盛有40℃等量水的烧杯中加入KNO3都达到饱和状态。比较NaCl与KNO3溶解的量,并讨论能否在该条件下定量地比较二者的溶解能力?
向40g20℃水中加入NaCl,向100g20℃水中加入KNO3,都达到饱和状态。比较它们溶质的量,讨论能否在该条件下定量地比较二者的溶解能力?
向100g20℃水中加入NaCl直到饱和,向100g20℃水中加入KNO3配制成不饱和溶液。比较二者溶解的量,讨论能否在该条件下定量地比较出二者的溶解能力?
1.概念: 在一定温度下,某固态物质在100g溶剂里达到饱和状态时所溶解的质量,叫做这种物质在这种溶剂里的溶解度。
理解了溶解度的概念,那你了解平时所说的“易溶”、“难溶”与溶解度的关系吗?
[中考·武汉] 20 ℃时,氯化钠的溶解度为36 g。对这句话理解错误的是( )A. 20 ℃时,100 g 水中最多能溶解氯化钠36 gB. 20 ℃时,100 g 氯化钠饱和溶液中含氯化钠36 gC. 20 ℃时,氯化钠饱和溶液中水与氯化钠的质量比为100 ∶ 36D. 20 ℃时,将36 g 氯化钠溶解于100 g 水中,所得溶液为该温度下氯化钠的饱和溶液
解题秘方:本题可运用内涵分析法解答,解题的关键是把握好溶解度概念中的四要素:条件(一定温度)、溶剂标准(100 g)、溶液的状态(饱和)、溶解的溶质质量(单位:g)。解:根据溶解度的概念,20 ℃时,100 g 水中最多能溶解氯化钠36 g,所得溶液为饱和溶液,其中水与氯化钠的质量比为100 ∶ 36;100 g 为溶剂的质量,而不是溶液的质量。
1.【中考•福建】某同学模拟化学家侯德榜的“侯氏制碱法”制纯碱,需用 50.0 g 水配制 20 ℃的 NaCl 饱和溶液(20 ℃时 NaCl 的溶解度为 36.0 g),应称取 NaCl 的质量为( )A.18.0 g B.16.0 g C.13.2 g D.11.5 g
打开汽水盖时,汽水会自动喷出来。这说明气体在水中的溶解度与什么有关?
喝了汽水以后,常常会打嗝。这说明气体的溶解度还与什么有关?
气体溶解度的影响因素:气体溶解度一般随压强增大而增大,随压强减小而减小。气体溶解度一般随温度升高而减小,随温度降低而增大。
生活中的下列现象,不能说明气体的溶解度随温度变化而变化的是( )A.夏季,鱼塘中的鱼常常会浮在水面呼吸B.喝了汽水以后,常常会打嗝C.打开汽水瓶盖,有大量气泡冒出D.烧开水时,沸腾前水中有气泡产生
导引:夏季温度高,水中溶解的氧气量减少,鱼会浮出水面呼吸;喝了汽水后会打嗝,是因为温度升高,气体溶解度减小;烧开水时,温度升高,气体溶解度减小,原来溶解的气体会逸出,产生气泡。打开汽水瓶盖,有大量气泡冒出,是因为压强减小,气体的溶解度减小。
6.佛山市三水健力宝生产的魔水驰名中外,魔水内溶有一定量的二氧化碳气体,打开瓶塞,魔水会自动喷出,喝了魔水后常会打嗝。说明气体在水中的溶解度与压强、温度有关。以下关于气体溶解度的说法正确的是( )A.压强增大,气体溶解度不变B.压强减小,气体溶解度增大C.温度升高,气体溶解度减小D.温度降低,气体溶解度减小
溶解度的表示方法:表格法、列表法:
硝酸钾在不同温度时的溶解度:
列表法表示溶解度不直观,不能表示物质在任意温度时的溶解度,也不能直观表示某物质溶解度随温度变化的趋向,有没有其他表示溶解度的方法呢?
[中考·青岛] 如图6 是氯化钠、硝酸钾两种物质的溶解度曲线。下列说法正确的是( )A. 硝酸钾的溶解度大于氯化钠的溶解度B. 50 ℃时,将45 g 硝酸钾固体加入50 g 水中,充分搅拌,得到95 g 溶液C. 50 ℃时,将等质量的硝酸钾、氯化钠两种固体分别配制成饱和溶液,需要水的质量硝酸钾比氯化钠少D. 分别将50 ℃的硝酸钾、氯化钠的饱和溶液降温至20 ℃,硝酸钾溶液析出的固体多
解题秘方:解答有关溶解度曲线的问题时应运用图示分析法,通过分析溶解度曲线上点、线等的意义。解:未指明温度,不能比较溶解度大小,A 错误;50 ℃时,硝酸钾的溶解度是85.5 g,将45 g 硝酸钾固体加入50 g 水中,充分搅拌,得到溶液的质量=42.75 g+50 g=92.75 g,B 错误;
50 ℃时,硝酸钾的溶解度比氯化钠大,将等质量的硝酸钾、氯化钠两种固体分别配制成饱和溶液,需要水的质量硝酸钾比氯化钠少,C 正确;分别将50 ℃的硝酸钾、氯化钠的饱和溶液降温至20 ℃,硝酸钾溶液析出的固体不一定多,因为没有指明饱和溶液的质量,D 错误。
1.【中考•衡阳】如图是a、b、c三种固体物质的溶解度曲线图,请回答下列问题:(1)t1℃时,a、b、c三种物质中,溶解度由大到小的顺序是 ____________________________。
(2)将c物质的不饱和溶液转变成饱和溶液可采取的方法有 _______________________ (写出一种即可)。 (3)t2℃时,将30 g a物质加入50 g水中充分溶解后,所得溶液的质量是 ________ g。(4)图中P点所表示的意义是_____________________________。
t1 ℃时,a、c物质的溶解度相等
加溶质或蒸发溶剂或升温
粗盐经溶解、沉淀、过滤、蒸发,可制得精盐。
1、蒸发过程中要不断用玻璃棒搅拌2、有大量晶体析出时,就停止加热,利用余热蒸干
使液体受热均匀,防止飞溅
NaClMgCl2 CaCl2 Na2SO4溶液
NaCl、MgCl2 CaCl2 、剩余BaCl2
NaCl、CaCl2剩余 NaOH、BaCl2
MgCl2、CaCl2、Na2SO4等
NaCl、剩余NaOH、Na2CO3
CaCO3 ↓ BaCO3 ↓
[中考·巴中 ] 某化学兴趣小组的同学做粗盐提纯实验,如图所示是同学们做粗盐提纯实验的示意图,请回答下列问题:
(1)操作③中玻璃棒搅拌的作用是____________________。(2)操作⑥中的错误是__________________。
(3)粗盐提纯实验中的操作顺序为_____________(填操作序号),以及称量精盐并计算产率。(4)操作④中,当观察到蒸发皿内__________________时,停止加热,利用余热蒸干剩余液体。
导引:(1)操作③是溶解操作,玻璃棒的作用是加快粗盐的溶解速率;(2)操作⑥是过滤操作,图中直接倾倒待过滤液,没有用玻璃棒引流;(3)粗盐提纯的步骤为:称量、溶解、过滤(把不溶物除去)、蒸发(得到食盐晶体)、称量精盐、计算产率,操作的先后顺序是①⑤②③⑥④;(4)蒸发时,待蒸发皿中出现较多量的固体时,即停止加热,利用余热将剩余液体蒸干。
〈荆州〉为了除去粗盐中的Ca2+、Mg2+、SO42-和泥沙,可将粗盐溶于水,然后进行下列五项操 作:①过滤;②加过量的NaOH溶液;③加适量的盐酸;④加过量的Na2CO3溶液;⑤加过量的BaCl2溶液。下列操作顺序中最合适的是( )A.②④⑤①③ B.⑤④②③①C.⑤②④③① D.②⑤④①③
导引:首先选择合适的物质除去杂质,如除SO42-可加入BaCl2溶液;加入NaOH溶液除Mg2+;加入Na2CO3溶液除Ca2+。由于为除尽杂质,加入的试剂都是过量的,会带来新的杂质Ba2+、OH-、CO32-。BaCl2 能与 Na2CO3反应产生沉淀,因此需先加 BaCl2 溶液,后加 Na2CO3 溶液 , 这样可以利用Na2CO3 除去 Ca2+ 及过量的 Ba2+。沉淀完全后再进行过滤,往滤液中再加入适量的盐酸除去过量的 OH- 和 CO32-,综上所述,应选 D。
1.【中考·广西】粗盐中含有少量的MgCl2、CaCl2、Na2SO4等杂质,为了将杂质除干净,先向粗盐溶液中分别加入过量的①NaOH ②Na2CO3 ③BaCl2溶液,过滤,再加入④稀盐酸,使溶液的pH=7,将最后所得溶液进行蒸发可得到精 盐。加入溶液的先后顺序错误的是( )A.②③①④ B.③②①④C.①③②④ D.③①②④
2.【中考•绥化】海洋中有丰富的水生生物和化学资源。海水晒盐能得到粗盐和苦卤,粗盐中含有多种可溶性杂质(氯化镁、氯化钙等)和不溶性杂质(泥沙等)。请回答下列问题。
(1)蒸发过程中要用到玻璃棒,其作用是________________________________________________________。
搅拌,使液体受热均匀,防止局部温度过高,造成液滴飞溅
鲁教版九年级下册第八单元 海水中的化学第二节 海水“晒盐“课堂教学ppt课件: 这是一份鲁教版九年级下册第八单元 海水中的化学第二节 海水“晒盐“课堂教学ppt课件,共25页。PPT课件主要包含了饱和溶液,不饱和溶液,实验探究,溶质种类和水的质量,溶质种类的影响,温度的影响,四要素,条件在一定温度下,状态达到饱和状态,单位克等内容,欢迎下载使用。
初中化学鲁教版九年级下册第二节 海水“晒盐“背景图课件ppt: 这是一份初中化学鲁教版九年级下册第二节 海水“晒盐“背景图课件ppt,共18页。PPT课件主要包含了粗盐提纯考题分析,我的分享思维导图,我的完善思维导图,解题技巧,当堂检测,课后反思与总结等内容,欢迎下载使用。
2021学年第二节 海水“晒盐“备课ppt课件: 这是一份2021学年第二节 海水“晒盐“备课ppt课件,共24页。PPT课件主要包含了动动手,海水晒盐,蒸发池,结晶池,--蒸发结晶法,实验过程,粗盐提纯,实验室提纯,玻璃棒,操作要点等内容,欢迎下载使用。













