
专题10 化学工艺流程(题型突破)(测试)-2024年高考化学二轮复习讲练测(新教材新高考)(原卷版)
展开
这是一份专题10 化学工艺流程(题型突破)(测试)-2024年高考化学二轮复习讲练测(新教材新高考)(原卷版),共10页。试卷主要包含了选择题,非选择题等内容,欢迎下载使用。
一、选择题(本题共15小题,每小题3分,共45分。每小题只有一项是符合题目要求的)
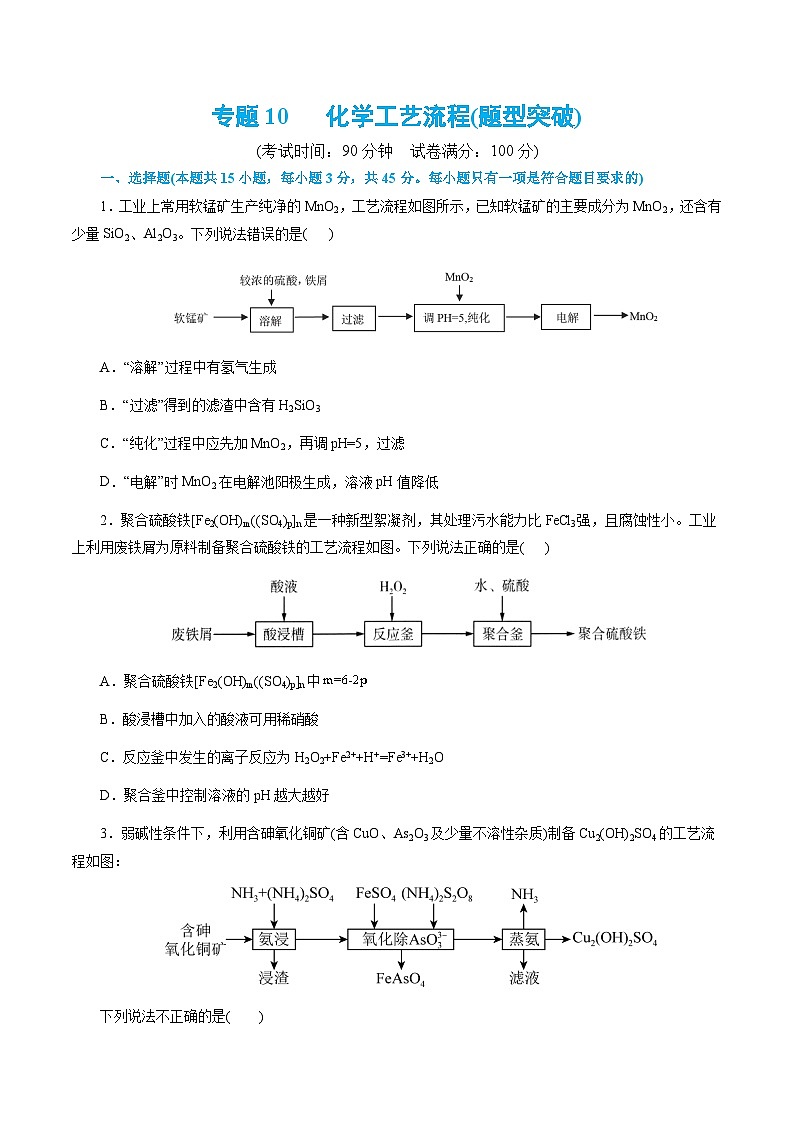
1.工业上常用软锰矿生产纯净的MnO2,工艺流程如图所示,已知软锰矿的主要成分为MnO2,还含有少量SiO2、Al2O3。下列说法错误的是( )
A.“溶解”过程中有氢气生成
B.“过滤”得到的滤渣中含有H2SiO3
C.“纯化”过程中应先加MnO2,再调pH=5,过滤
D.“电解”时MnO2在电解池阳极生成,溶液pH值降低
2.聚合硫酸铁[Fe2(OH)m((SO4)p]n是一种新型絮凝剂,其处理污水能力比FeCl3强,且腐蚀性小。工业上利用废铁屑为原料制备聚合硫酸铁的工艺流程如图。下列说法正确的是( )
A.聚合硫酸铁[Fe2(OH)m((SO4)p]n中
B.酸浸槽中加入的酸液可用稀硝酸
C.反应釜中发生的离子反应为H2O2+Fe2++H+=Fe3++H2O
D.聚合釜中控制溶液的pH越大越好
3.弱碱性条件下,利用含砷氧化铜矿(含CuO、As2O3及少量不溶性杂质)制备Cu2(OH)2SO4的工艺流程如图:
下列说法不正确的是( )
A.“氨浸”时As2O3发生的离子反应为:As2O3+6NH3+3H2O=6NH4++ 2AsO33-
B.“氨浸”时CuO转化为[Cu(NH3)4]2+
C.“氧化除As2O3”时每生成1 ml FeAsO4,转移的电子数目为6.02×1023
D.“蒸氨”后滤液中主要存在的离子为:NH4+、SO42-
4.碱式碳酸锌可被用于皮肤保护剂、饲料添加剂等,以锌焙砂(主要成分为ZnO及少量Cu2+、Mn2+的化合物)为原料制备碱式碳酸锌的工艺流程如图所示,下列说法错误的是( )
A.“酸浸”前将锌焙砂粉碎可提高酸浸速率与原料的利用率
B.“氧化”过程中,消耗的氧化剂与还原剂物质的量之比为2∶1
C.“沉铜”过程中反应的离子方程式为ZnS(s)+Cu2+(aq)Zn2+(aq)+ CuS(s)
D.碱式碳酸锌可与盐酸反应,其加热灼烧时可得到ZnO
5.氨既是一种重要的化工产品,又是一种重要的化工原料。如图为合成氨以及氨氧化制硝酸的流程示意图。下列说法不正确的是( )
A.合成塔内发生的反应中有非极性键的断裂和极性键的生成
B.氧化炉内发生的反应氧化剂与还原剂的物质的量之比为5∶4
C.使用溶液吸收尾气中的氮氧化物,和NO2是酸性氧化物
D.向吸收塔中通入O2的作用是氧化
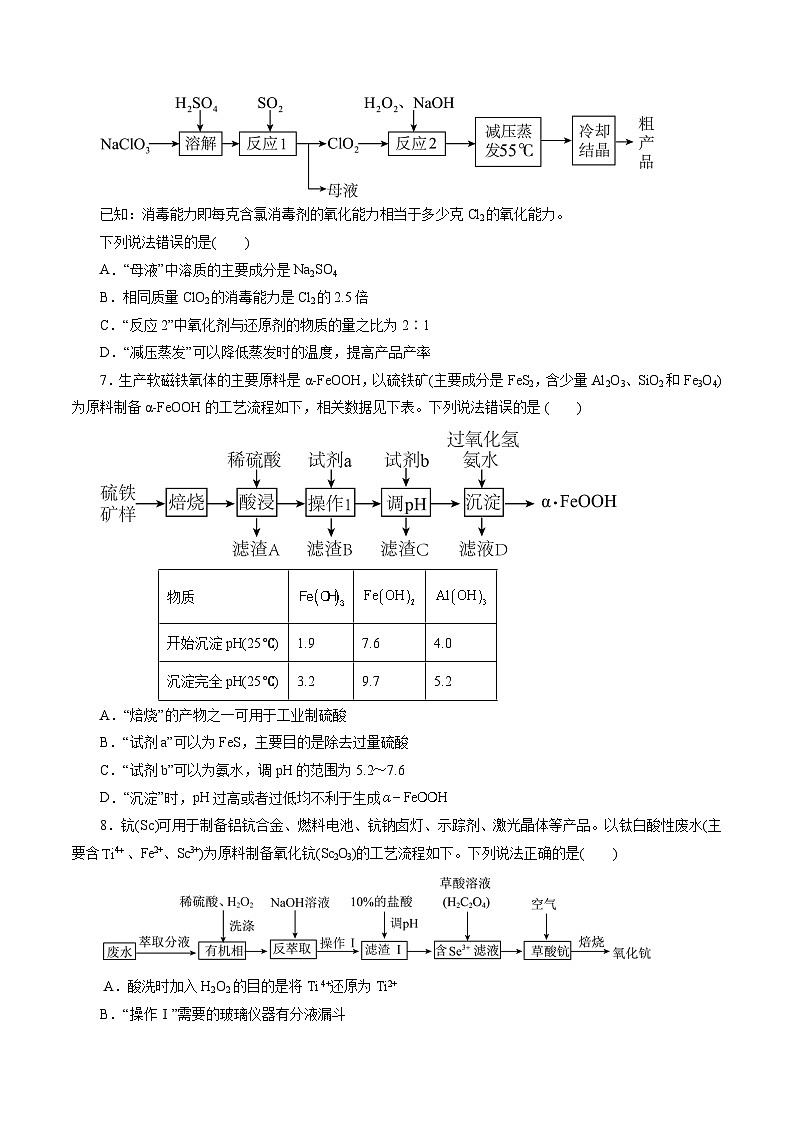
6.化学工业为疫情防控提供了强有力的物质支撑。亚氯酸钠(NaClO2)具有强氧化性,受热易分解,可作漂白剂、食品消毒剂等,以氯酸钠等为原料制备亚氯酸钠的工艺流程如下图所示。
已知:消毒能力即每克含氯消毒剂的氧化能力相当于多少克Cl2的氧化能力。
下列说法错误的是( )
A.“母液”中溶质的主要成分是Na2SO4
B.相同质量ClO2的消毒能力是Cl2的2.5倍
C.“反应2”中氧化剂与还原剂的物质的量之比为2∶1
D.“减压蒸发”可以降低蒸发时的温度,提高产品产率
7.生产软磁铁氧体的主要原料是α-FeOOH,以硫铁矿(主要成分是FeS2,含少量Al2O3、SiO2和Fe3O4)为原料制备α-FeOOH的工艺流程如下,相关数据见下表。下列说法错误的是 ( )
A.“焙烧”的产物之一可用于工业制硫酸
B.“试剂a”可以为FeS,主要目的是除去过量硫酸
C.“试剂b”可以为氨水,调pH的范围为5.2~7.6
D.“沉淀”时,pH过高或者过低均不利于生成
8.钪(Sc)可用于制备铝钪合金、燃料电池、钪钠卤灯、示踪剂、激光晶体等产品。以钛白酸性废水(主要含、Fe2+、Sc3+)为原料制备氧化钪(Sc2O3)的工艺流程如下。下列说法正确的是( )
A.酸洗时加入H2O2的目的是将Ti 4+还原为Ti2+
B.“操作Ⅰ”需要的玻璃仪器有分液漏斗
C.“滤渣Ⅰ”的主要成分是Ti (OH)4、Fe(OH)3
D.草酸钪焙烧时反应的化学方程式:2Sc2(C2O4)3+3O22Sc2O3+12CO2
9.高铁酸钾(K2FeO4)具有杀菌消毒及净水作用,某实验小组在碱性条件下制备K2FeO4流程如图所示:
下列说法错误的是( )
A.1mlK2FeO4消毒能力相当于1.5ml HClO
B.氧化反应:3NaClO+2Fe(NO3)3+10 NaOH=2Na2FeO4+3NaCl+6 NaNO3+5H2O
C.同温度时高铁酸钠溶解度大于高铁酸钾
D.提纯时,应用到的玻璃仪器有蒸发皿、玻璃棒、烧杯、酒精灯
10.硫代硫酸钠晶体(Na2S2O3·5H2O)不溶于乙醇,可用作纸浆漂白时的脱氯剂等。用工业硫化钠(主要成分Na2S,含少量Na2SO4 )及纯碱等为原料制备Na2S2O3·5H2O的流程如下:
下列说法正确的是( )
A.Na2S2O3作脱氯剂时主要利用其氧化性
B.“净化”时加入的试剂X可选用BaCl2溶液
C.“反应”过程中体系pH大小对产品产率无影响
D.提纯Na2S2O3·5H2O时,应先用水洗,再用乙醇洗涤
11.为研究废旧电池的再利用,实验室利用旧电池的铜帽(主要成分为Zn和Cu)回收Cu并制备ZnO的部分实验过程如图所示。下列叙述错误的是( )
A.“溶解” 操作中溶液温度不宜过高
B.铜帽溶解后,将溶液加热至沸腾以除去溶液中过量的氧气或H2O2
C.过滤后滤液中只有ZnSO4
D.本流程涉及置换反应
12.锂被誉为“高能金属”,废旧锂离子电池的正极材料主要含有LiCOO2及少量Al,Fe等,处理该废料的一种工艺流程如图所示:
已知LiCOO2难溶于水,具有强氧化性。下列说法正确的是( )
A.滤液1中含有的阳离子主要是Al3+和Na+
B.“还原”时,参加反应n(CO3+):n(SO32-)=2:1
C.“沉钴”离子方程式为CO2++HCO3-= COCO3↓+H+
D.滤渣主要是Fe(OH)3,滤液2中仅含有一种溶质
13.下图是以市售铁屑(含少量锡、氧化铁等杂质)为原料生产纯净绿矾的一种方法:
已知:室温饱和H2S溶液的pH的为3.9,SnS沉淀完全时溶液的pH为1.6,FeS开始沉淀时溶液的pH为3.0,沉淀完全时的pH为5.5
根据以上流程图。下列说法错误的是( )
A.“溶解”中用到25%的稀硫酸,可用98%浓硫酸配制,需玻璃棒、烧杯、量筒、胶头滴管等仪器
B.操作II中用硫酸酸化至pH=2的主要目的是抑制Fe2+的水解
C.操作II中,通入H2S至饱和的目的之一是防止Fe2+被氧化
D.操作IV中所得的晶体最后用乙醇洗去晶体表面附着的水分
14.某废催化剂主要含Al、Ni、M(钼)等的氧化物,回收利用其金属资源的流程如下:
已知:碱性条件下,M元素以MO42-的形态存在;Ksp(BaMO4)=3.5×10-8。
下列有关说法不正确的是( )
A.焙烧时,Al2O3与NaOH反应的化学方程式为Al2O3+2NaOH2NaAlO2+H2O
B.水浸时,控制适当温度并不断搅拌,有利于提高铝、钼浸取率
C.沉铝后,过滤所得滤渣的主要成分是Al(OH)3
D.沉钼后,过滤所得滤液中不存在MO42-
15.某废矿渣的主要成分有FeO、NiO、Al2O3、SiO2,为节约和充分利用资源,通过如图工艺流程回收铁、镍。下列说法错误的是( )
已知:ⅰ.常温下,Ksp(NiCO3)=1.4×10-7;Ksp[Ni(OH)2]=1.0×10-15。
ⅱ.“萃取”可将金属离子进行富集与分离,原理如下:X2+(水相)+2RH(有机相) XR2(有机相)+2H+(水相)。
A.滤液①中,主要存在的钠盐有NaAlO2、Na2SiO3
B.“反萃取”应控制在酸性环境进行
C.“沉镍”过程中反应方程式为:Ni2++2HCO3-=NiCO3↓+CO2↑+H2O,“沉镍”时若溶液pH越大,越能充分吸收二氧化碳,NiCO3的产率越高
D.已知“水相”中c(Ni2+)=2×10-2ml•L-1,加NaHCO3“沉镍”,当沉镍率达到99%时,溶液中c(CO32-)=7×10-4ml•L-1
二、非选择题(本题包括4小题,共55分)
16.(12分)钒(V)是一种重要的金属,有金属“维生素”之称,用途涵盖了航空航天、电池、光学、医药等众多领域,主要由五氧化二钒冶炼得到。某种由钒精矿(含V2O5及少量MgO、SiO2等杂质)提取五氧化二钒的工艺流程如下图所示。
【资料】+5价钒在溶液中的主要存在形式与溶液pH的关系:
(1)钒精矿磨细的目的是_______,浸出液中含有钒酸钠(Na3VO4)。VO43-与PO43-的空间构型相同,键角的大小为_______。
(2)用硫酸缓慢调节浸出液的pH为7,得到净化液中主要的阴离子是_______。
(3)氨化沉钒:将净化液中的钒转化为NH4VO3固体,其流程如下。
向(NH4)3VO4溶液中加入NH4Cl溶液的目的:_______。
(4)煅烧2.340g偏钒酸铵(NH4VO3,摩尔质量为117g/ml)时,其固体质量的减少量随温度变化的曲线如图所示:
100~200℃时产生的一种气体的化学式为_______,300~350℃时发生反应的化学方程式为_______。
17.(13分)聚合硫酸铁(Ⅲ)[Fe2(OH)x(SO4)y]n是一种新型,优质、高效铁盐类无机高分子絮凝剂,极易溶于水,广泛应用于饮用水、各种工业废水、城市污水、污泥脱水等的净化处理。工业上用高硫铝土矿(主要成分为Fe2O3、Al2O3、SiO2,少量FeS2)为原料制备聚合硫酸铁的部分工艺流程如下:
(1)写出焙烧产生的SO2气体在工业上的一种用途_______。
(2)“滤液”中存在的阴离子主要为OH-及_______(填离子符号)。
(3)氧化过程中加入双氧水的目的为_______,实际生产过程中温度不宜过高且要控制H2O2的投加速度,其原因为_______。
(4)在焙烧时若通入的空气量不足,Fe2O3与FeS2之间可以反应生成Fe3O4和SO2、Fe2O3与FeS2之间反应时理论上完全反应消耗的n(FeS2):n(Fe2O3)=_______。
(5)加入试剂A的目的是通过调节pH促进聚合物的形成,所加试剂A为_______(填化学式),溶液的pH对[Fe2(OH)x(SO4)y]n中x的值有较大影响(如下图所示),试分析pH过大(pH>3.0)导致聚合硫酸铁中x的值减小的原因_______。
(6)聚合硫酸铁虽广泛应用于各类水的净化处理,但是实际使用过程中发现该絮凝剂对铁质输送管道和容器比明矾的腐蚀性更强,这是由于该絮凝剂水解程度大,产生的氢离子浓度更大、腐蚀作用更强,同时还有另一离子也具有腐蚀性,该离子发生腐蚀的离子方程式为_______。
18.(15分)金属铅具有广泛用途,其提取根据工艺差异分为火法炼铅和湿法炼铅。
[火法炼铅]以铅精矿(主要成分为PbS)为原料制备金属Pb,其工艺流程如下:
(1)“氧化脱硫”时,反应温度为1100℃,生成PbO和SO2,该反应的化学方程式为_________。
(2)下列金属冶炼方法正确且与本工艺“冶炼”的方法相似的是_________(填标号)。
A.电解熔融NaCl制钠 B.铝热反应制铝 C.高炉炼铁D.氧化汞分解制汞
(3)由以上信息可得,火法炼铅工艺的主要不足为_________(任写一条)。
[湿法炼铅]以锌浸出渣(主要成分为PbSO4,还含有PbO和ZnFe2O4)为原料制备金属Pb,其工艺流程如下:
已知:①“碱浸”时,ZnFe2O4与NaOH反应生成Na2ZnO2和H2O,还有一种氧化物;
②“碱浸”后,铅主要以[Pb(OH)3]-的形式存在溶液中。
(4)“碱浸”时,PbSO4发生反应的离子方程式为_________。
(5)“浸渣”的主要成分为_________(填化学式)。
(6)“碱浸”液经处理后所得溶液[、]用于“沉铅”。
①“沉铅”时,理论上,当PbS完全沉淀时,ZnS_________(是或否)开始沉淀,通过计算说明_________[已知:、]。
②“滤液”中主要含有的金属阳离子有_________。
19.(15分)工业利用闪锌矿(主要成分ZnS,还含有FeS、CuFeS2、石英及F-、Cl -等杂质)富氧酸浸提取锌,同时实现环保除铁的工艺流程如下:
已知:①酸性条件下,亚铜离子易发生歧化反应;
②CaF2易形成胶体。
回答下列问题:
(1)“浸出”过程原理如图1a所示,ZnS “浸出”的总反应的化学方程式为___________。对比人造闪锌矿浸出原理(如图1b所示),可知“浸出”过程中Fe2+的作用为___________。
(2)“滤渣1”主要成分为___________。
(3)“加热加压氧化”发生反应的离子方程式为___________。
(4)“电积”时,F-、Cl -会腐蚀电极板,需提前除净。
①“脱氯”时,脱氯率随时间变化如图2,约后脱氯率减小的原因可能为___________。物质
开始沉淀pH(25℃)
1.9
7.6
4.0
沉淀完全pH(25℃)
3.2
9.7
5.2
PH
4~6
6~8
8~10
10~12
主要离子
相关试卷
这是一份专题10 化学工艺流程(题型突破)(练习)-2024年高考化学二轮复习讲练测(新教材新高考),共24页。
这是一份专题14 有机合成与推断(题型突破)(练习)-2024年高考化学二轮复习讲练测(新教材新高考)(原卷版),共13页。
这是一份专题12 物质结构与性质综合(题型突破)(测试)-2024年高考化学二轮复习讲练测(新教材新高考)(原卷版),共7页。试卷主要包含了选择题,非选择题等内容,欢迎下载使用。









