
2024届河北省保定市九县一中高三下学期三模化学试题(原卷版+解析版)
展开
这是一份2024届河北省保定市九县一中高三下学期三模化学试题(原卷版+解析版),共34页。试卷主要包含了可能用到的相对原子质量, 下列装置能达到实验目的的是, 下列离子方程式书写正确的是等内容,欢迎下载使用。
注意事项:
1.答题前,考生务必将自己的姓名、考生号、考场号、座位号填写在答题卡上。
2.回答选择题时,选出每小题答案后,用铅笔把答题卡上对应题目的答案标号涂黑。如需改动,用橡皮擦干净后,再选涂其他答案标号。回答非选择题时,将答案写在答题卡上。写在本试卷上无效。
3.考试结束后,将本试卷和答题卡一并交回。
4.可能用到的相对原子质量:H 1 N 14 O 16 Si 28 Cl 35.5 C 59 Ni 59
一、选择题:本题共14小题,每小题3分,共42分。在每小题给出的四个选项中,只有一项是符合题目要求的。
1. 酒文化是中国传统文化的重要组成部分。热播节目《诗词大会》深受中外观众青睐,下列古诗中不涉及“酒”的是
A. 爆竹声中一岁除,春风送暖入屠苏B. 投泥泼水愈光明,烁玉流金见精悍
C. 叹息风流今未泯,两川名酝避鹅黄D. 兰陵美酒郁金香,玉碗盛来琥珀光
2. 下列化学用语表示错误的是
A. 2-氨基戊酸的结构简式:
B. HCHO分子的球棍模型:
C. 分子中 σ键形成过程:
D. 基态Ge原子的价层电子排布图:
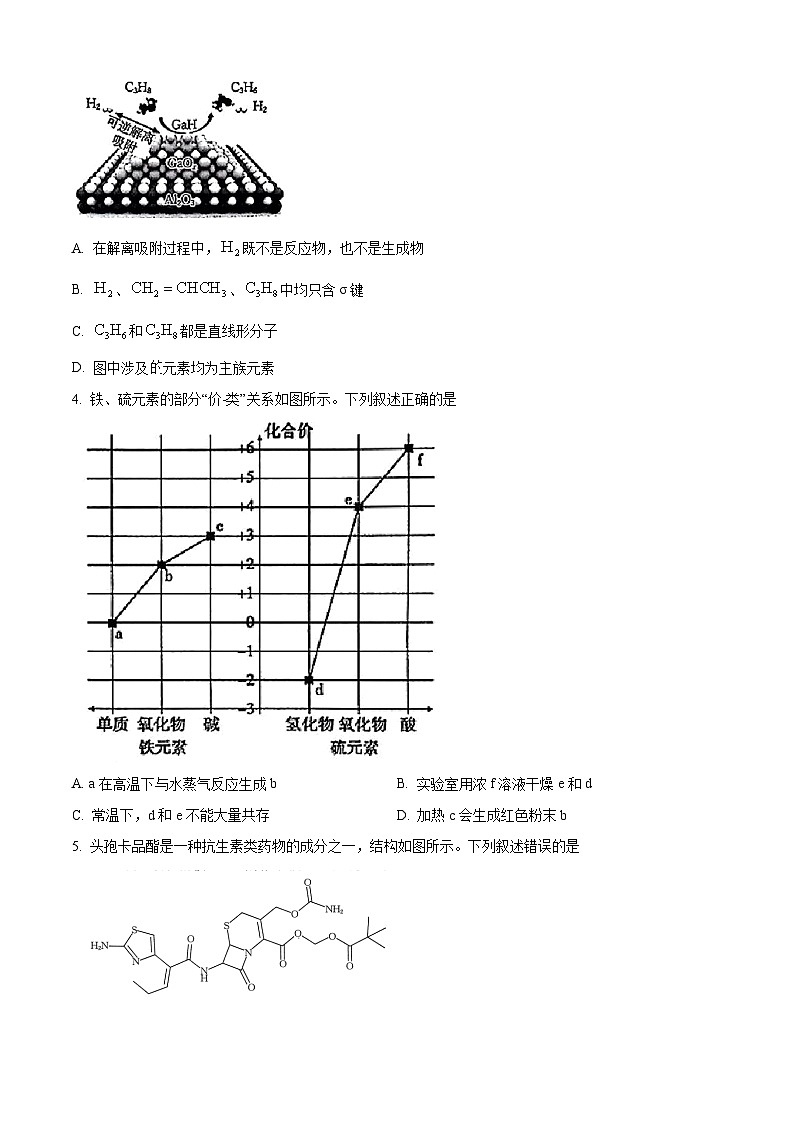
3. 天津大学某科研团队通过向原料中添加适量的氢气,即可在氧化物催化剂表面形成活性更强的金属氢化物催化位点,提升丙烯生产效率,示意图如图所示。下列叙述正确的是
A. 在解离吸附过程中,既不是反应物,也不是生成物
B. 、、中均只含σ键
C. 和都是直线形分子
D. 图中涉及元素均为主族元素
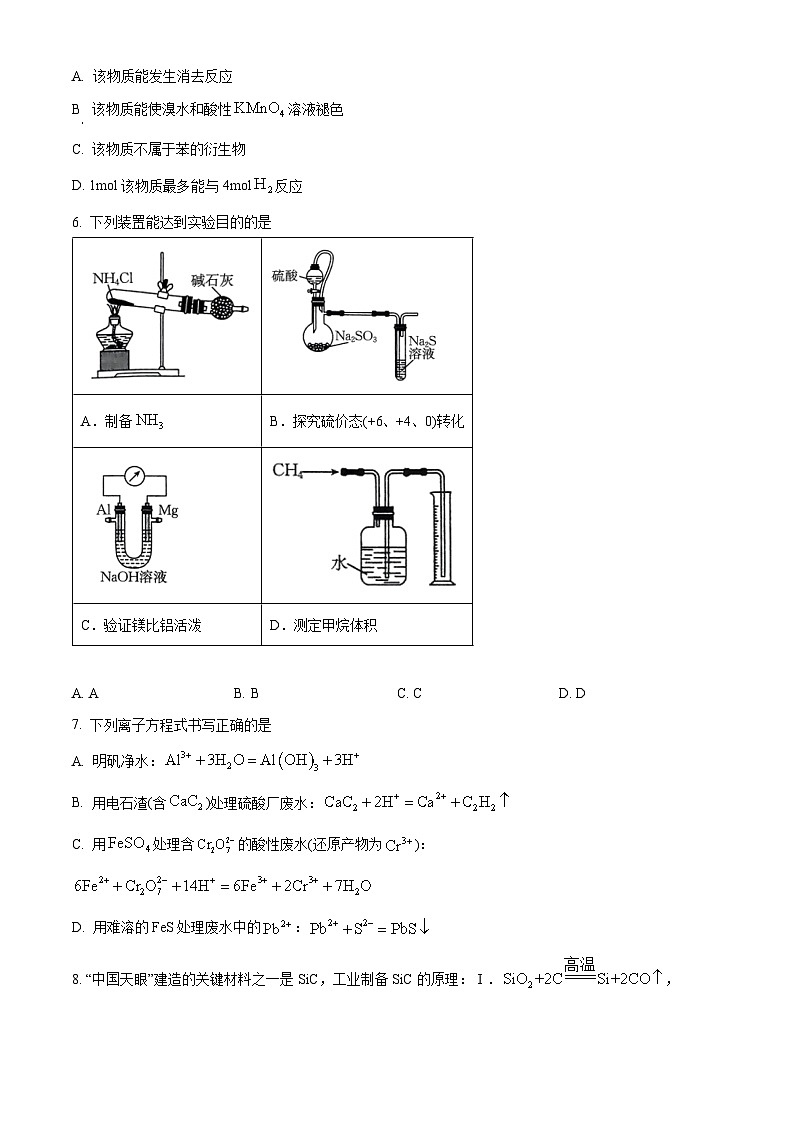
4. 铁、硫元素的部分“价-类”关系如图所示。下列叙述正确的是
A. a在高温下与水蒸气反应生成bB. 实验室用浓f溶液干燥e和d
C. 常温下,d和e不能大量共存D. 加热c会生成红色粉末b
5. 头孢卡品酯是一种抗生素类药物的成分之一,结构如图所示。下列叙述错误的是
A. 该物质能发生消去反应
B 该物质能使溴水和酸性溶液褪色
C. 该物质不属于苯的衍生物
D. 1ml该物质最多能与4ml反应
6. 下列装置能达到实验目的的是
A. AB. BC. CD. D
7. 下列离子方程式书写正确的是
A. 明矾净水:
B. 用电石渣(含)处理硫酸厂废水:
C. 用处理含的酸性废水(还原产物为):
D. 用难溶的FeS处理废水中的:
8. “中国天眼”建造的关键材料之一是SiC,工业制备SiC的原理:Ⅰ.,Ⅱ.。为阿伏加德罗常数的值。下列叙述正确的是
A. 6.0g含Si-O键数目为0.4
B. 高温下,生成11.2LCO时转移的电子数为
C. 中氧化剂、还原剂质量比为1:1
D. 每生成1mlSiC,总反应中转移的电子数为2
9. 以下探究目的所对应的实验方案最合适的是
A. AB. BC. CD. D
10. 铌被广泛应用于航空航天、电子、原子能、超导材料及新型功能材料等领域,是一种十分重要的战略物资。常用于萃取稀土金属铌:。某温度下,萃取过程中溶液中与时间的变化关系如图所示。下列叙述正确的是
A. 其他条件不变,时萃取反应已停止
B. 增大,萃取反应平衡向左移动,平衡常数减小
C. min、min时萃取反应的正反应速率:
D. min内,的平均反应速率
11. 短周期主族元素X、Y、Z、R的原子序数依次增大,它们的原子序数之和等于22,Y与Z位于不同主族,由这四种元素组成的化合物M的结构如图所示。下列叙述正确的是
A. 第一电离能:Z>R>Y
B. 简单氢化物的稳定性:R>Z
C 1mlM含1ml配位键
D. 和都是平面三角形结构
12. 我国科学家开发了一种新型催化电极,该催化剂能实现在碱性介质中高选择性地使糠醛生成糠醇(如图)。下列叙述正确的是
A. 电极a与电源负极连接
B. 生成0.1mlX时有0.2ml向b极区迁移
C. b极上电极反应式为
D. 随着反应进行,电解质溶液中KOH总物质的量不断增大
13. 科学家开发出了新型高效金属氧化物,该氧化物能催化与环氧化物反应合成新的环氧化物(如图)。下列叙述正确的是
已知:R-为烃基。
A. 甲和乙生成丙的反应符合绿色化学思想B. M和N是催化剂
C. 循环中断裂和形成了非极性键和极性键D. 若R为甲基,则甲、丙都不是手性分子
14. 常温下,在柠檬酸()和的混合液中滴加NaOH溶液,混合液中pX[,X代表、、、]与pH的关系如图所示。下列叙述错误的是
A. 直线表与pH关系B.
C. 0.1 溶液呈碱性D. 的K>1000
二、非选择题:本题共4小题,共58分。
15. 溶于水,也溶于盐酸,不溶于乙醇和氨水,主要用于磷酸盐的测定。某小组设计实验制备并测定其纯度,回答下列问题:
实验(一):制备。
步骤1:称取6.0g和4.0g放入250mL锥形瓶中,加入10mL蒸馏水,加热溶解。
步骤2:稍冷却后,向步骤1所得溶液中加入0.4g活性炭,搅拌,停止加热,冷却,加入14mL浓氨水;再用冷水浴冷却至20℃以下,缓慢地边搅拌边加入8mL30%的双氧水;然后用热水浴加热至60℃,并恒温20min,冷却并抽滤,得到沉淀。
步骤3:将步骤2得到的沉淀溶解于50mL热水中并加入5mL浓盐酸,搅拌,趁热过滤,取其滤液加热浓缩、冷却至0℃,抽滤,用无水乙醇洗涤得到的固体,称量。
(1)的作用是_______(答一条即可)。
(2)步骤2中,在“冷却”之后加入浓氨水,这样操作的目的是_____,双氧水的作用是______(用化学方程式表示)。
(3)步骤3中“趁热过滤”是为了_______。
(4)步骤2和步骤3中,抽滤装置如上图所示。相比普通过滤操作,抽滤的优点有______(答一条)。
抽滤时部分操作如下:
①过滤完成后,先断开抽气泵和吸滤瓶之间的橡皮管,然后再关闭抽气泵。
②将准备好的液体缓慢地倒入布氏漏斗中。
③开启抽气泵,抽气以帮助滤纸紧贴在漏斗的内壁,防止液体泄漏。
④从漏斗中取出固体时,应小心地将漏斗从吸滤瓶上移除,并将漏斗管倒置,利用手的力量将固体和滤纸一同脱落到干净的表面上。正确的操作顺序是_______(填标号)。
实验(二):测定产品中含量。
称取mg产品溶于足量热的NaOH溶液中,冷却后,滴加稀硫酸酸化,加入过量的KI溶液,充分反应后,将溶液稀释至250mL,准确量取25.00mL配制的溶液于碘量瓶中,用标准溶液滴定至终点,消耗标准溶液VmL。
有关反应如下:
①。
②。
③。
(5)该产品中的质量分数为____(用含c、V、m的代数式表示)%。若加入的硫酸过量,则测得的结果会____(填“偏高”“偏低”或“无影响”)。
16. 以废旧镍氢电池的金属电极芯[主要成分为和,还含有少量铁、铝的氧化物]为原料回收钴、镍的化合物,流程如图:
已知:①部分金属离子生成氢氧化物沉淀的pH如下表所示。
②酸性条件下的氧化性:>。
回答下列问题:
(1)“氧化”时作_____(填“氧化剂”或“还原剂”,下同),“浸出”时作______。
(2)写出“沉钴1”中转化为的离子方程式:_______。
(3)设计“”的目的是_______。
(4)“沉钴2”中发生反应的离子方程式为_______,_______(填“能”或“不能”)用替代,理由是_______。
(5)设计实验检验是否洗净:_______。
(6)水溶液中、的颜色与分裂能大小有关。定义1个电子从较低能量的d轨道跃迁到较高能量的d轨道所需的能量为d轨道的分裂能。d轨道分裂能:_______(填“>”“”“R>Y
B. 简单氢化物的稳定性:R>Z
C. 1mlM含1ml配位键
D. 和都是平面三角形结构
【答案】B
【解析】
【分析】短周期主族元素X、Y、Z、R的原子序数依次增大, Y与Z位于不同主族,由M的结构可知,Z原子最外层有5个电子,Y原子最外层有3个电子,由四种元素的原子序数之和为22可知,R为F,X为H;结合Y、Z原子最外层电子数可知,Y为B,Z为N。
【详解】A.同一周期随着原子序数变大,第一电离能变大,第一电离能:F>N>B,A错误;
B.非金属性越强,其简单氢化物稳定性越强,简单氢化物的稳定性:F>N,B正确;
C.的阴、阳离子都含配位键,1mlM含2ml配位键,C错误;
D.是平面三角形结构, 分子中N原子的价层电子对数为,孤电子对数为1,所以为三角锥形结构,D错误;
故选B
12. 我国科学家开发了一种新型催化电极,该催化剂能实现在碱性介质中高选择性地使糠醛生成糠醇(如图)。下列叙述正确的是
A. 电极a与电源负极连接
B. 生成0.1mlX时有0.2ml向b极区迁移
C. b极上电极反应式为
D. 随着反应进行,电解质溶液中KOH总物质的量不断增大
【答案】C
【解析】
【分析】根据醛基变为羟基可知,a极为阳极,b极为阴极。据此分析解答。
【详解】A.电极a为阳极与电源正极连接,A项错误;
B.a电极为阳极,水在阳极失电子生成氧气,则X为,生成0.1ml转移0.4ml电子,则向a极区迁移0.4ml,B项错误;
C.b极上得电子生成,电子方程式为:,C项正确;
D.总反应为:2+2H2O2+O2,从总反应看KOH的总物质的量保持不变,D项错误;
故选:C。
13. 科学家开发出了新型高效金属氧化物,该氧化物能催化与环氧化物反应合成新的环氧化物(如图)。下列叙述正确的是
已知:R-为烃基。
A. 甲和乙生成丙的反应符合绿色化学思想B. M和N是催化剂
C. 循环中断裂和形成了非极性键和极性键D. 若R为甲基,则甲、丙都不是手性分子
【答案】A
【解析】
【详解】A.甲和乙生成丙的过程中无其他副产物生成,符合绿色化学思想,故A正确;
B.M、N是中间产物,故B错误;
C.循环过程中没有断裂和形成非极性键,只断裂和形成极性键,故C错误;
D.甲、丙分子都含1个手性碳原子,它们都是手性分子,故D错误;
故选:A。
14. 常温下,在柠檬酸()和的混合液中滴加NaOH溶液,混合液中pX[,X代表、、、]与pH的关系如图所示。下列叙述错误的是
A. 直线表与pH关系B.
C. 0.1 溶液呈碱性D. 的K>1000
【答案】C
【解析】
【分析】混合液中加NaOH,Cd2+浓度减小,因此-lgc(Cd2+)增大,故L0为-lgc(Cd2+)与pH的变化曲线,由Ka1()=,p=pKa1-pH,的电离平衡常数Ka1> Ka2> Ka3,因此等pH时,pKa越大pX越大,L1、L2、L3分别代表-lg、-lg 、-lg 随pH的变化曲线;
【详解】A.根据多元酸电离常数可知,代表与pH关系,A项正确;
B.L0为-lgc(Cd2+)与pH的变化曲线,将a(7,0.3)代入计算c(OH-)=10-7ml/L,c(Cd2+)=10-0.3ml/L,,B 项正确:
C.根据电离常数,L1代表-lg随pH的变化曲线,由图像中将b(4,-0.9)带入计算:Ka1()==100.9×10-4=10-3.1,同理,将(2,2.7)代入计算可得,将c(8,-1.6)代入计算可得,的水解常数,的电离能力大于水解能力,溶液呈酸性,C项错误;
D.的平衡常数,D项正确;
故选C
二、非选择题:本题共4小题,共58分。
15. 溶于水,也溶于盐酸,不溶于乙醇和氨水,主要用于磷酸盐的测定。某小组设计实验制备并测定其纯度,回答下列问题:
实验(一):制备。
步骤1:称取6.0g和4.0g放入250mL锥形瓶中,加入10mL蒸馏水,加热溶解。
步骤2:稍冷却后,向步骤1所得溶液中加入0.4g活性炭,搅拌,停止加热,冷却,加入14mL浓氨水;再用冷水浴冷却至20℃以下,缓慢地边搅拌边加入8mL30%的双氧水;然后用热水浴加热至60℃,并恒温20min,冷却并抽滤,得到沉淀。
步骤3:将步骤2得到的沉淀溶解于50mL热水中并加入5mL浓盐酸,搅拌,趁热过滤,取其滤液加热浓缩、冷却至0℃,抽滤,用无水乙醇洗涤得到的固体,称量。
(1)的作用是_______(答一条即可)。
(2)步骤2中,在“冷却”之后加入浓氨水,这样操作的目的是_____,双氧水的作用是______(用化学方程式表示)。
(3)步骤3中“趁热过滤”是为了_______。
(4)步骤2和步骤3中,抽滤装置如上图所示。相比普通过滤操作,抽滤的优点有______(答一条)。
抽滤时部分操作如下:
①过滤完成后,先断开抽气泵和吸滤瓶之间的橡皮管,然后再关闭抽气泵。
②将准备好的液体缓慢地倒入布氏漏斗中。
③开启抽气泵,抽气以帮助滤纸紧贴在漏斗的内壁,防止液体泄漏。
④从漏斗中取出固体时,应小心地将漏斗从吸滤瓶上移除,并将漏斗管倒置,利用手的力量将固体和滤纸一同脱落到干净的表面上。正确的操作顺序是_______(填标号)。
实验(二):测定产品中含量。
称取mg产品溶于足量热的NaOH溶液中,冷却后,滴加稀硫酸酸化,加入过量的KI溶液,充分反应后,将溶液稀释至250mL,准确量取25.00mL配制的溶液于碘量瓶中,用标准溶液滴定至终点,消耗标准溶液VmL。
有关反应如下:
①。
②。
③。
(5)该产品中的质量分数为____(用含c、V、m的代数式表示)%。若加入的硫酸过量,则测得的结果会____(填“偏高”“偏低”或“无影响”)。
【答案】(1)抑制氨水电离,避免生成(或其他合理答案)
(2) ①. 避免氨水大量挥发 ②. {或}
(3)避免产品析出 (4) ①. 过滤更快(或固体能较快干燥或便于固液分离等) ②. ②③①④
(5) ①. ②. 偏高
【解析】
【分析】根据题意,在氨气和氯化铵存在条件下,以活性炭为催化剂,用双氧水氧化CCl2溶液来制备[C(NH3)6]Cl3,反应的化学方程式为;将粗产品溶于热的稀盐酸中,再向滤液中缓慢加入浓盐酸,有大量橙黄色晶体析出,再用少许乙醇洗涤,干燥,得产品,据此分析解题。
【小问1详解】
C2+和一水合氨电离产生的OH-反应产生C(OH)2,可以抑制一水合氨电离,的作用是:抑制氨水电离,避免生成。
【小问2详解】
氨水受热会挥发,步骤2中,在“冷却”之后加入浓氨水,这样操作的目的是避免氨水大量挥发;双氧水的作用是氧化C2+离子生成[C(NH3)6]2+,根据得失电子守恒和电荷守恒配平离子方程式为:{或。
【小问3详解】
在溶液中遇冷会析出,步骤3中“趁热过滤”是为了避免产品析出。
【小问4详解】
抽滤的操作顺序为:②将准备好的液体缓慢地倒入布氏漏斗中;③开启抽气泵,抽气以帮助滤纸紧贴在漏斗的内壁,防止液体泄漏;①过滤完成后,先断开抽气泵和吸滤瓶之间的橡皮管,然后再关闭抽气泵;④从漏斗中取出固体时,应小心地将漏斗从吸滤瓶上移除,并将漏斗管倒置,利用手的力量将固体和滤纸一同脱落到干净的表面上。相比普通过滤操作,抽滤的优点有:过滤更快(或固体能较快干燥或便于固液分离等)。
【小问5详解】
根据方程式可以得到关系式:n(C3+)=n(Na2S2O3),产品中的质量分数:,如果酸过量,则发生反应:,导致V偏大,测得的结果偏高。
16. 以废旧镍氢电池的金属电极芯[主要成分为和,还含有少量铁、铝的氧化物]为原料回收钴、镍的化合物,流程如图:
已知:①部分金属离子生成氢氧化物沉淀的pH如下表所示。
②酸性条件下的氧化性:>。
回答下列问题:
(1)“氧化”时作_____(填“氧化剂”或“还原剂”,下同),“浸出”时作______。
(2)写出“沉钴1”中转化为的离子方程式:_______。
(3)设计“”的目的是_______。
(4)“沉钴2”中发生反应的离子方程式为_______,_______(填“能”或“不能”)用替代,理由是_______。
(5)设计实验检验是否洗净:_______。
(6)水溶液中、的颜色与分裂能大小有关。定义1个电子从较低能量的d轨道跃迁到较高能量的d轨道所需的能量为d轨道的分裂能。d轨道分裂能:_______(填“>”“”“②>③,碱性:①>②>③,故答案为:①②③;
【小问2详解】
从图可知A()与发生反应中苯环上的氢原子被硝基取代,发生取代反应生成B();根据系统命名法可知为2,3-二硝基苯胺,故答案为:取代反应;;2,3-二硝基苯胺;
【小问3详解】
含氧官能团为酯基,故答案为:酯基;
【小问4详解】
E()与反应生成F()和水,对应化学方程式:
,故答案为: ;
【小问5详解】
A()的芳香族同分异构体中,同时含、-CHO、-OOCH结构,说明苯环上含有三个不同的取代基分别为:、-CHO、-OOCH,三个不同取代基在苯环上位置的异构有10种,故答案为:10;
【小问6详解】
以苯甲醇和为原料合成,根据正逆结合法可知第一步将氧化为,与一定条件反应生成,与氢气加成得到目标产物,该设计路线为:,故答案为:。
A.制备
B.探究硫价态(+6、+4、0)转化
C.验证镁比铝活泼
D.测定甲烷体积
选项
探究目的
实验方案
A
验证活泼性:Na>Cu
向溶液中加入一小块钠
B
验证非金属性:Cl>S
向粉末中滴加盐酸,并将产生的气体通入品红溶液
C
验证羟基活泼性:
分别向乙醇和水中加入一小块钠
D
验证葡萄糖中含醇羟基
在酸性溶液中滴加葡萄糖溶液
离子
开始沉淀的pH
6.3
1.5
3.4
6.2
7.2
完全沉淀的pH
8.3
2.8
4.7
8.9
9.2
1.1
A.制备
B.探究硫价态(+6、+4、0)转化
C.验证镁比铝活泼
D.测定甲烷体积
选项
探究目的
实验方案
A
验证活泼性:Na>Cu
向溶液中加入一小块钠
B
验证非金属性:Cl>S
向粉末中滴加盐酸,并将产生的气体通入品红溶液
C
验证羟基活泼性:
分别向乙醇和水中加入一小块钠
D
验证葡萄糖中含醇羟基
在酸性溶液中滴加葡萄糖溶液
离子
开始沉淀的pH
6.3
1.5
3.4
6.2
7.2
完全沉淀的pH
8.3
2.8
4.7
8.9
9.2
1.1
相关试卷
这是一份2024届河北省保定市九县一中高三下学期三模化学试题,共4页。
这是一份河北省保定市九校2024届高三下学期二模化学试题(Word版附解析),共33页。试卷主要包含了本试卷主要考试内容,可能用到的相对原子质量, AX4四面体,下列说法正确是等内容,欢迎下载使用。
这是一份2024届河北省部分高中高三下学期二模化学试题(原卷版+解析版),文件包含2024届河北省部分高中高三下学期二模化学试题原卷版docx、2024届河北省部分高中高三下学期二模化学试题解析版docx等2份试卷配套教学资源,其中试卷共30页, 欢迎下载使用。









