



还剩22页未读,
继续阅读
所属成套资源:2025届高考化学一轮总复习课件
成套系列资料,整套一键下载
2025届高考化学一轮总复习第6章物质结构与性质元素周期律第29讲化学键课件
展开
这是一份2025届高考化学一轮总复习第6章物质结构与性质元素周期律第29讲化学键课件,共30页。PPT课件主要包含了极性键,非极性键,阳离子,活泼金属,活泼非金属,不同种,离子键,共价键,Na·,Al3+等内容,欢迎下载使用。
1.了解化学键的形成和表示方法,了解化学键与化合物类型的关系。2.能说出微粒间作用(离子键、共价键)的主要类型、特征和实质。3.能用键能、键长、键角等说明简单分子的某些性质。
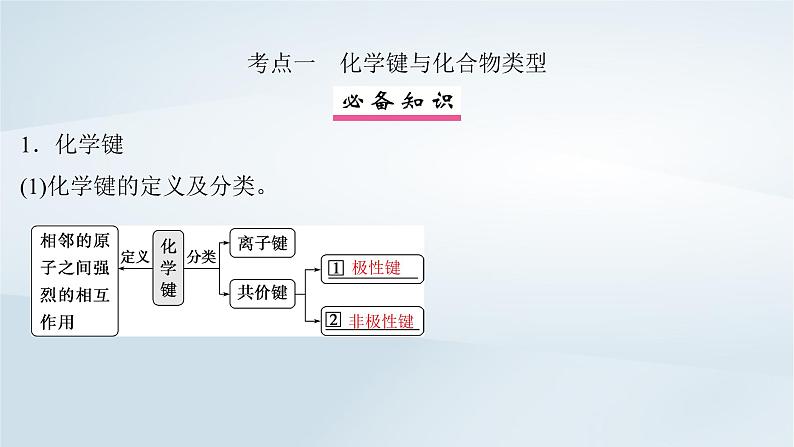
考点一 化学键与化合物类型 1.化学键(1)化学键的定义及分类。
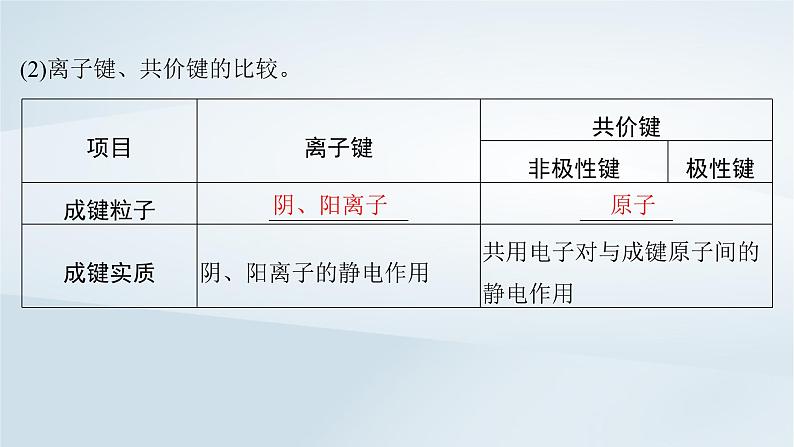
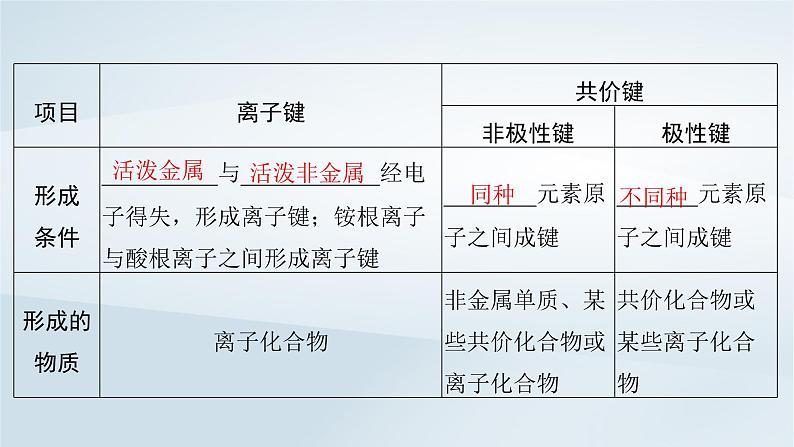
(2)离子键、共价键的比较。
2.离子化合物和共价化合物
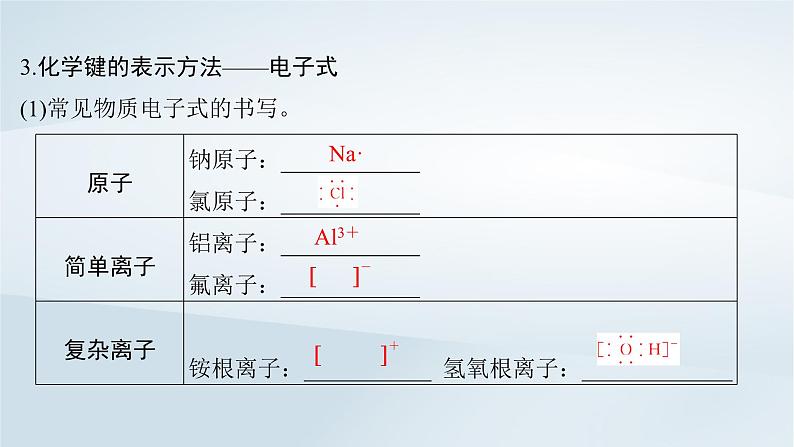
3.化学键的表示方法——电子式(1)常见物质电子式的书写。
[易错秒判](1)形成离子键的静电作用指的是阴、阳离子间的静电吸引作用( )(2)所有物质均含有化学键( )(3)某些金属与非金属原子间也能形成共价键( )(4)非金属元素的两个原子之间形成的一定是共价键,多个原子形成的化合物中可能含有离子键( )(5)某元素的原子最外层只有一个电子,它跟卤素原子结合时,所形成的化学键一定是离子键( )答案:(1)× (2)× (3)√ (4)√ (5)×
1.一定条件下,氨与氟气发生反应:4NH3+3F2===NF3+3NH4F,其中NF3的空间结构与NH3的相似。下列有关说法错误的是( )A.除单质F2外,反应物和生成物均为共价化合物B.NF3中各原子均满足8电子稳定结构C.NF3中只含极性共价键D.NH4F中既含有离子键又含有共价键解析:NH3、NF3为共价化合物,NH4F为离子化合物。
2.现有下列物质:①NaCl,②Na2O,③Na2O2,④NaOH,⑤AlCl3,⑥H2O,⑦N2,⑧NH4Cl,⑨CO2,⑩H2O2。(1)只含离子键的物质有________(填序号,下同),只含共价键的物质有________。(2)属于离子化合物的有________,含非极性键的离子化合物有______________,含有非极性键的共价化合物有____________。答案:(1)①② ⑤⑥⑦⑨⑩ (2)①②③④⑧ ③ ⑩
(2)HClO__________,CCl4_____________________________,CO2____________,N2H4____________。(3)Na2S__________,NaH________________________________,NaBH4__________________,Na2O2________________________。
考点二 共价键及其键参数 1.共价键的本质及特征共价键是原子间通过____________所形成的相互作用,其特征是具有____________和____________。
3.键参数(1)概念。
(2)对分子性质的影响。①键能越大,键长越短,分子越稳定。
[易错秒判](1)共价键的成键原子只能是非金属原子( )(2)共价键的键长是成键的两个原子半径之和( )(3)在任何情况下,σ键都比π键强度大( )(4)σ键能单独形成,而π键不能单独形成( )(5)σ键可以绕键轴旋转,π键不能绕键轴旋转( )(6)分子的稳定性与分子间作用力的大小无关( )(7)碳碳三键的键能是碳碳单键的键能的3倍( )答案:(1)× (2)× (3)× (4)√ (5)√ (6)√ (7)×
1.下列有关化学键类型的叙述正确的是( )A.化合物NH5中所有原子最外层均满足2个或8个电子的稳定结构,故1 ml NH5中含有5NA个N—H σ键(NA表示阿伏加德罗常数的值)B.乙烯酮的结构简式为CH2===C===O,其分子中含有极性共价键和非极性共价键,且σ键与π键数目之比为1∶1C.已知乙炔的结构式为H—C≡C—H,故乙炔分子中存在2个σ键(C—H)和3个π键(C≡C) D.乙烷分子中只存在σ键,不存在π键
2.关于键长、键能和键角,下列说法错误的是( )A.键角是描述分子空间结构的重要参数B.键长的大小与成键原子的半径和成键数目有关C.C===C键能等于C—C键能的2倍D.因为O—H的键能小于H—F的键能,所以O2与H2反应的能力比F2与H2反应的能力弱解析:C===C由一个σ键和一个π键构成,C—C为σ键,二者的键能不是2倍的关系,C项错误。
3.硅是重要的半导体材料,构成了现代电子工业的基础。碳和硅的有关化学键键能如表所示,简要分析和解释下列有关事实:
(1)硅与碳同族,也有系列氢化物,但硅烷在种类和数量上都远不如烷烃多,原因是_______________________________________________。(2)SiH4的稳定性小于CH4的,SiH4更易生成氧化物,原因是____________________________________________________________。答案:(1)C—C和C—H的键能较大,所形成的烷烃稳定,而硅烷中 Si—Si 和Si—H的键能较小,易断裂,导致难以形成长链硅烷(2)C—H的键能大于C—O的,C—H比C—O稳定,而Si—H 的键能小于Si—O的,Si—H不稳定而倾向于形成稳定性更强的Si—O
2.(2022·新高考北京卷改编)由键能数据大小,不能解释下列事实的是( )
A.稳定性:CH4>SiH4 B.键长:C===O晶体硅
解析:A.键能越大越稳定,键能:C—H>Si—H,所以稳定性:CH4>SiH4,故不符合题意;B.键能越大,键长越短,键能:C===O>C—O,所以键长:C===OSi—Si,所以硬度:金刚石>晶体硅,故不符合题意。
3.(2020·新高考山东卷)下列关于C、Si及其化合物结构与性质的论述错误的是( )A.键能C—C>Si—Si、C—H>Si—H,因此 C2H6稳定性大于Si2H6B.立方型SiC是与金刚石成键、结构均相似的共价晶体,因此具有很高的硬度C.SiH4中Si的化合价为+4,CH4中C的化合价为-4,因此SiH4还原性小于CH4D.Si原子间难形成双键而C原子间可以,是因为Si的原子半径大于C,难形成p-p π键
1.了解化学键的形成和表示方法,了解化学键与化合物类型的关系。2.能说出微粒间作用(离子键、共价键)的主要类型、特征和实质。3.能用键能、键长、键角等说明简单分子的某些性质。
考点一 化学键与化合物类型 1.化学键(1)化学键的定义及分类。
(2)离子键、共价键的比较。
2.离子化合物和共价化合物
3.化学键的表示方法——电子式(1)常见物质电子式的书写。
[易错秒判](1)形成离子键的静电作用指的是阴、阳离子间的静电吸引作用( )(2)所有物质均含有化学键( )(3)某些金属与非金属原子间也能形成共价键( )(4)非金属元素的两个原子之间形成的一定是共价键,多个原子形成的化合物中可能含有离子键( )(5)某元素的原子最外层只有一个电子,它跟卤素原子结合时,所形成的化学键一定是离子键( )答案:(1)× (2)× (3)√ (4)√ (5)×
1.一定条件下,氨与氟气发生反应:4NH3+3F2===NF3+3NH4F,其中NF3的空间结构与NH3的相似。下列有关说法错误的是( )A.除单质F2外,反应物和生成物均为共价化合物B.NF3中各原子均满足8电子稳定结构C.NF3中只含极性共价键D.NH4F中既含有离子键又含有共价键解析:NH3、NF3为共价化合物,NH4F为离子化合物。
2.现有下列物质:①NaCl,②Na2O,③Na2O2,④NaOH,⑤AlCl3,⑥H2O,⑦N2,⑧NH4Cl,⑨CO2,⑩H2O2。(1)只含离子键的物质有________(填序号,下同),只含共价键的物质有________。(2)属于离子化合物的有________,含非极性键的离子化合物有______________,含有非极性键的共价化合物有____________。答案:(1)①② ⑤⑥⑦⑨⑩ (2)①②③④⑧ ③ ⑩
(2)HClO__________,CCl4_____________________________,CO2____________,N2H4____________。(3)Na2S__________,NaH________________________________,NaBH4__________________,Na2O2________________________。
考点二 共价键及其键参数 1.共价键的本质及特征共价键是原子间通过____________所形成的相互作用,其特征是具有____________和____________。
3.键参数(1)概念。
(2)对分子性质的影响。①键能越大,键长越短,分子越稳定。
[易错秒判](1)共价键的成键原子只能是非金属原子( )(2)共价键的键长是成键的两个原子半径之和( )(3)在任何情况下,σ键都比π键强度大( )(4)σ键能单独形成,而π键不能单独形成( )(5)σ键可以绕键轴旋转,π键不能绕键轴旋转( )(6)分子的稳定性与分子间作用力的大小无关( )(7)碳碳三键的键能是碳碳单键的键能的3倍( )答案:(1)× (2)× (3)× (4)√ (5)√ (6)√ (7)×
1.下列有关化学键类型的叙述正确的是( )A.化合物NH5中所有原子最外层均满足2个或8个电子的稳定结构,故1 ml NH5中含有5NA个N—H σ键(NA表示阿伏加德罗常数的值)B.乙烯酮的结构简式为CH2===C===O,其分子中含有极性共价键和非极性共价键,且σ键与π键数目之比为1∶1C.已知乙炔的结构式为H—C≡C—H,故乙炔分子中存在2个σ键(C—H)和3个π键(C≡C) D.乙烷分子中只存在σ键,不存在π键
2.关于键长、键能和键角,下列说法错误的是( )A.键角是描述分子空间结构的重要参数B.键长的大小与成键原子的半径和成键数目有关C.C===C键能等于C—C键能的2倍D.因为O—H的键能小于H—F的键能,所以O2与H2反应的能力比F2与H2反应的能力弱解析:C===C由一个σ键和一个π键构成,C—C为σ键,二者的键能不是2倍的关系,C项错误。
3.硅是重要的半导体材料,构成了现代电子工业的基础。碳和硅的有关化学键键能如表所示,简要分析和解释下列有关事实:
(1)硅与碳同族,也有系列氢化物,但硅烷在种类和数量上都远不如烷烃多,原因是_______________________________________________。(2)SiH4的稳定性小于CH4的,SiH4更易生成氧化物,原因是____________________________________________________________。答案:(1)C—C和C—H的键能较大,所形成的烷烃稳定,而硅烷中 Si—Si 和Si—H的键能较小,易断裂,导致难以形成长链硅烷(2)C—H的键能大于C—O的,C—H比C—O稳定,而Si—H 的键能小于Si—O的,Si—H不稳定而倾向于形成稳定性更强的Si—O
2.(2022·新高考北京卷改编)由键能数据大小,不能解释下列事实的是( )
A.稳定性:CH4>SiH4 B.键长:C===O
解析:A.键能越大越稳定,键能:C—H>Si—H,所以稳定性:CH4>SiH4,故不符合题意;B.键能越大,键长越短,键能:C===O>C—O,所以键长:C===O
3.(2020·新高考山东卷)下列关于C、Si及其化合物结构与性质的论述错误的是( )A.键能C—C>Si—Si、C—H>Si—H,因此 C2H6稳定性大于Si2H6B.立方型SiC是与金刚石成键、结构均相似的共价晶体,因此具有很高的硬度C.SiH4中Si的化合价为+4,CH4中C的化合价为-4,因此SiH4还原性小于CH4D.Si原子间难形成双键而C原子间可以,是因为Si的原子半径大于C,难形成p-p π键












