






所属成套资源:2025高考化学一轮复习 课件
模块1 主题2 第1讲 物质的分类与转化 课件 2025高考化学一轮复习
展开
这是一份模块1 主题2 第1讲 物质的分类与转化 课件 2025高考化学一轮复习,共29页。PPT课件主要包含了学习目标,活动方案,链接真题等内容,欢迎下载使用。
1. 根据物质的分类,判断物质间相互转化的规律。2. 会正确使用恰当的化学用语表示物质的变化。3. 知道化学反应的常见分类方法,理解四种基本反应类型与氧化还原反应的关系。
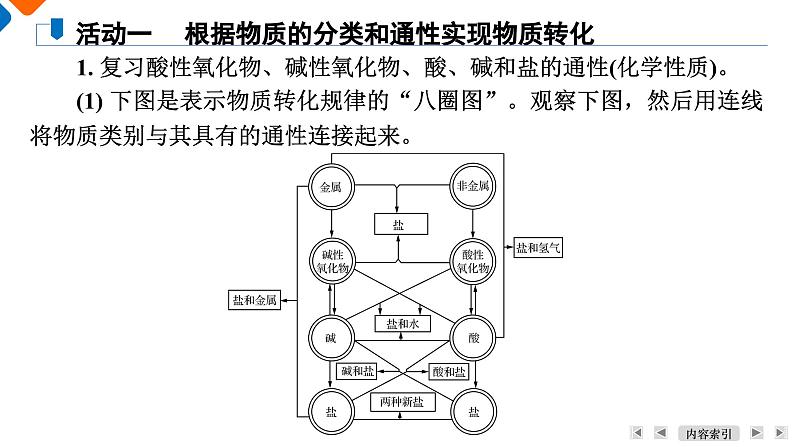
1. 复习酸性氧化物、碱性氧化物、酸、碱和盐的通性(化学性质)。(1) 下图是表示物质转化规律的“八圈图”。观察下图,然后用连线将物质类别与其具有的通性连接起来。
活动一 根据物质的分类和通性实现物质转化
物质的分类①酸性氧化物②碱性氧化物③酸④碱⑤盐
通性a. 与活泼金属反应生成H2b. 与水反应生成对应的酸或碱c. 与酸反应生成盐和水d. 与碱反应生成盐和水e. 与酸性氧化物反应生成盐f. 与碱性氧化物反应生成盐g. 与盐反应生成新的酸和新的盐h. 与盐反应生成新的碱和新的盐i. 与酸性氧化物反应生成盐和水j. 与碱性氧化物反应生成盐和水k. 与酸反应生成新的酸和新的盐l. 与碱反应生成新的碱和新的盐m. 与盐反应生成两种新盐
【答案】 ①(bdf) ②(bce) ③(adgj) ④(chi) ⑤(klm)
(2) 酸、碱、盐之间的复分解反应需要满足什么条件?
【答案】 生成(更)难电离的物质,生成(更)难溶的物质
2. 利用非氧化还原反应的一般规律完成物质间的转化。(1) 在下图括号中填充合适的物质类别(或反应条件)。
【答案】 ①碱 ②水 ③加热 ④碱或盐或碱性氧化物或金属 ⑤酸 ⑥酸 ⑦水 ⑧加热 ⑨酸或盐或酸性氧化物 ⑩碱
(2) 在下图括号中填充合适的物质(或反应条件)。
【答案】 ①CO2 ②H2O ③过量CO2 ④CO2或(NH4)2CO3 ⑤NaOH或加热 ⑥CO2 ⑦Ca(OH)2或Ba(OH)2 ⑧H2O ⑨加热 ⑩少量NH3·H2O ⑪强酸 ⑫NH3·H2O ⑬SO2 ⑭NH3·H2O ⑮NH3·H2O或(NH4)2CO3或NH4HCO3 ⑯强酸 ⑰强酸
3. 信息条件下的非氧化还原反应的化学方程式的书写。(1) 五氧化二钒(V2O5)是一种酸性氧化物,对应的酸为HVO3,请写出五氧化二钒与氢氧化钠溶液反应的离子方程式。
(2) 已知:Fe元素在Fe3O4中有+2价、+3价,Fe3O4可以看作是由FeO与Fe2O3两种碱性氧化物以1∶1的比例组成的混合物。试写出Fe3O4与盐酸反应的离子方程式。
【答案】 Fe3O4+8H+===Fe2++2Fe3++4H2O
(3) 25 ℃时,下表为某些酸的电离平衡常数,找出能与NaF溶液反应生成HF的酸,并写出反应的离子方程式。
(4) 向次氯酸钠溶液中通入少量CO2,写出反应的化学方程式。
【答案】 NaClO+CO2+H2O===NaHCO3+HClO
活动二 熟悉表示物质变化的化学用语
1. 阅读下列材料,并根据要求书写有关表示物质变化的化学用语。在自然条件下(如海水、潮湿大气、酸雨等),金属的腐蚀通常是电化学腐蚀,如:铁在中性或在酸性很弱的条件下发生吸氧腐蚀;铁在酸性条件下发生析氢腐蚀。化学腐蚀则是金属与直接接触的物质发生氧化还原反应,金属被氧化而损耗。如:一定条件下,金属与氧气、卤素、水、二氧化碳等发生的反应。
(1) 潮湿的大气由于溶有二氧化碳而呈很弱的酸性。写出碳酸的电离方程式:________________________。
(2) 写出铁在酸性条件下发生析氢腐蚀的电极反应式。
【答案】 负极:Fe-2e-===Fe2+正极:2H++2e-===H2↑
(3) 写出铁在中性条件下发生吸氧腐蚀的电极反应式。
【答案】 负极:Fe-2e-===Fe2+正极:O2+2H2O+4e-===4OH-
(4) 通常情况下,钢铁在发生吸氧腐蚀后生锈(铁锈用Fe2O3表示)的过程通常分为三步反应。第一步反应如下,请写出第二步和第三步反应。第一步:2Fe+O2+2H2O===2Fe(OH)2;第二步:4Fe(OH)2+O2+2H2O===4Fe(OH)3第三步:2Fe(OH)3===Fe2O3+3H2O
2. 分别用电子式表示H2O和Na2O的形成过程。
3. 已知:56 g铁完全被氧化为氧化铁,放出的热量为 412.2 kJ。写出该反应的热化学方程式。
【答案】 4Fe(s)+3O2(g)===2Fe2O3(s) ΔH=-1 648.8 kJ· ml-1
4. 碳酸钠溶液可用于洗涤油污,因为碳酸钠溶液显碱性。写出碳酸钠水解的化学方程式。
1. 列举常见的无机反应的类型,并分别书写一例化学方程式。
活动三 正确判断化学反应的类型
【答案】 按反应前后物质的类别分为化合反应、分解反应、置换反应、复分解反应;按反应前后有无元素的化合价发生变化分为氧化还原反应和非氧化还原反应。化学方程式略。
2. 列举常见的有机反应的类型,并分别书写一例化学方程式。
【答案】 取代反应、加成反应、消去反应、加聚反应、缩聚反应、氧化反应、还原反应。化学方程式略。
3. 氧化还原反应与四种基本反应类型的关系。分析氧化还原反应与化合反应、分解反应、置换反应、复分解反应四种基本反应类型的关系,将四种基本反应类型分别填入图中对应的圆圈内。
1 (江苏卷)氮及其化合物的转化具有重要应用。下列说法不正确的是( )A. 自然固氮、人工固氮都是将N2转化为NH3B. 侯氏制碱法以H2O、NH3、CO2、NaCl为原料制备NaHCO3和NH4ClC. 工业上通过NH3催化氧化等反应过程生产HNO3D. 多种形态的氮及其化合物间的转化形成了自然界的“氮循环”
【解析】 固氮是将游离态的氮转化为化合态。
2 (2023江苏卷)氮及其化合物的转化具有重要应用。下列说法不正确的是( )
【解析】 NO不能与水反应生成硝酸,B错误。
3 (2023辽宁卷)下列有关物质的工业制备反应错误的是( )
【解析】 工业上通常用电解熔融的氯化镁的方法制备金属镁,而不用熔点很高的氧化镁制备,D错误。
4 (2023北京卷)回收利用工业废气中的CO2和SO2,实验原理示意图如下:
下列说法不正确的是( )A. 废气中SO2排放到大气中会形成酸雨
5 铜器久置于空气中会和空气中的水蒸气、CO2、O2作用产生“绿锈”,该“绿锈”俗称“铜绿”[化学式为Cu2(OH)2CO3],“铜绿”能跟酸反应生成铜盐、CO2和H2O。某同学利用下述系列反应实现了“铜→铜绿→……→铜”的转化。(1) 从三种不同分类标准回答,“铜绿”属于哪类物质:__________________________。(2) 请写出“铜绿”与盐酸反应的化学方程式:_______________________________________________。
Cu2(OH)2CO3+4HCl===2CuCl2+3H2O+CO2↑
(3) 写出④⑤的化学方程式:④_____________________________;⑤_______________________________。(4) 上述转化过程中,属于化合反应的是________(填序号,下同);属于复分解反应的是________;属于分解反应的是________。
相关课件
这是一份模块1 主题3 第2讲 利用化学方程式或关系式的计算 课件 2025高考化学一轮复习,共21页。PPT课件主要包含了学习目标,活动方案,链接真题等内容,欢迎下载使用。
这是一份模块1 主题2 第5讲 新情境下方程式的书写 课件 2025高考化学一轮复习,共32页。PPT课件主要包含了学习目标,活动方案,链接真题等内容,欢迎下载使用。
这是一份模块1 主题1 第1讲 物质的组成、结构与分类 课件 2025高考化学一轮复习,共31页。PPT课件主要包含了学习目标,活动方案,高沸点酸,低沸点酸挥发性酸,链接真题等内容,欢迎下载使用。









