






所属成套资源:2025高考化学一轮复习 课件
模块1 主题3 第3讲 利用守恒法的计算 课件 2025高考化学一轮复习
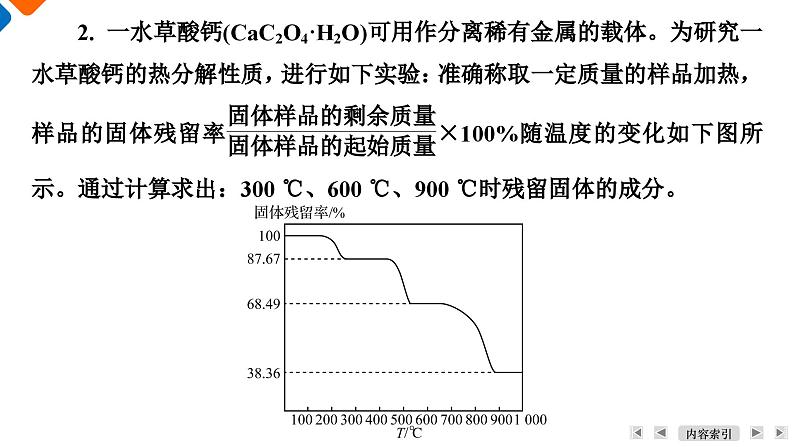
展开
这是一份模块1 主题3 第3讲 利用守恒法的计算 课件 2025高考化学一轮复习,共32页。PPT课件主要包含了学习目标,活动方案,链接真题等内容,欢迎下载使用。
能选择利用元素守恒法、电子得失守恒法和电荷守恒法进行计算。
活动一 元素守恒法在计算中的应用
3. C(OH)2在空气中加热时,固体残留率随温度的变化如下图所示。已知钴的氢氧化物加热至290 ℃时已完全脱水。计算并分析A、B、C点物质的化学式。
【答案】 原始固体的质量即为C(OH)2的质量,可假设有C(OH)2 1 ml,质量为93 g。则固体中C的物质的量为1 ml,质量为59 g。设290 ℃后固体的化学式为COx。A点固体的相对分子质量=93×89.25%=83,此时x=1.5,即该固体为C2O3;C点固体的相对分子质量=93×80.65%=75,此时x=1,即该固体为CO。
1. 水中溶解氧的测定方法如下:向一定量水样中加入适量MnSO4和碱性KI溶液,生成MnO(OH)2沉淀,密封静置;加入适量稀硫酸,待MnO(OH)2与I-完全反应生成Mn2+和I2后,以淀粉作指示剂,用Na2S2O3标准溶液滴定至终点,测定过程中物质的转化关系如下:取100.00 mL加过一定量供氧剂的池塘水样,按上述方法测定水中溶解氧量,消耗0.010 00 ml·L-1 Na2S2O3标准溶液13.50 mL。计算该水样中的溶解氧(以mg·L-1表示)。
活动二 得失电子守恒法在计算中的应用
活动三 电荷守恒法在计算中的应用
1. 碱式硫酸铝溶液[(1-x)Al2(SO4)3·xAl(OH)3]可用于烟气脱硫。通过测定碱式硫酸铝溶液中相关离子的浓度确定x的值,测定方法如下:①取碱式硫酸铝溶液25.00 mL,加入盐酸酸化的过量BaCl2溶液充分反应,静置后过滤、洗涤,干燥至恒重,得固体2.330 0 g。②取碱式硫酸铝溶液2.50 mL,稀释至25 mL,加入 0.100 0 ml·L-1EDTA标准溶液25.00 mL,调节溶液pH约为4.2,煮沸,冷却后用0.080 00 ml·L-1CuSO4标准溶液滴定过量的EDTA至终点,消耗CuSO4标准溶液20.00 mL(已知Al3+、Cu2+与EDTA反应的化学计量比均为1∶1)。计算(1-x)Al2(SO4)3·xAl(OH)3中的x值(写出计算过程)。
2. 磷酸锰铵是重要的复盐,在工农业生产中具有广泛应用。为测定磷酸锰铵[(NH4)aMnb(PO4)c·xH2O]的组成,进行如下实验:①称取样品2.448 0 g,加水溶解后配成 100.00 mL 溶液A;②量取25.00 mL溶液A,加足量NaOH溶液并充分加热,生成NH3 0.067 20 L(标准状况);③另取25.00 mL溶液A,边鼓空气边缓慢滴加氨水,控制溶液pH 6 ~ 8,充分反应后,将溶液中Mn2+转化为Mn3O4,得Mn3O4 0.229 0 g。通过计算确定该样品的化学式(写出计算过程)。
2 Cu2S与一定浓度的HNO3反应,生成Cu(NO3)2、CuSO4、NO2、NO和H2O,当NO2和NO的物质的量之比为1∶1时,实际参加反应的Cu2S与HNO3的物质的量之比为( )A. 1∶7 B. 1∶9 C. 1∶5 D. 2∶9
3 (江苏第二次适应性考试)以软锰矿浆(主要成分为MnO2,杂质为Fe、Al等元素的氧化物)和烟气(含有SO2、O2等)为原料可制备Mn2O3。实验过程如下:①向一定量软锰矿浆中匀速通入烟气,向吸收后的混合溶液中滴加氨水,调节pH进行除杂,向除杂后的溶液中加入NH4HCO3溶液,反应生成MnCO3沉淀。
②在氧气气氛中加热分解MnCO3,测得加热升温过程中固体的质量变化如图所示。加热分解MnCO3制备Mn2O3,需要控制的温度为多少(写出计算推理过程)。
4 取7.90 g KMnO4,加热分解后剩余固体7.42 g。该剩余固体与足量的浓盐酸在加热条件下充分反应,生成单质气体A,产物中锰元素以Mn2+存在。请计算:(1) KMnO4的分解率为________。(2) 气体A的物质的量为____________。
5 (江苏适应性考试)以印刷线路板的碱性蚀刻废液{主要成分为[Cu(NH3)4]Cl2}或焙烧过的铜精炼炉渣(主要成分为CuO、SiO2和少量Fe2O3)为原料均能制备CuSO4·5H2O晶体。
(1) 取一定量蚀刻废液和稍过量的NaOH溶液加入如图所示实验装置的三颈瓶中,在搅拌下加热反应并通入空气,待产生大量的黑色沉淀时停止反应,趁热过滤、洗涤,得到CuO固体;所得固体经酸溶、结晶、过滤等操作,得到CuSO4·5H2O晶体。
(2)通过下列方法测定产品纯度:准确称取0.500 0 g CuSO4·5H2O样品,加适量水溶解,转移至碘量瓶中,加过量KI溶液并用稀硫酸酸化,以淀粉溶液为指示剂,用0.100 0 ml·L-1 Na2S2O3标准溶液滴定至终点,消耗Na2S2O3的溶液19.80 mL。
6 (江苏卷)硫铁化合物(FeS、FeS2等)应用广泛。FeS2、FeS在空气中易被氧化,将FeS2在空气中氧化,测得氧化过程中剩余固体的质量与起始FeS2的质量的比值随温度变化的曲线如图所示。800 ℃时,FeS2氧化成含有两种元素的固体产物为________(填化学式,写出计算过程)。
相关课件
这是一份模块1 主题1 第1讲 物质的组成、结构与分类 课件 2025高考化学一轮复习,共31页。PPT课件主要包含了学习目标,活动方案,高沸点酸,低沸点酸挥发性酸,链接真题等内容,欢迎下载使用。
这是一份2025届高考化学一轮总复习第1章物质及其变化第3讲离子共存检验与推断课件,共37页。PPT课件主要包含了答案①⑤,不溶解,无明显,无色无味,变浑浊,有刺激性气味,Br-等内容,欢迎下载使用。
这是一份第一篇 主题二 热点题空1 关系式法、守恒法在化学计算中的应用-2024年高考化学二轮复习课件,文件包含第一篇主题二热点题空1关系式法守恒法在化学计算中的应用pptx、第一篇主题二热点题空1关系式法守恒法在化学计算中的应用docx、第一篇主题二热点题空1关系式法守恒法在化学计算中的应用学生版docx等3份课件配套教学资源,其中PPT共25页, 欢迎下载使用。








