上海市第八中学2023-2024学年高二下学期期末考试 化学(等级)试题(无答案)
展开
这是一份上海市第八中学2023-2024学年高二下学期期末考试 化学(等级)试题(无答案),共5页。试卷主要包含了5ml,6×10-4,0×10-8等内容,欢迎下载使用。
考试时间:60分钟
考生注意:
1.答题前,考生务必将自己的班级、姓名、准考证号填写清楚,并将六位考号填涂完整。
2.答题纸与试卷在试题编号上是一一对应的,答题时应特别注意,不能错位。
相对原子质量:N-14O-16Cr-52Fe-56
一、
铬属于过渡元素,三价铬离子能形成多种配位化合物,例如:[Cr(NH3)3(H2O)2Cl]2+。
1.对于基态Cr原子,下列叙述不正确的是( )。
A.铬位于周期表的第四周期ⅥB族B.铬核外电子排布式为[Ar]3d54s1C.4s轨道上电子能量大于3d
2.[Cr(NH3)3(H2O)2Cl]2+中提供空轨道形成配位键的原子或离子是 ,中心离子的配位数为 。
3.[Cr(NH3)3(H2O)2Cl]2+中所含元素中,N、O、Cl三种元素第一电离能由大到小的顺序为( )。
A.O>Cl>NB.Cl>N>OC.N>O>ClD.O>N>Cl
4.[Cr(NH3)3(H2O)2Cl]2+中基态Cl原子核外电子的运动状态有 种,核外电子的空间运动状态有 种。
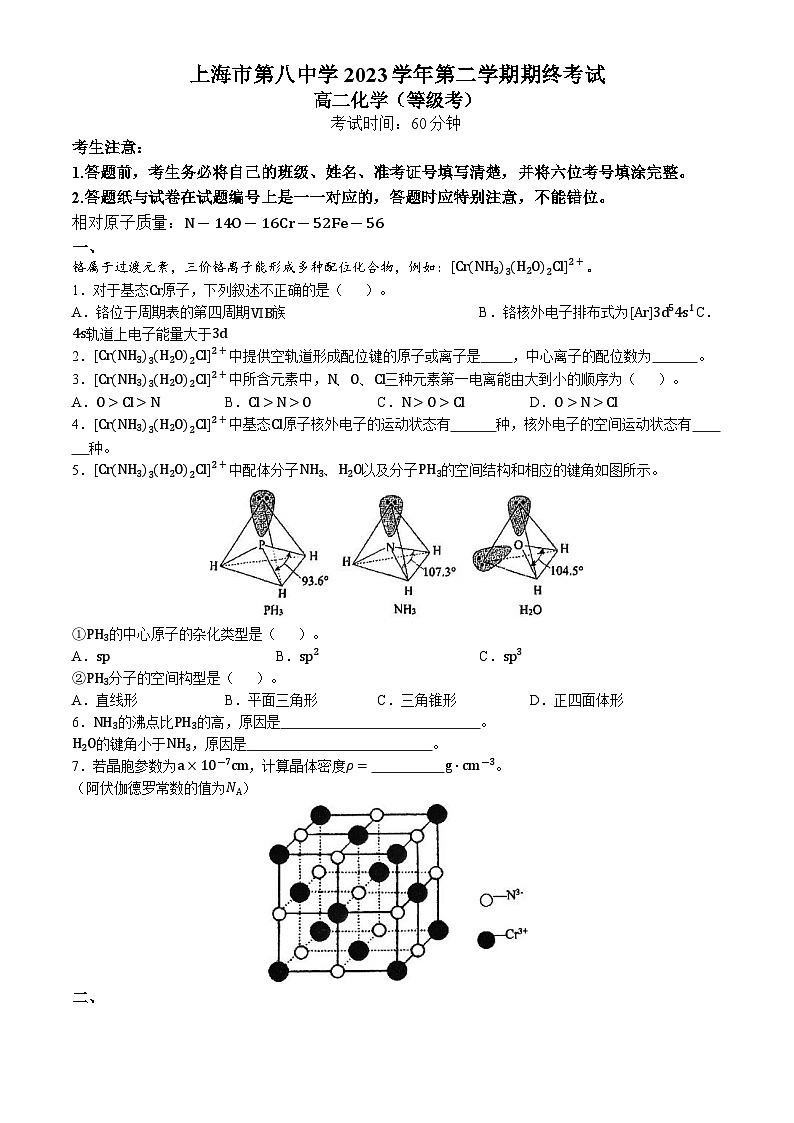
5.[Cr(NH3)3(H2O)2Cl]2+中配体分子NH3、H2O以及分子PH3的空间结构和相应的键角如图所示。
①PH3的中心原子的杂化类型是( )。
A.spB.sp2C.sp3
②PH3分子的空间构型是( )。
A.直线形B.平面三角形C.三角锥形D.正四面体形
6.NH3的沸点比PH3的高,原因是 。
H2O的键角小于NH3,原因是 。
7.若晶胞参数为a×10-7cm,计算晶体密度ρ= g⋅cm-3。
(阿伏伽德罗常数的值为NA)
二、
CO2的综合利用与工业合成氨:综合利用CO2、CO对实现“零排放”有重要意义。CH4-CO2催化重整是CO2利用的研究热点之一。其主要反应原理为:
CH4(g)+CO2(g)⇌2CO(g)+2H2(g)
已知:①C(s)+2H2(g)=CH4(g)ΔH=-75kJ⋅ml-1
②C(s)+O2(g)=CO2(g)ΔH=-394kJ⋅ml-1
③C(s)+12O2(g)=CO(g)ΔH=-111kJ⋅ml-1
8.( )固态CO2属于 晶体,当它升华时,其中 作用力发生了变化。
A.分子 共价键 B.分子 范德华力 C.共价 共价键
9.根据盖斯定律,该催化重整反应的ΔH=( )kJ⋅ml-1。
A.+247 B.-247 C.+358 D.-358
写出该催化重整反应的平衡常数表达式K= 。
10.请判断反应②常温下是否可自发进行? (填可或不可)自发进行,并写出判断依据: 。
11.某温度下,在体积为2L的容器中加入1mlCH4、2mlCO2以及催化剂进行重整反应,10min时测得生成的CO是0.5ml。则0∼10minCH4的平均反应速率v(CH4)= 。
12.(双选)若要加快CO的生成速率同时有利于提高CH4平衡转化率的条件是( )。
A.高温B.高压C.使用催化剂D.增大CO2浓度
二氧化碳加氢制甲醇的总反应可表示为:CO2(g)+3H2(g)=CH3OH(g)+H2O(g),该反应一般认为通过如下步骤来实现:
①CO2(g)+H2(g)=CO(g)+H2O(g)ΔH1=+41kJ⋅ml-1
②CO(g)+2H2(g)=CH3OH(g)ΔH2=-90kJ⋅ml-1
13.若反应①为慢反应,如图示意图中能体现上述反应能量变化的是( )
A.B.
C.D.
某化学研究性学习小组参考反应②用CO和H2模拟工业合成甲醇。
14.学习小组考查了其他条件不变的情况下,温度和压强对反应的影响,实验结果如图所示。下列说法正确的是( )
A.T2>T1,P2T2,P1vA,vDKB,KC>KD
合成氨是目前转化空气中氮最有效的工业方法。
15.恒容条件下,不能说明合成氨反应已经达到平衡状态的是( )
A.氢气含量不再变化B.混合气体密度不发生变化
C.容器内压强不再变化D.混合气体物质的量不再变化
16.若改变某一条件,使合成氨的化学反应速率加快,下列解释正确的是( )。
A.升高温度,使单位体积内活化分子百分数增加
B.增加反应物的浓度,使单位体积内活化分子百分数增加
C.催化剂不改变反应焓变(ΔH),但能增大正、逆反应的活化能
D.增大压强,能降低反应的活化能,使单位体积内活化分子数增加
三、
了解电解质在水溶液中的存在形式及其行为,有助于从微观角度认识水溶液中离子反应的本质和规律。下表是几种常见弱酸的电离平衡常数(25∘C)。
17.可以证明醋酸是弱酸的事实是( )(填字母序号,双选)
A.醋酸和水能以任意比例混溶
B.在醋酸水溶液中还含有未电离的醋酸分子
C.醋酸与Na2CO3溶液反应放出CO2气体
D.1ml⋅L-1的醋酸水溶液能使紫色石蕊溶液变红色
E.等体积等pH的醋酸和盐酸分别与足量氢氧化钠溶液充分反应,醋酸消耗的氢氧化钠更多
18.结合表中给出的电离常数回答下列问题:
(1)上述四种酸中,酸性最强的酸是 (用化学式表示)。
(2)(双选)下列能使醋酸溶液中CH3COOH的电离程度增大,而电离平衡常数不变的操作是( )。
A.升高温度B.加水稀释C.加少量的CH3COONa固体
D.加少量冰醋酸E.加氢氧化钠固体
(3)据上表,判断醋酸和次氯酸钠溶液能否反应: 反应(填能或不能)。请结合上表中Ka数据,通过计算解释上述反应能否发生的原因:
19.在室温下,下列五种溶液的物质的量浓度均为0.01ml⋅L-1分析并回答下列问题,①盐酸 ②硫酸 ③醋酸 ④Ba(OH)2溶液 ⑤氨水
(1)pH由小到大的排列顺序是 (填序号)。
(2)室温下,计算0.01ml⋅L-1硫酸的pH= ,其中由水电离产生的OH-浓度为 ml⋅L-1。
(3)若将等体积的溶液①和④混合并充分反应,计算反应后溶液pH= 。
四、
苯乙烯(A)是一种重要化工原料。以苯乙烯为原料可以制备一系列化工产品,如图所示。
20.A中所含官能团的名称是 ,A→B的反应类型是 。
21.在溴水、溴的四氯化碳溶液中分别加入过量的A,观察到的现象中,相同之处是 ,
不同之处在于 。
22.写出D→E反应的化学方程式: 。生成1mlE至少需要 gNaOH。
已知与四个互不相同的原子或原子团相连的碳原子被称为“手性碳原子”。
23.C中有 个“手性碳原子”。
24.写出同时满足下列条件的E的任意一个同分异构体的结构简式 。
①含六元环;
②能发生消去反应;
③核磁共振氢谱显示有7组峰,且峰面积比为6:2:2:2:2:1:1
25.具有良好性能的工程塑料ABS()可由苯乙烯与其他物质聚合得到。写出除苯乙烯外的另两种单体的结构简式 、 。
五、
四氧化三铁(Fe3O4)磁性纳米颗粒稳定、容易生产且用途广泛,是临床诊断、生物技术和环境化学领域多种潜在应用的有力工具。
铁粉在氧气中燃烧是制取Fe3O4最为快捷的方法。
A∼D是制取四氧化三铁的系列装置,A装置用于制取二氧化碳气体,并要求气流稳定,流速可控。
26.写出B装置中反应的化学方程式 。
27.
(1)Fe3O4能和稀硫酸反应,生成的两种盐是 。
(2)验证反应后溶液中含有Fe2+的试剂是 (填所需试剂的化学式)。
(3)某学生利用如图所示装置制备氢氧化亚铁。实验前把稀硫酸和氢氧化钠溶液均煮沸处理,目的是 ,实验开始,打开弹簧夹C和D,一段时间后,关闭弹簧夹 (填C或D),在B中生成 色絮状沉淀,实验结束未关闭弹簧夹D,无法长时间保存氢氧化亚铁,原因是 (用化学反应方程式表示)。
28.中国科学院上海硅酸盐研究所研制出“纳米药物分子运输车”,该“运输车”可提高肿瘤的治疗效果,其结构如图所示。下列有关说法正确的是( )。
A.该“运输车”中四氧化三铁是碱性氧化物B.四氧化三铁起到“磁性导航仪”的作用
C.该“运输车”的外壳不含碳元素D.该“运输车”分散于水中所得的分散系属于胶体酸
CH3COOH
HNO2
HCN
HClO
电离平衡常数(Ka)
1.8×10-5
4.6×10-4
5×10-10
3.0×10-8
相关试卷
这是一份上海市南汇中学2023-2024学年高二下学期期末考试化学(等级)试题,共6页。
这是一份上海市南洋中学2023-2024学年高二下学期(等级)期末考试化学试题+,共8页。
这是一份上海市延安中学2023-2024学年高二下学期期中考试++化学试卷(等级)+(无答案),共6页。试卷主要包含了下列过程一定不能自发进行的是,下列方程式书写正确的是,羰基硫,某温度下,将0,常温下,一元酸HA的等内容,欢迎下载使用。










