

所属成套资源:高中化学 选择性必修一(人教版2019)学案
高中化学人教版 (2019)选择性必修1第四章 化学反应与电能第二节 电解池学案设计
展开
这是一份高中化学人教版 (2019)选择性必修1第四章 化学反应与电能第二节 电解池学案设计,共12页。学案主要包含了 能力打底 概念辨析, 电解饱和食盐水, 电镀和电解精炼铜, 电冶金, 电解的相关计算等内容,欢迎下载使用。
1. 认识电解饱和食盐水、电镀、电解精炼铜以及电冶金等电解原理的应用。
2. 掌握电解原理的有关计算。
一、 能力打底 概念辨析
判断下列说法的正误(正确的画“√”,错误的画“×”)。
(1) 氯碱工业是非常重要的化工产业,在电解饱和食盐水时,在阴极上得到的产物为H2和NaOH。( √ )
(2) 电解饱和食盐水制烧碱,用铁作阳极。( × )
(3) 电解法精炼粗铜,用纯铜作阳极。( × )
(4) 在镀件上电镀锌,用锌作阳极。( √ )
(5) 电解法精炼粗铜时,电解质溶液中各离子浓度一定不变。( × )
(6) 在镀件上电镀铜,电镀过程中阳极减少的质量等于阴极增加的质量。( × )
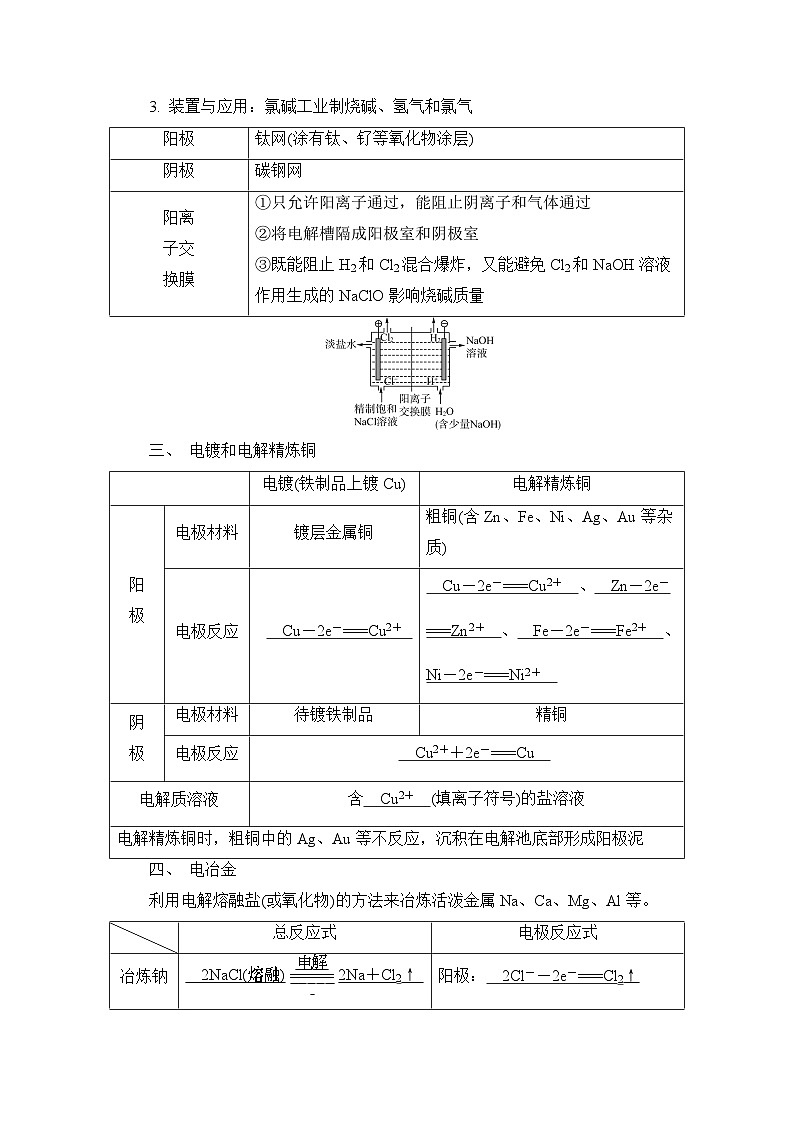
二、 电解饱和食盐水
氯碱工业:电解饱和食盐水的工业叫作氯碱工业。
1. 电极反应
阳极: 2Cl--2e-===Cl2↑ (反应类型: 氧化 反应)。
阴极: 2H2O+2e-===H2↑+2OH- (反应类型: 还原 反应)。
2. 总反应式
化学方程式: 2NaCl+2H2Oeq \(=====,\s\up12(电解))2NaOH+H2↑+Cl2↑ 。
离子方程式: 2Cl-+2H2Oeq \(=====,\s\up12(电解))2OH-+H2↑+Cl2↑ 。
3. 装置与应用:氯碱工业制烧碱、氢气和氯气
三、 电镀和电解精炼铜
四、 电冶金
利用电解熔融盐(或氧化物)的方法来冶炼活泼金属Na、Ca、Mg、Al等。
五、 电解的相关计算
1. 计算方法
有关电解的计算通常是求电解后某产物的质量、气体的体积、某元素的化合价、元素的相对原子质量、溶液的pH及物质的量浓度等。不论哪种计算,均可概括为下列三种方法:
2. 等量关系
(1) 当电流通过一个或多个串联的电解池时, 它们皆处于同一闭合电路中,所以各池的电流强度相等,同一时间内通过的电子的物质的量相等。
(2) 常见电化学计算的对应关系: H2~Cl2~eq \f(1,2)O2~Cu~2Ag~2H+~2OH-。
如电解中析出气体时,在同温同压下析出各气体物质的量之比为n(H2)∶n(Cl2)∶n(O2)=1∶1∶0.5。
类型1 电解原理的基本应用
关于镀铜和电解精炼铜,下列说法中正确的是( D )
A. 都用粗铜作阳极、纯铜作阴极
B. 电解液的成分都保持不变
C. 阳极反应都只有Cu-2e-===Cu2+
D. 阴极反应都只有Cu2++2e-===Cu
[解析] 电镀时镀件作阴极,A错误;电解精炼铜时,电解液成分发生变化,B错误;电解精炼铜时,比铜活泼的金属杂质(如锌)更易被氧化,C错误。
类型2 电解原理的综合应用
(2023·海安模拟)Na2Cr2O7的酸性水溶液随着H+浓度的增大会转化为CrO3。电解法制备CrO3的原理如右图所示。下列说法错误的是( A )
A. 电解时只允许H+通过离子交换膜
B. 生成O2和H2的质量比为8∶1
C. 电解一段时间后,阴极区OH-的浓度增大
D. 生成CrO3的反应为Cr2Oeq \\al(2-,7)+2H+===2CrO3+H2O
[解析] 根据左侧电极上生成O2,右侧电极上生成H2,可知左侧电极为阳极,发生反应2H2O-4e-===4H++O2↑,右侧电极为阴极,发生反应2H2O+2e-===2OH-+H2↑;由题意知,左室中Na2Cr2O7随着H+浓度增大转化为CrO3:Cr2Oeq \\al(2-,7)+2H+===2CrO3+H2O,因此阳极生成的H+不能通过离子交换膜。由以上分析知,电解时通过离子交换膜的是Na+,A错误;根据各电极上转移电子数相同,由阳极反应和阴极反应可知生成O2和H2的物质的量之比为1∶2,其质量比为8∶1,B正确;根据阴极反应知,电解一段时间后阴极区溶液OH-的浓度增大,C正确;电解过程中阳极区H+的浓度增大,Na2Cr2O2转化为CrO3∶Cr2Oeq \\al(2-,7)+2H+===2CrO3+H2O,D正确。
类型3 电解规律的综合应用
(2022·梁丰中学)我国科学家最新研发的固体透氧膜提取金属钛工艺,装置如图所示。将TiO2熔于NaCl-NaF融盐体系,以石墨为阴极,覆盖氧渗透膜的多孔金属陶瓷涂层为阳极,固体透氧膜把阳极和熔融电解质隔开,只有O2-可以通过。下列说法错误的是( D )
A. a极是电源的正极,O2-在熔融盐中从右往左迁移
B. 阳极电极反应式为2O2--4e-===O2↑
C. NaCl-NaF融盐的作用是降低熔化TiO2需要的温度
D. 阳极每产生4.48 L的O2,理论上能生成0.1 ml钛
[解析] 连接阳极的电源电极是正极,连接阴极的电源电极是负极,电解质中阴离子向阳极移动,所以a是正极、b是负极,O2-在熔融盐中从右往左迁移,A正确;阳极上氧离子失电子发生氧化反应,电极反应式为2O2--4e-===O2↑,B正确;NaCl-NaF融盐的温度较高,它能降低熔化TiO2需要的温度,从而减少能量损失,C正确;温度和压强未知,导致气体摩尔体积未知,无法计算O2的物质的量,则无法计算生成的钛的物质的量,D错误。
1. (2022·木渎中学)右下图是工业电解饱和食盐水的装置示意图,下列有关说法中错误的是( C )
A. 装置出口①处的物质是氯气
B. 出口②处的物质是氢气,该离子交换膜只能让阳离子通过
C. 装置中发生反应的离子方程式为2Cl-+2H+eq \(=====,\s\up12(电解))Cl2↑+H2↑
D. 该装置是将电能转化为化学能
[解析] 出口①处是电解池的阳极区,溶液中的氯离子失电子生成氯气,A正确;出口②处是电解池的阴极区,溶液中的氢离子得到电子发生还原反应生成氢气,离子交换膜是阳离子交换膜,只允许阳离子通过,B正确;电解饱和食盐水生成氢氧化钠、氢气和氯气,离子方程式为2Cl-+2H2Oeq \(=====,\s\up12(电解))Cl2↑+H2↑+2OH-,C错误;该装置是电解装置,是把电能转化为化学能,D正确。
2. 利用电解法可将含有Fe、Zn、Ag、Pt等杂质的粗铜提纯,下列说法中正确的是( D )
A. 电解时以精铜作阳极
B. 电解时阴极发生氧化反应
C. 粗铜连接电源负极,其电极反应式为Cu-2e-===Cu2+
D. 电解后,电解槽底部会形成含少量Ag、Pt等金属的阳极泥
3. 用LiOH可制备锂离子电池的正极材料。LiOH可由电解法制备,如图所示,两极区电解质溶液分别为LiOH和LiCl溶液。下列说法中错误的是( C )
A. B极区电解质溶液为LiOH溶液
B. 阳极的电极反应式为2Cl--2e-===Cl2↑
C. 电解过程中主要是H+通过阳离子交换膜向B极区迁移
D. 电极A连接电源的正极
[解析] B极区生成H2,同时生成LiOH,则B极区电解液为LiOH溶液, A正确;电极A为阳极,阳极区电解液为LiCl溶液,根据放电顺序,阳极上Cl-失去电子,阳极的电极反应式为2Cl--2e-===Cl2↑,B正确;在电解池中阳离子向阴极移动,所以电解过程中主要是Li+向B极区迁移, C错误;电极A为阳极,所以电极A连接电源的正极, D正确。
4. (2023·徐州模拟)以熔融盐为电解液,以含Cu、Mg和Si等的铝合金废料为阳极进行电解,实现Al的再生。该过程中( C )
A. 阴极发生的反应为Mg-2e-===Mg2+
B. 阴极上Al被氧化
C. 在电解槽底部产生含Cu的阳极泥
D. 阳极和阴极的质量变化相等
[解析] 根据电解原理可知,电解池中阳极发生失电子的氧化反应,阴极发生得电子的还原反应,该题中以熔融盐为电解液,含Cu、Mg和Si等的铝合金废料为阳极进行电解,通过控制一定的条件,从而可使阳极区Mg和Al发生失电子的氧化反应,分别生成Mg2+和Al3+,Cu和Si不参与反应,阴极区Al3+得电子生成Al单质,从而实现Al的再生,据此分析解答。阴极发生得电子的还原反应,实际上Mg在阳极失电子生成Mg2+,A错误;Al在阳极上被氧化生成Al3+,B错误;阳极材料中Cu和Si不参与氧化反应,在电解槽底部可形成阳极泥,C正确;因为阳极除了铝参与电子转移,镁也参与了电子转移,且还会形成阳极泥,而阴极只有铝离子得电子生成铝单质,根据电子转移数守恒及元素守恒可知,阳极与阴极的质量变化不相等,D错误。
1. 工业上电解食盐水的阴极区产物是( C )
A. 氯气 B. 氢气和氯气
C. 氢气和氢氧化钠 D. 氯气和氢氧化钠
2. (2022·前黄中学)用电解法精炼含有Fe、Zn、Ag等杂质的粗铜。下列叙述正确的是( C )
A. 电解时以硫酸铜溶液作电解液,精铜作阳极
B. 粗铜与直流电源负极相连,发生氧化反应
C. 阴极上发生的反应是Cu2++2e-===Cu
D. 电解后Fe、Zn、Ag等杂质会沉积在电解槽底部形成阳极泥
[解析] 电解精炼铜时,粗铜作阳极,与直流电源正极相连,A、B错误;阴极上Cu2+得电子,被还原为Cu,C正确;Fe、Zn等金属活动性强于Cu,在阳极失电子,以离子的形式进入电解液中,而不活泼的Ag等杂质会沉积在电解槽底部形成阳极泥,D错误。
3. 金属镍有广泛的用途。粗镍中含有少量铁、锌、铜、铂等杂质,可用电解法制备高纯度的镍。下列说法中正确的是(已知:氧化性Fe2+
相关学案
这是一份高中人教版 (2019)第二节 电解池导学案,共13页。
这是一份人教版 (2019)选择性必修1第四章 化学反应与电能第二节 电解池第二课时学案及答案,共19页。
这是一份人教版 (2019)选择性必修1第二节 电解池第一课时学案,共14页。










