
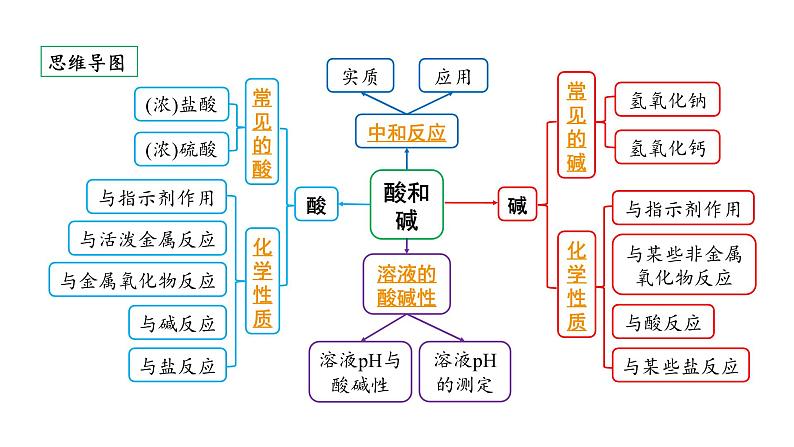

2024贵阳中考化学二轮专题复习 主题六 酸和碱(课件)
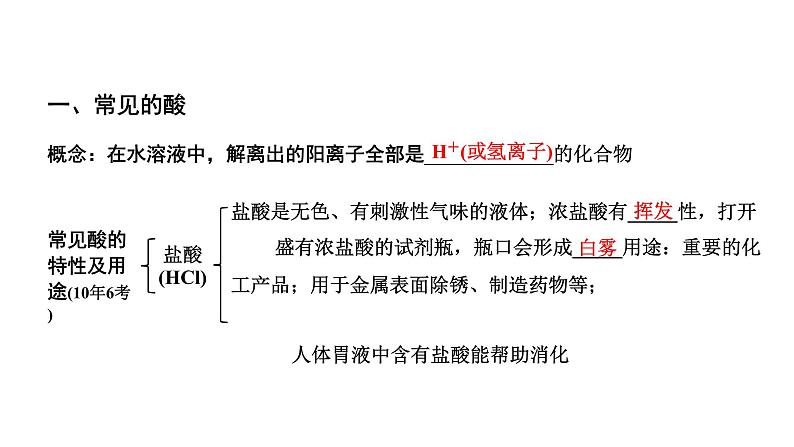
展开盐酸是无色、有刺激性气味的液体;浓盐酸有_____性,打开 盛有浓盐酸的试剂瓶,瓶口会形成_____用途:重要的化工产品;用于金属表面除锈、制造药物等; 人体胃液中含有盐酸能帮助消化
概念:在水溶液中,解离出的阳离子全部是_____________的化合物
常见酸的特性及用途(10年6考)
盐酸 (HCl)
浓硫酸是无色无味、黏稠的油状液体吸水性:浓硫酸能吸收空气中的_______,故应密封保存,实验室 常用浓硫酸作_______腐蚀性:也称为脱水性,浓硫酸能夺取纸张、木材、布料里的水 分,生成黑色的炭浓硫酸的稀释:将浓硫酸沿着烧杯内壁缓慢 地注入水中,并用玻璃棒不 断搅拌,如右图所示
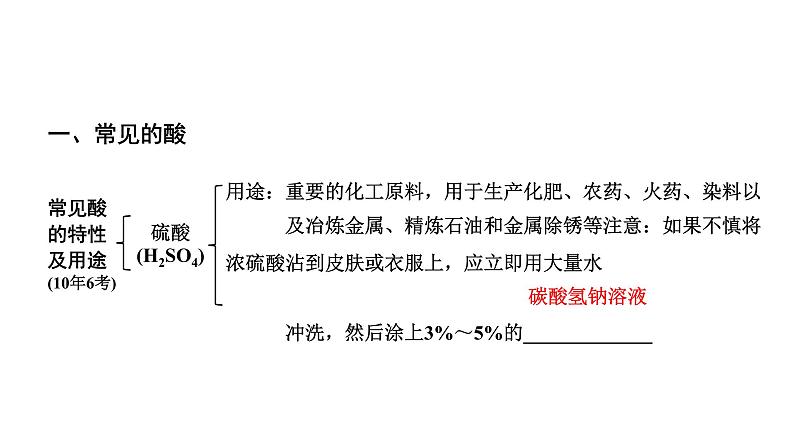
硫酸 (H2SO4)
用途:重要的化工原料,用于生产化肥、农药、火药、染料以及冶炼金属、精炼石油和金属除锈等注意:如果不慎将浓硫酸沾到皮肤或衣服上,应立即用大量水冲洗,然后涂上3%~5%的_____________
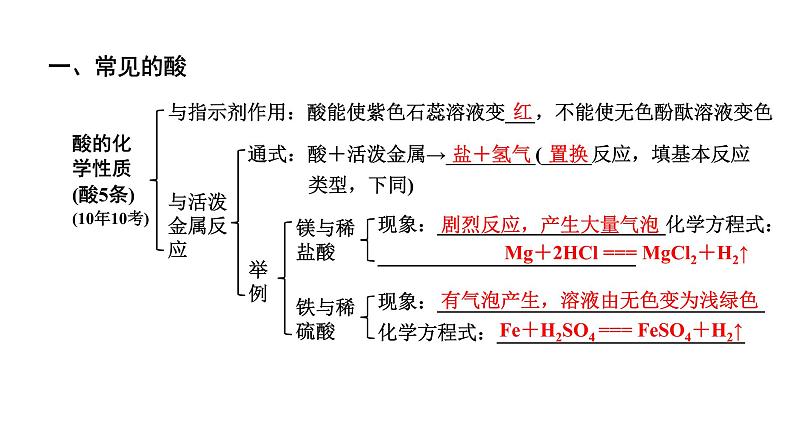
酸的化学性质(酸5条)(10年10考)
与指示剂作用:酸能使紫色石蕊溶液变___,不能使无色酚酞溶液变色
通式:酸+活泼金属→_________(_____反应,填基本反应 类型,下同)
现象:_______________________化学方程式:__________________________
剧烈反应,产生大量气泡
Mg+2HCl === MgCl2+H2↑
现象:_________________________________化学方程式:_________________________
有气泡产生,溶液由无色变为浅绿色
Fe+H2SO4 === FeSO4+H2↑
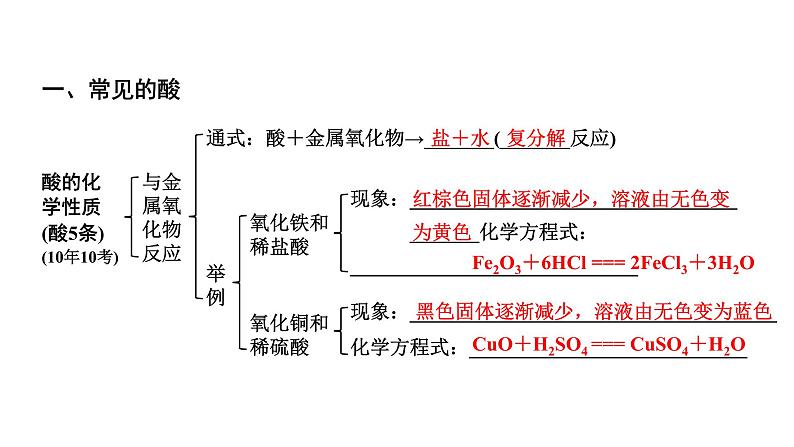
与金属氧 化物反应
通式:酸+金属氧化物→_______(_______反应)
氧化铁和 稀盐酸
现象:_________________________________ _______化学方程式:_____________________________
氧化铜和 稀硫酸
现象:_____________________________________化学方程式:____________________________
红棕色固体逐渐减少,溶液由无色变为黄色
Fe2O3+6HCl === 2FeCl3+3H2O
黑色固体逐渐减少,溶液由无色变为蓝色
CuO+H2SO4 === CuSO4+H2O
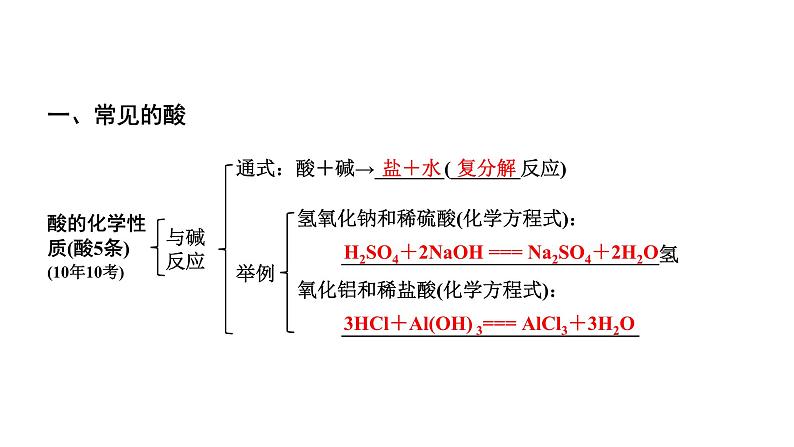
通式:酸+碱→_______(_______反应)
氢氧化钠和稀硫酸(化学方程式): ________________________________氢氧化铝和稀盐酸(化学方程式): ______________________________
H2SO4+2NaOH === Na2SO4+2H2O
3HCl+Al(OH) 3=== AlCl3+3H2O
酸具有“通性”的原因是________________
通式:酸+盐→___________(_______反应)
碳酸钙和 稀盐酸
现象:_________________________化学方程式:_____________________________ _______
白色固体溶解,有气泡产生
CaCO3+2HCl === CaCl2+H2O
碳酸钠和 稀盐酸
现象:___________化学方程式:___________________________ ___________
Na2CO3+2HCl === 2NaCl+
注意:不同的酸具有“个性”的原因是_______________________,举 例如下:
酸根离子(或阴离子)不同
稀盐酸和 硝酸银
现象:_____________化学方程式:______________________________
稀硫酸和 氯化钡
现象:_____________化学方程式:________________________________
HCl+AgNO3 === AgCl↓+HNO3
H2SO4+BaCl2 === BaSO4 ↓+ 2HCl
俗称:_____、火碱或苛性钠性质:白色块状固体,___溶于水并放出大量的热;曝露在空气中易吸收水分而潮解用途:重要的化工原料;用于肥皂、造纸、纺织等工业;生 活中可用于除油污;实验室可用作气体干燥剂等注意:NaOH具有强_____性,若不慎沾到皮肤上,应用大量 清水冲洗,并涂上_________
概念:在水溶液中,解离出的阴离子全部是___________________的化合物
OH-(或氢氧根离子)
常见碱 的特性 及用途 (10年3考)
氢氧化钠 (NaOH)
俗称:消石灰、_______性质:___色粉末状固体,___溶于水,溶解度随温度的升高 而_____用途:作建筑材料、改良_________、配制农药波尔多液等制备:可由氧化钙(CaO)与水反应得到,反应的化学方程式为______________________
氢氧化钙 [Ca(OH)2]
CaO+H2O === Ca(OH)2
碱的化学性质 (碱4条) (10年10考)
与某些非 金属氧化 物反应
通式:碱+非金属氧化物→_______
氢氧化钠和二氧化碳(化学方程式): ______________________________
现象:_______________ 化学方程式: _______________________________
2NaOH+CO2 === Na2CO3+H2O
CO2+Ca(OH)2 === CaCO3↓+H2O
与指示剂作用:碱能使紫色石蕊溶液变___,能使无色酚酞溶液变___
氢氧化钠和稀盐酸(化学方程式,下同): ___________________________氢氧化钙和稀盐酸: ________________________________
HCl+NaOH === NaCl +H2O
2HCl+Ca(OH) 2 === CaCl2+2H2O
通式:碱+盐→____________(_______反应)
举例:氢氧化钠和硫酸铜
现象:_____________ 化学方程式:____________________________________
2NaOH+CuSO4 === Cu(OH)2↓+Na2SO4
碱具有“通性”的原因是_______________
注意:不同的碱具有“个性”的原因是___________,例如:氢氧化 钙和碳酸钠反应的现象为_____________,化学方程式为 _____________________________________
Na2CO3+Ca(OH)2 === CaCO3↓+2NaOH
碱变质的探究(详见精练本微专题11)
碱的化学性质(碱4条) (10年10考)
【备考补充】物质敞口放置在空气中各个量的变化
2NaOH+CO2 === Na2CO3+
Ca(OH) 2+CO2 === CaCO3↓
CaO+H2O === Ca(OH) 2
定义:酸与碱作用生成盐和水的反应实质:酸中的____与碱中的_____结合生成_____,即H++OH- === H2O表达式: 酸+碱→盐+水中和反应及其反应后溶质成分的探究(详见精练本微专题10)
应用 (10年2考)
a.农业上:改良土壤的酸碱性,如用熟石灰改良酸性土壤b.工业上:处理工厂中的废水,如用硫酸处理碱性废水c.医药上:可服用含有碱性物质的药物治疗胃酸过多症d.生活中:蚊虫叮咬后涂肥皂水
四、溶液的酸碱性与酸碱度
酸碱性 的检验 (定性)
酸性溶液:使紫色石蕊溶液变___,不能使无色酚酞溶液变色碱性溶液:使紫色石蕊溶液变___,使无色酚酞溶液变___【记忆口诀】紫色石蕊溶液:酸里红,碱里蓝无色酚酞溶液:遇酸不变色,遇碱红艳艳
酸碱度—— pH(定量) (10年7考)
定义:溶液的酸碱度常用pH来表示,pH的范围通常在______之间
溶液酸碱 度与pH
方法:在白瓷板或玻璃片上放一小片pH试纸,用_______蘸取 溶液滴在pH试纸上,把试纸显示的颜色与标准比色卡 比较,读出该溶液的pH
a.pH试纸不能直接浸入待测液,否则会污染待测液b.pH试纸不能用水润湿,防止测量结果不准确c.在半分钟内对照标准比色卡并读出pHd.pH读数为整数
化工生产中,许多反应都必须在一定pH的溶液中才能进行测定土壤的酸碱性,提供土壤改良依据测定雨水的pH,了解空气污染情况,pH<____的雨水为酸雨医院常通过测定人体内或排出的液体的pH了解人体的健康状况
判断下列说法是否正确(正确的在括号中打“√”,错误的在括号中打“×”)1. 纯碱和烧碱都是碱( )2. 碱溶液能使酚酞溶液变红,则能使酚酞溶液变红的溶液一定是碱溶液( )3. 稀释浓硫酸时,将水沿着烧杯壁缓慢地倒入浓硫酸中( )4. 酸溶液一定显酸性,则显酸性的溶液一定是酸( )
专题六 常见的酸和碱 中和反应 溶液的pH——2024届中考化学一轮复习进阶课件【人教版】: 这是一份专题六 常见的酸和碱 中和反应 溶液的pH——2024届中考化学一轮复习进阶课件【人教版】,共55页。PPT课件主要包含了考情分析,考法一酸碱指示剂,考法二常见的酸,考法三常见的碱,考法四中和反应,酸碱指示剂,注意事项,常见的酸,常见的碱,碱的化学性质等内容,欢迎下载使用。
2024河北中考化学复习 板块一 主题6 酸和碱(2~11分) 课件: 这是一份2024河北中考化学复习 板块一 主题6 酸和碱(2~11分) 课件,共60页。PPT课件主要包含了知识清单·理脉络,2物质与碱的反应,常见的酸,酸的化学性质,常见的碱,碱的化学性质,中和反应,考点突破·释疑难,溶液变为红色,Fe2+等内容,欢迎下载使用。
中考化学复习主题六常见的酸和碱教学课件: 这是一份中考化学复习主题六常见的酸和碱教学课件,共57页。PPT课件主要包含了刺激性,挥发性,吸水性,HCl,干燥剂,纸上显出黑色字迹,蘸有浓硫酸的部位变黑,腐蚀或脱水,盐+氢气,没有明显现象等内容,欢迎下载使用。












