
化学第三节 盐类的水解教案
展开2.熟练掌握盐类水解的表示方法——水解离子方程式的书写。
教学重难点
重点:盐类水解的概念、原理及规律
难点:理解盐类水解的原理
教学过程
1.新课导入
[复习巩固]什么是盐?什么是电离平衡?水溶液的酸碱性由什么决定?
2.1新课讲授——盐溶液酸碱性
[探究活动1]酸溶液呈酸性,碱溶液呈碱性,那么盐溶液是否呈中性呢?测定下列盐溶液的pH,实验探究一下。
[学生活动]实验步骤:分别用玻璃棒蘸取少量下列溶液,滴到pH试纸上,观察颜色变化,并与标准比色卡比较,得出溶液的酸碱性。
NaCl、Na2CO3、NH4Cl、KNO3、CH3COONa、(NH4)2SO4
[得出结论]盐溶液不一定都显中性,有的呈酸性,有的呈碱性。
[设疑]同样为盐溶液,却表现岀不同的酸碱性,分析实验结果,归纳其与盐的类型间的关系。
[得出结论]盐溶液酸碱性:强碱弱酸盐的水溶液显碱性;强酸弱碱盐的水溶液显酸性;强酸强碱盐的水溶液显中性。
2.2新课讲授——盐类溶液呈现酸碱性的原因
[分析]NH4Cl溶液显酸性的原因。
[设疑]同样为盐溶液,却表现岀不同的酸碱性,说明在这六种溶液里H+和OHˉ的浓度分别呈何种关系呢?
[学生活动]学生分组讨论并回答:由于溶液呈现酸或碱性,因此溶液中H+和OHˉ的浓度不相等。
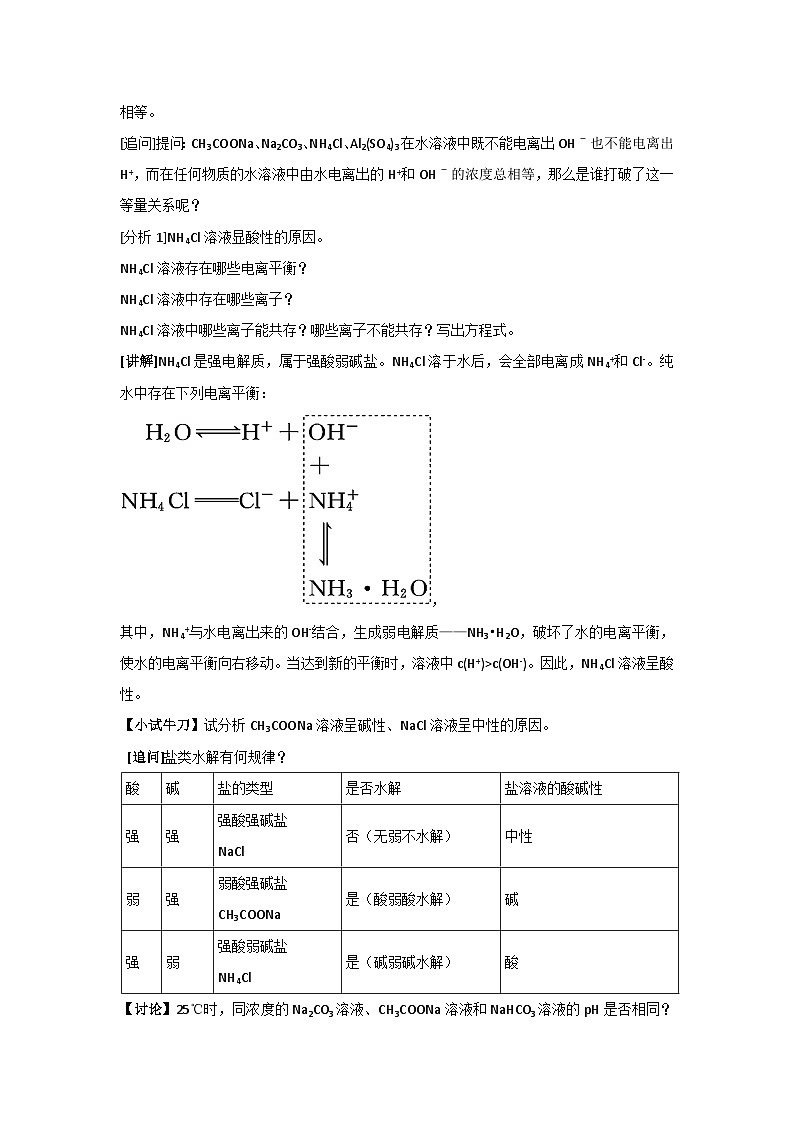
[追问]提问:CH3COONa、Na2CO3、NH4Cl、Al2(SO4)3在水溶液中既不能电离出OHˉ也不能电离出H+,而在任何物质的水溶液中由水电离出的H+和OHˉ的浓度总相等,那么是谁打破了这一等量关系呢?
[分析1]NH4Cl溶液显酸性的原因。
NH4Cl溶液存在哪些电离平衡?
NH4Cl溶液中存在哪些离子?
NH4Cl溶液中哪些离子能共存?哪些离子不能共存?写出方程式。
[讲解]NH4Cl是强电解质,属于强酸弱碱盐。NH4Cl溶于水后,会全部电离成NH4+和Cl-。纯水中存在下列电离平衡:
,
其中,NH4+与水电离出来的OH-结合,生成弱电解质——NH3•H2O,破坏了水的电离平衡,使水的电离平衡向右移动。当达到新的平衡时,溶液中c(H+)>c(OH-)。因此,NH4Cl溶液呈酸性。
【小试牛刀】试分析CH3COONa溶液呈碱性、NaCl溶液呈中性的原因。
[追问]盐类水解有何规律?
【讨论】25℃时,同浓度的Na2CO3溶液、CH3COONa溶液和NaHCO3溶液的pH是否相同?如果不同,你能得到什么经验规律?
[口诀]盐类水解的规律:在可溶性盐溶液中:有弱才水解,无弱不水解,越弱越水解,都弱都水解,谁强显谁性,同强显中性。
[归纳总结]盐类水解的实质:盐电离出弱酸阴离子,结合水电离出的H+,或盐电离出弱碱阳离子,结合水电离出的OH-,生成弱电解质,破坏了水的电离平衡,促进水的电离,使c(H+)≠c(OH-),因此盐溶液呈现不同的酸碱性。
[讲解]水解特征
①一般是可逆反应,在一定条件下达到化学平衡。
②盐类水解反应是中和反应的逆反应。
③盐类水解是吸热反应。
④水解反应程度很微弱。
⑤盐类的水解促进水的电离。
2.3新课讲授——盐类水解离子方程式的书写规则
盐类水解离子方程式的书写规则
①盐类水解是可逆反应,反应方程式中要写“ ⇌”号。
②一般盐类水解的程度很小,水解产物很少。通常不生成沉淀或气体,也不发生分解。在书写离子方程式时一般不标“↑”或“↓”,也不把生成物(如H2CO3、NH3·H2O等)写成其分解产物的形式。
③多元弱酸的盐的阴离子水解是分步进行的,以第一步为主。如Na2CO3的水解过程:
第一步:CO32-+H2O ⇌HCO3-+OH-(主要)
第二步:HCO3-+H2O ⇌H2CO3+OH-(次要)
④多元弱碱的阳离子水解复杂,书写时一步书写。如:Fe 3+的水解:Fe 3++3H2O ⇌Fe(OH)3+3H+
3.课堂小结
回顾本节课内容,总结自己的收获
4.小试牛刀
1.关于盐类水解反应的说法正确的是( )
A.溶液呈中性的盐一定是强酸强碱生成的盐
B.盐溶液的酸碱性主要决定于形成盐的酸、碱性的相对强弱
C.NaCl溶液和CH3COONH4溶液均显中性,两溶液中水的电离程度相同
D.除去CuCl2中的Fe3+,可以加入NaOH固体
2.下列关于盐类水解的说法中正确的是( )
A.任何盐均能发生水解 B.溶液的pH一定变大
C.使水的电离程度增大 D.发生氧化还原反应
3.下列盐中,能发生水解的是( )
A.NaCl B.BaCl2 C.KCl D.NH4Cl
4.下列离子方程式中,属于水解反应的是( )
A.HCOOH⇌HCOO﹣+H+ B.HCO3﹣+H2O⇌H2CO3+OH﹣
C.H2O+H2O⇌H3O++OH﹣ D.HCO3﹣⇌CO32﹣+H+
5.下列属于水解反应的离子方程式为( )
A.碳酸钠溶液呈碱性:CO32﹣+2H2O⇌H2CO3+2OH﹣
B.氯化铝溶液呈酸性:Al3++3H2O⇌Al(OH)3+3H+
C.硫氢化钠溶液呈碱性:HS﹣+H2O⇌S2﹣+H3O+
D.H2SO3溶液呈酸性:H2SO3⇌H++HSO3﹣
6.加较多量的水稀释 0.1 ml/l 的 NaHCO3 溶液,下列离子浓度会增大的是( )
A.CO32﹣ B.HCO3﹣ C.H+ D.OH﹣
7、写出下列盐水解的离子方程式:
K2S:
NaClO:_____________________________________________________
CuSO4:_____________________________________________________
8.常温下,某水溶液M中存在的离子有:Na+、A-、H+、OH-。根据题意回答下列问题:
(1)若溶液M由0.1 ml·L-1的HA溶液与0.1 ml·L-1的NaOH溶液等体积混合而得,则溶液M的pH不可能_ _7(填“大于”、“小于”或“等于”)。
(2)若溶液M的pH>7,则c(Na+)___ __c(A-)(填“>”、“<”或“=”)。
(3)常温下,若溶液M由pH=3的HA溶液V1 mL与pH=11的NaOH溶液V2 mL混合反应而得,则下列说法中正确的是____ ____(填字母)。
A.若溶液M呈中性,则溶液M中c(H+)+c(OH-)=2×10-7 ml·L-1
B.若V1=V2,则溶液M的pH一定等于7
C.若溶液M呈酸性,则V1一定大于V2
D.若溶液M呈碱性,则V1一定小于V2
9.(1)某二元酸(化学式用H2A表示)在水中的电离方程式是H2A===H++HA- HA-H++A2- 试完成下列问题:
Na2A溶液显________(填“酸性”、“中性”或“碱性”)。理由是_______________
(用离子方程式表示)。
(2)pH=5的NH4Cl溶液与pH=5的HCl溶液中由水电离出的c(H+)分别是___________、____________。
板书设计
第三节盐类的水解
一、盐溶液酸碱性
强碱弱酸盐的水溶液显碱性
强酸弱碱盐的水溶液显酸性
强酸强碱盐的水溶液显中性
二、盐类溶液呈现酸碱性的原因
1、盐类溶液呈现酸碱性的因素
总反应:NH4Cl+H2O ⇋NH3·H2O+HCl
离子方程式:NH4++H2O ⇋NH3·H2O+H+
2、盐类水解反应的规律:
有弱才水解,无弱不水解;
都弱双水解,越弱越水解;
谁强显谁性,同强显中性。
3、水解方程式的书写:
盐
NaCl
KNO3
Na2CO3
CH3COONa
NH4Cl
(NH4)2SO4
盐溶液的酸碱性
盐的类型
酸
碱
盐的类型
是否水解
盐溶液的酸碱性
强
强
强酸强碱盐
NaCl
否(无弱不水解)
中性
弱
强
弱酸强碱盐
CH3COONa
是(酸弱酸水解)
碱
强
弱
强酸弱碱盐
NH4Cl
是(碱弱碱水解)
酸
人教版 (2019)选择性必修1第四节 化学反应的调控优质教学设计及反思: 这是一份人教版 (2019)选择性必修1<a href="/hx/tb_c4002422_t8/?tag_id=27" target="_blank">第四节 化学反应的调控优质教学设计及反思</a>,共3页。教案主要包含了合成氨反应的特点,合成氨反应特点的分析,工业合成氨的适宜条件,合成氨的生产流程,影响化学反应进行的两个因素,化学反应的调控等内容,欢迎下载使用。
高中化学人教版 (2019)选择性必修1第三节 盐类的水解优秀教学设计: 这是一份高中化学人教版 (2019)选择性必修1第三节 盐类的水解优秀教学设计,共7页。教案主要包含了教学目标,教学重难点,教学过程,创设情境,进一步思考,学生活动,思考交流,课堂专练等内容,欢迎下载使用。
人教版 (2019)选择性必修1第二节 化学平衡精品教学设计: 这是一份人教版 (2019)选择性必修1第二节 化学平衡精品教学设计,共6页。教案主要包含了教学目标,教学重难点,教学过程,课堂小结等内容,欢迎下载使用。













