
高中化学人教版 (2019)选择性必修1第二节 化学平衡第三课时教学设计及反思
展开1.通过实验探究、讨论交流,从变化的角度进一步认识化学平衡的移动,即可逆反应达到平衡后,温度、催化剂等外界条件的改变,对化学平衡移动的影响,进一步学习控制变量、对比实验等科学探究方法,激发主动探究的欲望,透过现象看本质。培养学生宏观辨析与微观探析、变化观念与平衡思想、科学探究与创新意识等学科核心素养。
2.通过典例分析,问题探究、实验论证、原理分析等构建分析判断化学平衡移动方向的思维模型(勒夏特列原理)。培养学生证据推理与模型认知学科核心素养。
3.了解勒夏特列原理在生活、生产和科学领域中的应用。培养学生科学态度与社会责任学科核心素养。
教学重难点
教学重点:通过实验探究、讨论交流,从变化的角度掌握浓度、压强、温度、催化剂等对平衡移动的影响。
教学难点:通过实验论证、原理分析等构建分析判断化学平衡移动方向的思维模型(勒夏特列原理)。
教学过程
【引入】我们上节课已经探究了浓度、压强对化学平衡移动的影响,这节课我们继续探究化学平衡移动的其他影响因素。
一、小组合作,实验探究
探究实验三:
实验原理:2NO2(g) N2O4(g) ΔH=-56.9 kJ/ml
红棕色 无色
二、小组讨论,成果汇报
【小组讨论】学生分组讨论,总结实验过程中改变平衡的因素,及影响规律。
【成果汇报】本实验过程中影响平衡因素为:温度。
在其他条件不变的情况下,改变温度对化学平衡的影响规律:
升高温度(加热),平衡向吸热反应方向移动;
降低温度(降温),平衡向放热反应方向移动。
【设计意图】通过实验探究、讨论交流,从变化的角度进一步认识化学平衡的移动,即可逆反应达到平衡后,外界因素的改变,对化学平衡移动的影响,进一步学习控制变量、对比实验等科学探究方法,激发主动探究的欲望,培养学生宏观辨识与微观探析、变化观念与平衡思想的学科核心素养。
三、小试牛刀,规律总结
【小组合作总结】根据以上结论,我们各小组讨论总结一下,我们应该怎么定义化学平衡的移动的概念?
在一定条件下,当可逆反应达到平衡状态后,如果改变反应条件,平衡状态被破坏,平衡体系的物质组成也会随着改变,直到达到新的平衡状态。这种由原有的平衡状态达到新的平衡状态的过程叫做化学平衡的移动。【小组讨论总结规律】学生根据探究实验结论,对外界因素对化学平衡的影响规律进行总结。
【总结提升】综上所述,改变浓度、压强、温度等因素可以提高反应产率或者抑制反应进行的程度。法国化学家勒夏特列曾就此总结出一条经验规律:如果改变影响平衡的一个因素(如温度、压强及参加反应的物质的浓度),平衡就向着能够减弱这种改变的方向移动。这就是勒夏特列原理,也称化学平衡移动原理。
【设计意图】引导学生对实验现象进一步地分析、探索,培养学生的探索精神,培养学生归纳总结的能力,在对比分析中获得新知识。培养学生具有证据意识,能基于证据通过分析推理加以证实或证伪;建立观点、结论和证据之间的逻辑关系;通过分析认识研究对象的本质特征、及其相互关系,揭示现象的本质和规律。通过构建分析判断化学平衡移动方向的思维模型(勒夏特列原理),培养学生证据推理与模型认知学科核心素养。
化学平衡移动原理是经过反复验证的,在化学工业和环境保护等领域有十分重要的应用。根据化学平衡移动原理,可以更加科学、有效地调控和利用化学反应,尽可能地让化学反应按照人们的需要进行。如:
工业合成氨的反应原理为:N2+3H22NH3,在生产中,经常向反应体系中充入过量的氮气,使平衡正向移动,从而提高氨气的产率。
【设计意图】将化学知识与生产生活中的情境联系起来,了解化学对社会发展的重大贡献,培养学生科学精神与社会责任学科核心素养。
四、学习评价
1. Cr2O72-和CrO42-可相互转化:Cr2O72-+H2O 2CrO42- +2H+
酸性条件下,主要存在形式为__________,
碱性条件下,主要存在形式为__________。
2. 在高温下,反应2HBr(g)H2(g) +Br2(g) △H>0,要使混合气体颜色加深,可采取的方法是(双选)( )
A. 升高温度 B. 增大H2浓度
C. 增大压强(压缩容器的体积) D. 移走部分Br2(g)
3.关节炎是因为在关节滑液中形成了尿酸钠晶体,尤其是在寒冷季节易诱发关节疼痛,其化学机理如下:
①HUr(尿酸)+H2OUr-(尿酸根离子)+H3O+,
②Ur-(aq)+Na+(aq) NaUr(s)(尿酸钠)。
下列对反应②的叙述正确的是( )
A.正反应为吸热反应 B.正反应为放热反应
C.升高温度,平衡向正反应方向移动 D.降低温度,平衡向逆反应方向移动
五、课堂小结
1.温度对化学平衡移动的影响
升高温度,平衡向吸热反应方向移动;降低温度,平衡向放热反应方向移动
2.勒夏特列原理(化学平衡移动原理)
改变影响平衡的一个因素(如温度、压强及参加反应的物质的浓度),平衡就向着能够减弱这种改变的方向移动。这就是勒夏特列原理,也称化学平衡移动原理。
板书设计
第二章 化学反应速率与化学平衡
第二节 化学平衡
第3课时 影响化学平衡移动的因素(2)
探究实验三:
影响因素:温度
实验原理:
2NO2(g)N2O4(g) ΔH=-56.9 kJ/ml
红棕色 无色
三.温度对化学平衡的影响:
在其他条件不变的情况下,温度升高,会使化学平衡向着吸热反应的方向移动;温度降低,会使化学平衡向着放热反应的方向移动。
四、勒夏特列原理
勒夏特列原理:如果改变影响平衡的一个条件(如浓度、压强、温度)平衡就向能够减弱这种改变的方向移动。实验步骤
实验现象
实验结论(反应方程式)
①取两只烧杯,一杯中盛冷水,一杯中盛热水,取充有NO2和N2O4的混合气体的两只连通的烧瓶。
混合气体中存在反应
2NO2N2O4
红棕色 无色
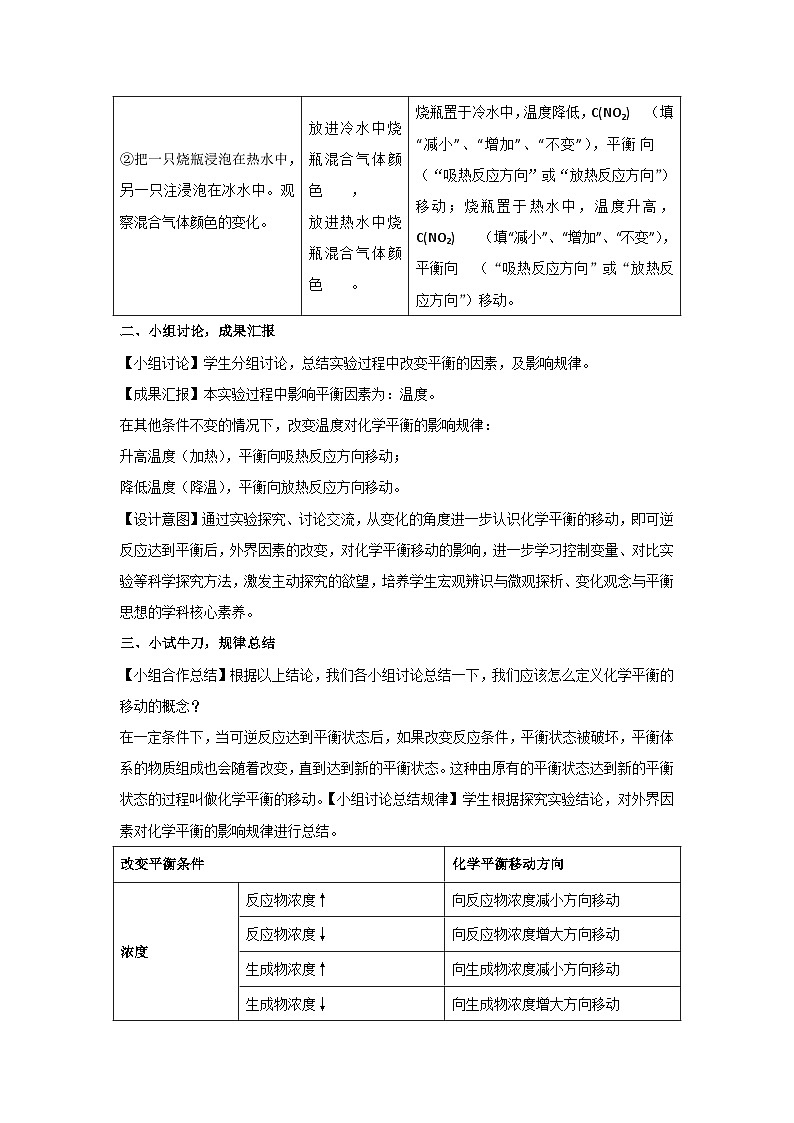
②把一只烧瓶浸泡在热水中,另一只注浸泡在冰水中。观察混合气体颜色的变化。
放进冷水中烧瓶混合气体颜色 ,
放进热水中烧瓶混合气体颜色 。
烧瓶置于冷水中,温度降低,C(NO2) (填“减小”、“增加”、“不变”),平衡 向 (“吸热反应方向”或“放热反应方向”)移动;烧瓶置于热水中,温度升高,C(NO2) (填“减小”、“增加”、“不变”),平衡向 (“吸热反应方向”或“放热反应方向”)移动。
改变平衡条件
化学平衡移动方向
浓度
反应物浓度↑
向反应物浓度减小方向移动
反应物浓度↓
向反应物浓度增大方向移动
生成物浓度↑
向生成物浓度减小方向移动
生成物浓度↓
向生成物浓度增大方向移动
压强
体系压强↑
向气体体积数减小的方向移动
体系压强↓
向气体体积数增大的方向移动
温度
温度↑
向吸热反应方向移动
温度↓
向放热反应方向移动
高中化学人教版 (2019)选择性必修1第二章 化学反应速率与化学平衡第二节 化学平衡公开课教案及反思: 这是一份高中化学人教版 (2019)选择性必修1第二章 化学反应速率与化学平衡第二节 化学平衡公开课教案及反思,共9页。教案主要包含了教学目标,教学重难点,教学过程,思考交流,课堂小结,板书设计等内容,欢迎下载使用。
高中化学人教版 (2019)选择性必修1第二节 化学平衡优秀教案及反思: 这是一份高中化学人教版 (2019)选择性必修1第二节 化学平衡优秀教案及反思,共6页。教案主要包含了教学目标,教学重难点,教学过程,回顾旧知,基础初探,思考交流,课堂练习,课堂小结等内容,欢迎下载使用。
人教版 (2019)选择性必修1第二节 化学平衡精品教学设计: 这是一份人教版 (2019)选择性必修1第二节 化学平衡精品教学设计,共6页。教案主要包含了教学目标,教学重难点,教学过程,课堂小结等内容,欢迎下载使用。













