





化学必修 第二册第一单元 金属的冶炼方法课前预习课件ppt
展开1 | 金属的存在形式及金属的冶炼
第一单元 金属的冶炼方法
必备知识 清单破
1.金属的存在形式(1)金属材料既有良好的可塑性,坚固耐用,而且还有导电、导热等诸多优良性能。(2)大量的金属元素存在于地壳的矿石中。自然界中的大部分金属元素都是以化合态形式存 在的。如铁元素存在于赤铁矿(主要成分为Fe2O3)中,铝元素存在于铝土矿(主要成分为Al2O3) 中。2.金属的冶炼(1)金属冶炼的原理:利用化学反应使金属元素从化合态变为游离态。(2)金属冶炼的方法:热分解法、高温还原法、电解法等。
(3)金属的冶炼方法与金属活动性的关系归纳总结 常见金属的冶炼方法
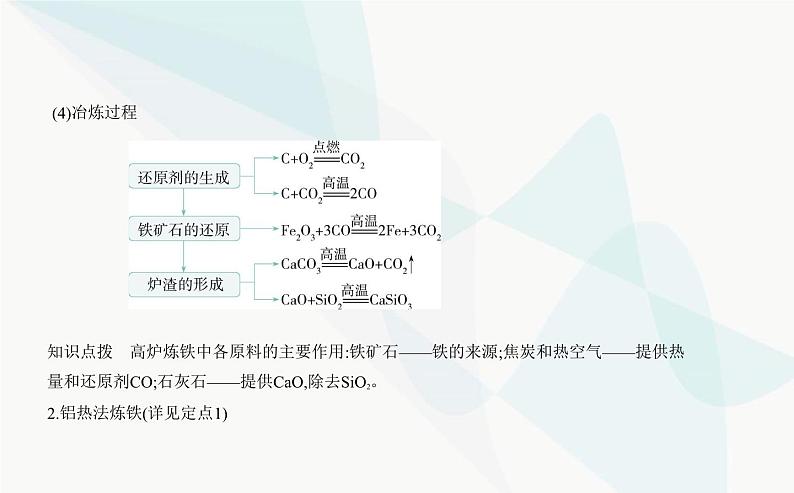
1.高炉炼铁(1)原料:铁矿石、焦炭和石灰石等。(2)设备:高炉。(3)原理:高温下,用还原剂把铁矿石中的氧化铁还原成铁单质。
知识点拨 高炉炼铁中各原料的主要作用:铁矿石——铁的来源;焦炭和热空气——提供热 量和还原剂CO;石灰石——提供CaO,除去SiO2。2.铝热法炼铁(详见定点1)
1.铝的存在(1)含量:铝元素是地壳中含量最多的金属元素。(2)存在:地壳中,铝元素主要以铝土矿形式存在,铝土矿的主要成分是Al2O3。2.从铝土矿中提取铝的工艺流程及反应(1)工艺流程
(2)有关反应①碱溶:Al2O3+2NaOH 2NaAlO2+H2O;②酸化:NaAlO2+CO2(过量)+2H2O Al(OH)3↓+NaHCO3;
③灼烧:2Al(OH)3 Al2O3+3H2O;④电解:2Al2O3(熔融) 4Al+3O2↑。
知识拓展 金属冶炼的步骤
知识辨析1.金属冶炼的本质均是金属元素被还原的过程,所以在冶炼过程中一定需要加入还原剂。这 种说法对吗?2.金属阳离子被还原,一定会得到金属单质。这种说法对吗?3.可以利用铝热反应原理,以MgO和金属铝为原料冶炼金属镁。这种说法对吗?4.Na、K等活泼金属可用高温还原法冶炼。这种说法对吗?5.金属的冶炼必须在高温下进行。这种说法对吗?6.冶炼Al时要电解熔融AlCl3。这种说法对吗?7.钾的沸点比钠低,可用钠置换熔融氯化钾中的钾。这种说法对吗?
一语破的1.不对。通过电解和热分解的方法冶炼金属不需要加入还原剂。2.不对。金属阳离子被还原可能会生成低价金属阳离子,如Fe3+→Fe2+。3.不对。镁的金属活动性比铝强,不能用铝还原MgO。4.不对。Na、K等活泼金属应该用电解法冶炼。5.不对。如湿法炼铜是在常温下发生反应:Fe+CuSO4 FeSO4+Cu。6.不对。AlCl3为共价化合物,熔融状态不导电,冶炼Al时应该电解熔融Al2O3。7.对。钾的沸点比钠低,容易分离出来,所以可用钠置换熔融氯化钾中的钾。
关键能力 定点破
铝和金属氧化物在高温下发生的剧烈并放出大量热的化学反应,叫作铝热反应。1.铝热反应实验
注意事项 ①镁条要打磨干净表面的氧化膜,否则难以点燃;②氧化铁粉末与铝粉要干燥,铝粉要用未被氧化的,否则难以反应;③内层滤纸要用水润湿,以防纸漏斗燃烧;④蒸发皿中的细沙要适量,既要防止蒸发皿炸裂,又要防止熔融的液体溅出伤人;⑤实验装置要与人有一定距离,防止人被烧伤2.铝热反应的用途 可用于冶炼熔点较高的相对较不活泼的金属,如Fe、Mn、Cr等。2Al+Fe2O3 2Fe+Al2O3(可用于焊接钢轨)4Al+3MnO2 3Mn+2Al2O32Al+Cr2O3 2Cr+Al2O3
典例 利用如图装置做铝热反应实验,下列说法不正确的是 ( ) A.该反应的化学方程式是2Al+Fe2O3 2Fe+Al2O3B.该反应会放出大量热、发出强光C.根据铝热反应的原理,可以冶炼某些高熔点的金属D.若反应中转移3 ml 电子,则消耗氧化剂的物质的量是1 ml
思路点拨 根据铝热反应实验解答此题,注意铝热反应的实验装置、实验现象以及注意事 项。
解析 该反应为高温下铝与氧化铁发生置换反应生成铁和氧化铝,化学方程式是2Al+Fe2O3 2Fe+Al2O3,A正确;铝热反应发生时会放出大量的热、发出强光,B正确;铝热反应发生时会放出大量的热,可以冶炼某些高熔点的金属,如Fe、Cr、Mn等,C正确;由化学方程式可知, 氧化铁为氧化剂,若反应中转移3 ml电子,消耗氧化铁的物质的量为0.5 ml,D错误。
易错分析 有关铝热反应的两个易错点(1)铝热反应可以用于焊接钢轨,但工业上不用该方法炼铁,因为铝比铁的冶炼成本更高。(2)由于铝只能冶炼活泼性比其弱的金属,故并不是铝与所有金属氧化物的混合物都叫铝热 剂,如Al和MgO的混合物不能叫铝热剂。
高中化学苏教版 (2019)必修 第二册第一单元 金属的冶炼方法备课课件ppt: 这是一份高中化学苏教版 (2019)必修 第二册<a href="/hx/tb_c4002529_t3/?tag_id=26" target="_blank">第一单元 金属的冶炼方法备课课件ppt</a>,共1页。
苏教版 (2019)必修 第二册第一单元 金属的冶炼方法集体备课ppt课件: 这是一份苏教版 (2019)必修 第二册<a href="/hx/tb_c4002529_t3/?tag_id=26" target="_blank">第一单元 金属的冶炼方法集体备课ppt课件</a>,共29页。PPT课件主要包含了金属的存在形式,金属的冶炼,设备炼铁高炉,冶炼过程,观察思考,电解法较活泼的金属,拓展视野等内容,欢迎下载使用。
高中化学苏教版 (2019)必修 第二册第一单元 金属的冶炼方法授课课件ppt: 这是一份高中化学苏教版 (2019)必修 第二册<a href="/hx/tb_c4002529_t3/?tag_id=26" target="_blank">第一单元 金属的冶炼方法授课课件ppt</a>,共60页。PPT课件主要包含了图说考点,基础知识,技能素养,课堂检测,氧化物,硫酸盐,自然银,辉银矿Ag2S,碲银矿Ag2Te,金属冶炼的方法等内容,欢迎下载使用。













