





所属成套资源:全套苏教版高中化学必修第二册专题课时课件+练习含答案
苏教版 (2019)必修 第二册第二单元 探究铁及其化合物的转化课前预习ppt课件
展开
这是一份苏教版 (2019)必修 第二册第二单元 探究铁及其化合物的转化课前预习ppt课件,共36页。PPT课件主要包含了1图示等内容,欢迎下载使用。
1 | 反应的合理选择(以Fe为例)
第二单元 探究铁及其化合物的转化
必备知识 清单破
1.铁元素的常见价态有+2、+3价,在相同价态铁元素化合物之间相互转化,通过非氧化还原
反应即可实现;在不同价态铁元素化合物之间相互转化,则需通过氧化还原反应才能实现。2.物质制备反应路线的选择(1)以铁屑为原料制取氯化铁路径Ⅰ:Fe→FeCl3路径Ⅱ:Fe→FeCl2→FeCl3路径Ⅲ:Fe→Fe2O3→FeCl3
路径Ⅰ:2Fe+3Cl2 2FeCl3。路径Ⅱ:Fe+2HCl FeCl2+H2↑、2FeCl2+Cl2 2FeCl3。路径Ⅲ:4Fe+3O2 2Fe2O3、Fe2O3+6HCl 2FeCl3+3H2O。(3)实际制备物质时,必须根据反应原料、反应条件、反应步骤、产物要求、反应装置、环
境保护、生产成本等因素进行综合判断,选择合适、可控的反应路径。
(2)三条路径的化学方程式
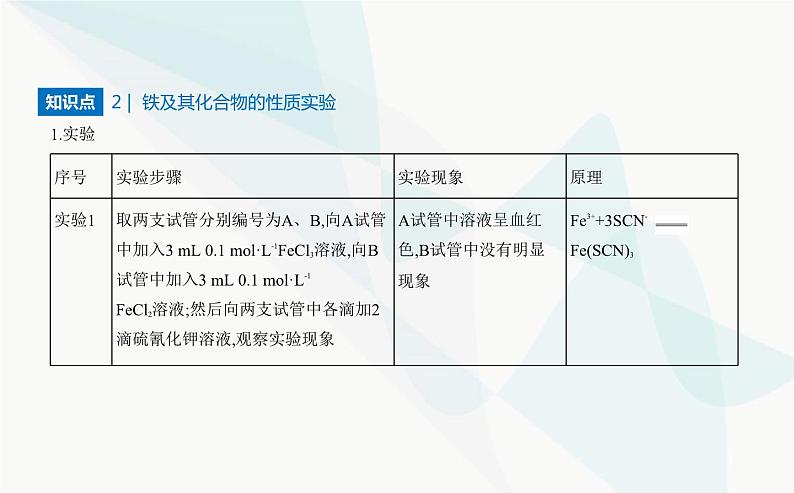
2 | 铁及其化合物的性质实验
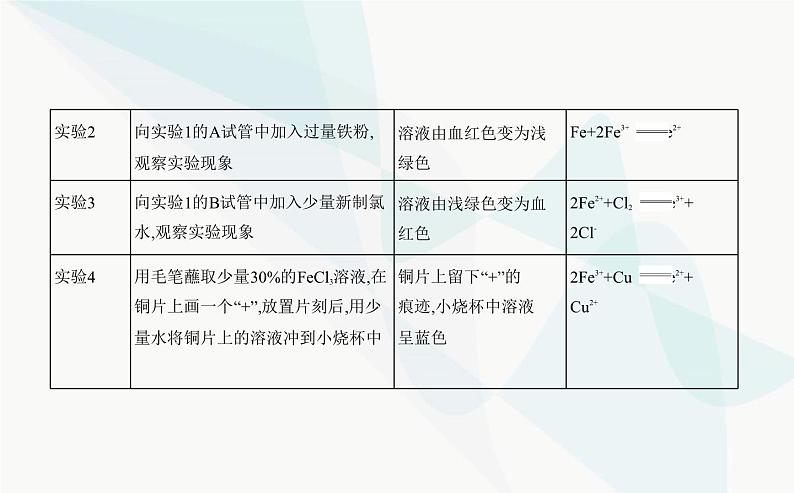
特别提醒 (1)化学上常用KSCN溶液检验Fe3+,反应的离子方程式是Fe3++3SCN- Fe(SCN)3,现象是溶液由黄色变成血红色。(2)Fe2+的检验方法:加入KSCN溶液无明显现象,再滴入新制氯水,溶液变成血红色。(3)当溶液中Fe2+和Fe3+共存时,Fe3+的存在对Fe2+的检验会造成干扰。 2.Fe3+和Fe2+的转化(1)Fe2+容易被氧化剂氧化为Fe3+,如Fe2+与H2O2反应的离子方程式为2Fe2++H2O2+2H+ 2Fe3++2H2O。(2)Fe3+能够被还原剂还原为Fe2+,如Fe3+与Fe反应的离子方程式为Fe+2Fe3+ 3Fe2+。
化学反应都是在一定条件下发生的。反应条件对化学反应有很大影响。在研究物质的
性质和制备时,应依据化学反应的规律和反应物、生成物的特点,合理选择并控制好反应条
件。已知:亚铁盐非常容易被氧气等氧化剂氧化,氢氧化亚铁也很不稳定,容易被空气中的氧
气氧化。做如下对比实验:
3 | 反应条件的控制
由上述实验可知,在实验室中,利用亚铁盐与氢氧化钠溶液反应制备氢氧化亚铁时,必须
使用新制的亚铁盐溶液与不含溶解氧的氢氧化钠溶液;在反应过程中还要采取措施,防止反
应物、产物与氧气接触。特别提醒 Fe3+具有氧化性,则Fe(OH)3与还原性酸反应时,不一定只发生酸碱中和反应,还可
能发生氧化还原反应;Fe2+具有还原性,则Fe(OH)2与氧化性酸反应时,不一定只发生酸碱中和
反应,还可能发生氧化还原反应。由此可推出,酸与碱之间的反应并不一定只是中和反应。
知识辨析1.铁是较活泼金属,能与盐酸反应生成FeCl3和H2,铁丝在氧气中燃烧生成Fe2O3。这种说法对
吗?2.Fe在足量Cl2中燃烧生成FeCl3,在少量Cl2中燃烧生成FeCl2。这种说法对吗?3.向含Fe3+的溶液中滴入KSCN溶液,立即出现血红色沉淀。这种说法对吗?4.某溶液通Cl2后,再加入KSCN溶液,溶液变为血红色,可以判断原溶液中一定存在Fe2+。这种
说法对吗?5.Fe2O3不能与水反应生成Fe(OH)3,所以不能通过化合反应制备Fe(OH)3。这种说法对吗?6.Zn比Fe活泼,把少量锌粉放入FeCl3溶液中,有单质Fe生成。这种说法对吗?
一语破的1.不对。铁与盐酸反应生成FeCl2和H2,铁丝在氧气中燃烧生成Fe3O4。2.不对。Fe在Cl2中燃烧一定生成FeCl3,与反应物的量无关。3.不对。溶液变为血红色,不是生成血红色沉淀。4.不对。原溶液中可能存在Fe3+而不含Fe2+。Fe2+的检验方法是先加入KSCN溶液,溶液无明显
现象,再通Cl2,溶液呈血红色。5.不对。Fe(OH)3可通过化合反应4Fe(OH)2+O2+2H2O 4Fe(OH)3制备。6.不对。少量的锌粉与FeCl3反应的离子方程式为Zn+2Fe3+ Zn2++2Fe2+,没有单质Fe生成,过量的锌粉放入FeCl3溶液中,有单质Fe生成。
1 | Fe、Fe2+、Fe3+之间的相互转化
关键能力 定点破
2.转化示例(1)Fe Fe2+:Fe+2H+ Fe2++H2↑;Zn+Fe2+ Fe+Zn2+。(2)Fe Fe3+:2Fe+3Cl2 2FeCl3;3CO+Fe2O3 2Fe+3CO2。(3)Fe2+ Fe3+:2Fe2++Cl2 2Fe3++2Cl-;2Fe3++Fe 3Fe2+。3.“铁三角”转化关系的应用(1)判断离子共存a.Fe3+与I-、S2-、HS-等因发生氧化还原反应而不能大量共存。b.酸性条件下,Fe2+与ClO-、Mn 、N 等因发生氧化还原反应而不能大量共存。
链接拓展 (1)在配制含Fe2+的溶液时,向溶液中加入少量铁粉,目的是防止Fe2+被空气中的氧
气氧化成Fe3+。(2)为除去废水中的Fe2+,常先将废水中的Fe2+氧化为Fe3+,再调节溶液的pH使Fe3+转化为红褐色的Fe(OH)3沉淀析出。
典例1 向Fe2O3、CuO、Fe、Cu的混合粉末中加入过量的稀硫酸,充分反应后,仍有红色粉末
存在,则关于所得溶液中金属阳离子的判断正确的是 ( )A.只有Fe2+和Cu2+B.一定有Fe2+、Cu2+,可能有Fe3+C.一定有Fe2+,可能有Cu2+D.只有Fe2+
思路点拨 根据稀硫酸过量及充分反应后,仍有红色粉末存在,可知红色粉末是Cu,则溶液中
一定不含Fe3+,因为Cu+2Fe3+ 2Fe2++Cu2+。
解析 混合粉末中加入过量稀硫酸后,仍有红色粉末Cu存在,说明所得溶液中一定没有Fe3+,
一定含有Fe2+,可能含有Cu2+,C符合题意。
典例2 某兴趣小组以部分被氧化的FeSO4为原料,制取高纯度的Fe2O3。流程图如下: (1)在“溶解”过程中,H2O2是氧化剂,试写出加入H2O2、稀H2SO4后发生反应的离子方程式:
。(2)简述检验“溶解”过程中Fe2+是否已被完全氧化成Fe3+的实验操作:
2Fe2++H2O2+2H+ 2Fe3++2H2O
于试管中,向其中滴入适量待测液,若酸性KMnO4溶液紫红色没有褪去,说明Fe2+已被完全氧化
取少量酸性KMnO4溶液
(可供选择的试剂:酸性KMnO4溶液、KSCN溶液、氯水)。(3)“沉铁”过程中产生红褐色沉淀,试写出相关反应的化学方程式: 。(4)操作A包括 、洗涤、干燥、 ;写出操作A中发生反应的化学方程式: 。
2Fe(OH)3↓+3(NH4)2SO4
6NH3∙H2O+Fe2(SO4)3
2Fe(OH)3 Fe2O3+3H2O
思路点拨 依据题给流程图分析,H2O2的作用是将Fe2+氧化为Fe3+,NH3∙H2O的作用是将Fe3+
转化为Fe(OH)3,据此解答此题。
解析 (1)H2O2是绿色氧化剂,加入H2O2是为了将Fe2+氧化为Fe3+,离子方程式为2Fe2++H2O2+2H+
2Fe3++2H2O。(2)检验“溶解”过程中Fe2+是否已被完全氧化成Fe3+,即检验是否含Fe2+,可利用Fe2+的还原性,用酸性高锰酸钾溶液检验,若Fe2+有剩余,酸性高锰酸钾溶液能被Fe2+还原
而褪色。(3)“沉铁”过程中产生红褐色沉淀,是硫酸铁和一水合氨反应生成氢氧化铁,相关
反应的化学方程式为Fe2(SO4)3+6NH3·H2O 2Fe(OH)3↓+3(NH4)2SO4。(4)从溶液中分离出Fe(OH)3沉淀,需要过滤、洗涤、干燥,然后灼烧或加热使氢氧化铁分解为氧化铁和水;操作A
中发生反应的化学方程式为2Fe(OH)3 Fe2O3+3H2O。
1.观察溶液颜色的方法 2.加KSCN溶液和氯水的方法 3.加NaOH溶液的方法
2 | Fe2+和Fe3+的检验方法
4.加酸性KMnO4溶液的方法 5.插入铜片的方法 知识拓展 同时含有Fe2+、Fe3+的检验方法
典例1 向某溶液中滴加KSCN溶液,无明显现象,再向其中滴加氯水,溶液变为血红色,则下列
说法正确的是 ( )A.原溶液中一定含有Fe3+,不含Fe2+B.原溶液中的Fe2+被还原为Fe3+C.原溶液中一定含有Fe2+,不含Fe3+D.原溶液中同时含Fe2+和Fe3+
思路点拨 依据Fe2+、Fe3+的检验方法解答此题。
解析 向溶液中滴加KSCN溶液,无明显现象,可知不含Fe3+,再向其中滴加氯水,溶液变为血红
色,可知Fe2+被氧化生成Fe3+,则原溶液中一定含有Fe2+,不含Fe3+,故选C。
典例2 选择合适试剂完成甲、乙两组实验。甲组:检验Fe2(SO4)3溶液中含有FeSO4;乙组:检验FeSO4溶液中含有Fe2(SO4)3。下列试剂及加入顺序能达到实验目的的是( )
思路点拨 掌握检验Fe2+和Fe3+的几种方法,在不同情境下采用不同的检验方法。
解析 甲组:在Fe3+存在的条件下检验Fe2+,要排除Fe3+的干扰。所选试剂具备下列条件:一是
能与Fe2+发生有明显现象的反应;二是与Fe3+不反应。酸性KMnO4溶液符合条件,实验现象是
溶液紫色褪去。乙组:在Fe2+存在的条件下检验Fe3+,用KSCN溶液即可,实验现象是溶液变为
血红色。
特别提醒 (1)检验Fe2+时不能先加氯水后加KSCN溶液,否则不能排除Fe3+的干扰;当溶液较
稀时,利用观察法不宜检验Fe2+和Fe3+的存在。(2)检验含Fe2+和Fe3+的混合溶液时,要分两次分别检验,检验Fe2+时可选择酸性高锰酸钾溶液,
检验Fe3+时最好选择KSCN溶液。(3)若检验FeCl3中是否混有FeCl2,一般不采用酸性KMnO4溶液检验,因为Cl-也能与酸性KMnO4
溶液发生氧化还原反应,对F 的检验有干扰。
1.制备原理(1)可溶性亚铁盐(如FeSO4)与强碱(如NaOH)溶液反应:Fe2++2OH- Fe(OH)2↓。(2)白色沉淀Fe(OH)2很容易被O2氧化为红褐色的Fe(OH)3。因此实验过程中一定要防止生成
的Fe(OH)2被氧化,应与O2隔绝。2.防止Fe(OH)2被氧化的措施(1)将用于配制溶液的蒸馏水煮沸,使O2逸出。(2)将盛有NaOH溶液的胶头滴管尖嘴插入试管中亚铁盐溶液底部(不接触试管底),并慢慢挤
出NaOH溶液。(3)在试管中亚铁盐溶液的上方充入保护气,如H2、N2、稀有气体等。(4)在试管中亚铁盐溶液上面加保护层,如苯(密度小于水,与水不互溶)、植物油等。
3 | Fe(OH)2的制备
3.常见实验装置 ① ② ③
典例 如图所示装置可用于制取Fe(OH)2并观察Fe(OH)2被O2氧化时颜色的变化。实验提供的
试剂:铁屑、稀硫酸、NaOH溶液等,下列说法不正确的是 ( ) A.烧瓶A中发生反应的离子方程式为Fe+2H+ Fe2++H2↑B.实验开始前先打开止水夹E,其目的是利用产生的H2将装置中的空气排尽C.生成Fe(OH)2的操作:关闭止水夹E,将烧瓶A中FeSO4溶液压入装置B中进行反应
D.若取下装置B的橡胶塞,可观察到沉淀由白色迅速变为红褐色
解析 制取Fe(OH)2应使用FeSO4溶液和NaOH溶液,需在隔绝空气条件下制备Fe(OH)2。结合
图示装置可知装置B中是NaOH溶液,A中利用Fe和稀硫酸反应可制备FeSO4。烧瓶A中反应
的离子方程式为Fe+2H+ Fe2++H2↑,A项正确;实验开始时应利用A中产生的H2排出装置中的空气,即实验开始前需打开止水夹E,B项正确;当装置B中空气排尽后,可关闭止水夹E,随着
A中不断反应,A中压强增大,将A中FeSO4溶液压入装置B中反应生成Fe(OH)2,C项正确;取下
装置B的橡胶塞,Fe(OH)2被空气中的O2氧化,看到白色固体迅速变成灰绿色,最后变成红褐色,
D项错误。
证据推理与模型认知——新情境下铁及其化合物的相互转化
学科素养 情景破
材料一 腌制食品中含有亚硝酸盐,人若进食了较多含亚硝酸盐的腌制品,会导致人体缺氧,
临床上有很多这种病人。铁元素是人体含量最高的微量元素,血红蛋白中含有Fe2+,正是这些
Fe2+使血红蛋白具有载氧能力,如果Fe2+被氧化成Fe3+,血红蛋白就会失去载氧能力。维生素C
具有还原性,可将Fe3+还原成Fe2+,所以很多补铁剂都建议与维生素C同时服用。材料二 利用“价—类”二维图能更好地掌握元素化合物的性质,明确元素化合物之间转化
的关系。铁元素的“价—类”二维图如图所示:
问题1 食用过多含亚硝酸盐的腌制品,为什么会导致人体缺氧?如果你是医生,针对这样的病
人,需要进行化验,你会检验什么?该如何开处方?
问题2 不同价态的物质转化一般利用氧化还原反应,试用离子方程式表示Fe2+、Fe3+之间的转化(各写一个即可)。
提示 2Fe3++Fe 3Fe2+,2Fe2++Cl2 2Fe3++2Cl-。
提示 亚硝酸盐具有较强的氧化性,能够将血红蛋白中的Fe2+氧化为Fe3+,使血红蛋白失去载氧能力,造成人体缺氧。需要检验病人血液中Fe3+的含量是否超标;维生素C具有还原性,能够将Fe3+还原为Fe2+,所以应让病人服用维生素C。
问题3 高铁酸钾是一种新型高效消毒剂,主要用于饮用水的消毒和净化。从元素价态的角度
分析高铁酸钾消毒的原理。为什么高铁酸钾还能净水?提示 高铁酸钾中铁元素为+6价,具有强氧化性,能杀菌、消毒。高铁酸钾的还原产物为Fe3+,在溶液中能形成胶体,能吸附水中的杂质和异味,起到净水的作用。
例题 将H2S和O2的混合气体通入FeCl2、CuCl2、FeCl3的混合溶液中反应,可回收S,转化过程
如图所示。下列描述正确的是( ) A.在图示转化关系中,化合价不变的元素只有氢、氯元素B.过程Ⅰ反应的离子方程式为4Fe2++O2+4H+ 4Fe3++2H2OC.通入过量的氧气或者增大Fe3+的浓度可以增大回收的S中CuS的含量D.转化过程中参加循环反应的离子只有Fe2+、Fe3+
素养解读 本题以物质转化过程图像为情境素材,考查铁、硫等元素的化合物的转化,提升
学生分析问题、解决问题的能力,培养证据推理与模型认知的化学学科核心素养。
信息提取 根据转化过程图中的箭头分析各步反应的反应物和生成物,确定相关反应的离子
方程式。
解题思路 观察题图中各种物质可知,H、Cl、Cu三种元素的化合价没有变化,A项错误;由
图示可知,Fe2+和O2在过程Ⅰ中发生反应生成Fe3+,根据得失电子守恒、电荷守恒和原子守恒,
可得过程Ⅰ反应的离子方程式为4Fe2++O2+4H+ 4Fe3++2H2O,B项正确;过程Ⅲ的反应为CuS+2Fe3+ S+2Fe2++Cu2+,可知通入过量的氧气或者增大Fe3+的浓度会减小回收的S中CuS的含量,C项错误;据图可知,过程Ⅰ的反应为4Fe2++O2+4H+ 4Fe3++2H2O,过程Ⅱ的反应为Cu2++H2S 2H++CuS↓,过程Ⅲ的反应为CuS+2Fe3+ S+2Fe2++Cu2+,据此可知参加循环反应的离子有Fe2+、H+、Cu2+、Fe3+,D项错误。
相关课件
这是一份高中化学苏教版 (2019)必修 第二册第二单元 探究铁及其化合物的转化课文内容ppt课件,共35页。PPT课件主要包含了反应的合理选择,铁的物理性质,铁的用途,学科提炼,方法导引,现象红色褪去,Fe3+的检验方法,Fe2+的检验方法,反应条件的控制,实验探究等内容,欢迎下载使用。
这是一份苏教版 (2019)必修 第二册第二单元 探究铁及其化合物的转化图片ppt课件,共60页。PPT课件主要包含了图说考点,基础知识,技能素养,课堂检测,2铁的氧化物,二价铁,三价铁,FeOH3,答案B,答案C等内容,欢迎下载使用。
这是一份高中化学苏教版 (2019)必修 第二册专题9 金属与人类文明第二单元 探究铁及其化合物的转化备课课件ppt,共58页。PPT课件主要包含了图说考点,基础知识,技能素养,课堂检测,烧杯和玻璃棒,Cu和Fe,答案B,答案D,溶液变成蓝色,答案A等内容,欢迎下载使用。











