






高中化学人教版 (2019)选择性必修1第二章 化学反应速率与化学平衡第一节 化学反应速率多媒体教学课件ppt
展开
这是一份高中化学人教版 (2019)选择性必修1第二章 化学反应速率与化学平衡第一节 化学反应速率多媒体教学课件ppt,共25页。PPT课件主要包含了新课导入,化学反应的碰撞理论,有效碰撞与活化能,没足够的能量,足够的能量合适的取向,借鉴投篮获得灵感,没合适的取向,ΔH=E1-E2,单位体积内活化分子数,升高温度等内容,欢迎下载使用。
问:为什么不同反应速率千差万别,同一反应,条件不同,速率也不同?
绝大多数的化学反应,并不是简单一步(一蹴而就)就完成的,化学反应是有历程的。
你对“化学反应是有历程的”这一说法有哪些理解?
分步进行,反应时间较长
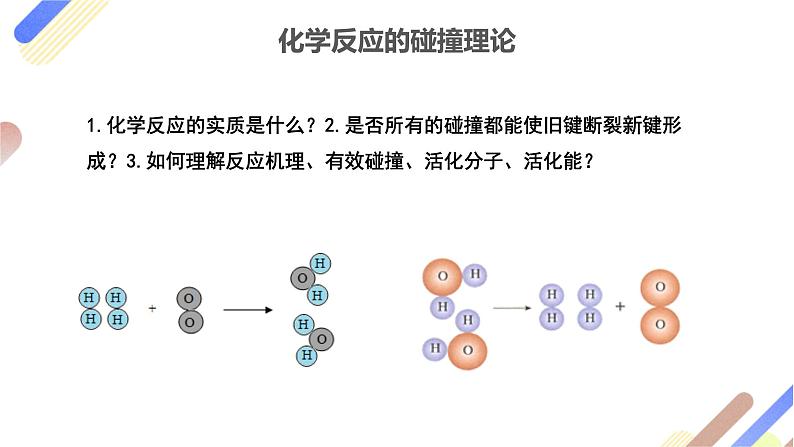
1.化学反应的实质是什么?2.是否所有的碰撞都能使旧键断裂新键形成?3.如何理解反应机理、有效碰撞、活化分子、活化能?
1、基元反应与反应历程
(1)基元反应:大多数的化学反应往往经过多个反应步骤才能实现。其中每一步反应都称为基元反应如:2HI=H2+I2的2个基元反应为2HI→H2+2I·、2I·―→I2
注意:I·,叫自由基(带有单电子的原子或原子团)
(2)反应机理:先后进行的基元反应反映了化学反应的反应历程,反应历程又称反应机理
(3)许多化学反应都不是基元反应,而是由两个或多个基元步骤完成的。
假设反应:A2+B=A2B是分两个基元步骤完成的第一步 A2+c→2A (慢反应)第二步 2A+B→A2B+c (快反应)
对于总反应来说,决定反应速率的肯定是第一个基元步骤,即这种前一步的产物作为后一步的反应物的连串反应的。
问:总反应速率的快慢由那一步决定?
决定速率的步骤是最慢的一个基元步骤
反应机理中间体、催化剂的判断(1)中间体:只在过程中出现[比如A];(2)催化剂:反应前后存在,过程中不存在[比如c]。催化剂直接和原料反应,可循环再生
(4)基元反应发生的先决条件:基元反应发生的先决条件是反应物的分子必须发生碰撞,但是并不是每一次分子碰撞都能发生化学反应
在某个化学反应中,那么多的反应物分子,其能量高低各不相同。并且,在通常状况下,能量相对较高的分子所占的比例较小,能量相对较低的分子所占的比例较大。研究证明,只有能量高度达到某一定值的分子,才能在碰撞以后有可能使原子间的化学键断裂,从而导致化学反应的发生。我们把能够发生化学反应的分子碰撞叫做有效碰撞,把能够发生有效碰撞的分子叫做活化分子。(但是活化分子也并不是每次碰撞都能引起化学反应的发生)
(1)化学反应与有效碰撞
(2)活化分子:具有足够能量能发生有效碰撞的分子。
3)活化分子的有效碰撞
2)碰撞时 取向不合适
1)碰撞时 能量不足
HI分子的几种可能的碰撞模式
注意:某化学反应一定条件下,反应物分子中活化分子百分数是一定的
4.活化能:具有的平均能量与反应物分子具有的平均能量之差称为活化能。
反应物、生成物的能量与活化能的关系图
问:化学反应速率与活化分子、有效碰撞有什么关系??
活化分子变成生成物分子放出的能量
该反应是吸热反应还是放热反应?
活化能与反应热有关吗?
活化能越小,普通分子就越容易变成活化分子。
用有效碰撞理论解释外界条件对化学反应速率的影响
1.浓度对反应速率的影响
2.压强对反应速率的影响
3.温度对反应速率的影响
单位体积活化分子数增多
单位时间内有效碰撞次数增多
4.催化剂对反应速率的影响
催化剂能改变反应的历程
影响化学反应速率的外因
1.反应C(s,石墨)+H2O(g) ⇌CO(g)+H2(g)在一可变容积的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是( )A.用纳米石墨代替普通石墨B.将容器的容积缩小一半C.保持容积不变,充入Ne使体系压强增大D.保持压强不变,充入Ne使容器容积增大
2.下列说法错误的是( )①碰撞理论认为,反应物分子间进行碰撞才可能发生化学反应②活化分子间的碰撞一定是有效碰撞③催化剂加快反应速率的本质是降低了反应的活化能④只有增加活化分子的百分含量才能加快反应速率⑤对于基元反应而言,温度升高,反应速率一定增加A.①④ B.②④ C.③⑤ D.②⑤
3.某实验探究小组研究340 K时N2O5的分解反应:2N2O5 ⇌4NO2+O2。该小组同学根据表中的实验数据绘制下图。下列说法中正确的是( )
A.曲线Ⅰ是N2O5的变化曲线B.曲线Ⅱ是O2的变化曲线C.N2O5的浓度逐渐减小,反应速率越小D.O2的浓度逐渐增大,反应速率越大
5.在一密闭容器中,充入1 ml N2和3 ml H2,并在一定温度和压强条件下,使其发生反应:N2(g)+3H2(g)⇌2NH3(g) ΔH=-92.4 kJ/ml。(1)若保持容器容积不变,再向其中充入1 ml N2,反应速率会 (填“加快”“减慢”或“不变”,下同),理由是 。(2)若保持容器容积不变,再向其中充入1 ml氩气,反应速率会_____,理由是 。(3)若保持容器内气体压强不变,再向其中充入1 ml N2和3 ml H2,反应速率会_____,理由是
。(4)使用催化剂,反应速率会_____,理由是
。
增大了反应物的浓度,活化分子数目增多,反应速率加快
反应物的浓度没有改变,反应速率不变
在一定温度和压强条件下,气体体积和气体的物质的量成正比,容器的容积增大,反应物的浓度没有改变,反应速率就不会改变
催化剂可以降低反应的活化能,提高活化分子的百分数,反应速率加快
相关课件
这是一份化学选择性必修1第一节 原电池图片ppt课件,共19页。PPT课件主要包含了原理维度,完善化学电源认知模型,实践应用,总结提升,结构简单一次电池,反复使用二次电池,连续工作燃料电池,新型电池,电解质溶液等内容,欢迎下载使用。
这是一份高中第二章 化学反应速率与化学平衡第二节 化学平衡集体备课ppt课件,共25页。PPT课件主要包含了增大反应物的浓度,降低温度,增大压强,使用催化剂,ACDF,催化剂,向正反应方向,气体体积的变化,平衡曲线,平衡点等内容,欢迎下载使用。
这是一份高中化学人教版 (2019)选择性必修1第二章 化学反应速率与化学平衡第一节 化学反应速率精品ppt课件,共16页。PPT课件主要包含了有效碰撞,随堂练习,答案C等内容,欢迎下载使用。










