


2024北部湾经济区中考化学二轮复习主题一 常见的酸和碱 (课件)
展开
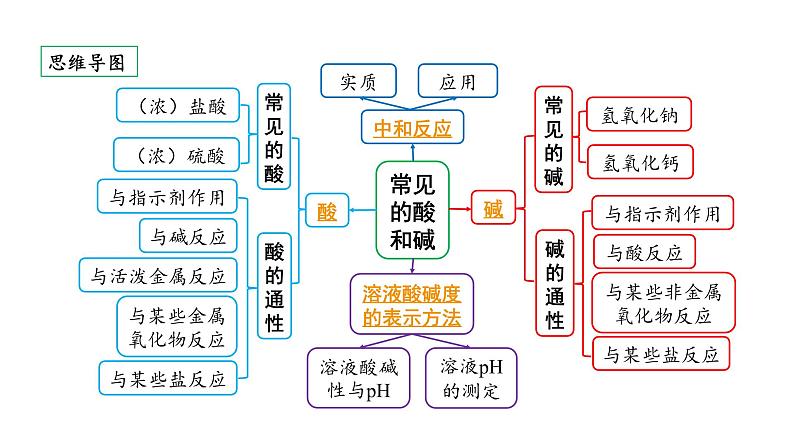
这是一份2024北部湾经济区中考化学二轮复习主题一 常见的酸和碱 (课件),共31页。PPT课件主要包含了常见的酸和碱,思维导图,常见的酸,盐酸HCl,氢离子或H+,刺激性,HCl,水蒸气,硫酸H2SO4,浓硫酸性质等内容,欢迎下载使用。
定义:在水溶液中解离时产生的阳离子全部是_____________的化合物,即酸→H++酸根离子
性质:无色、有_______气味的液体;浓盐酸易_____,能在空气中形 成____(从浓盐酸中挥发出的_____气体与空气中的______接触 形成)用途:用于金属表面除锈、制造药物等;胃液中含有_____帮助消化
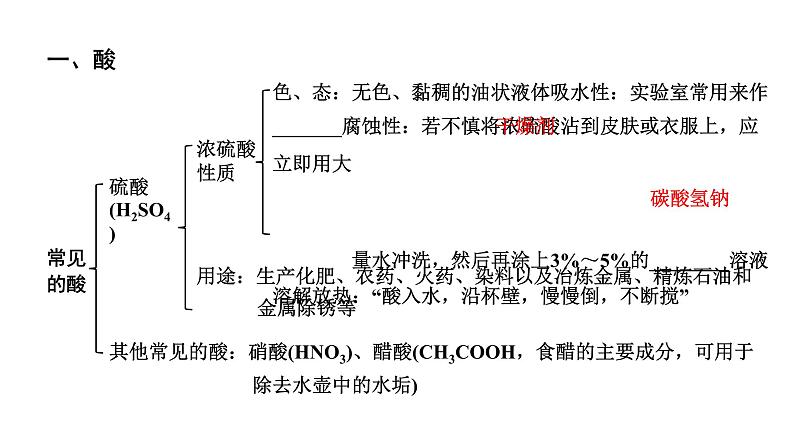
色、态:无色、黏稠的油状液体吸水性:实验室常用来作_______腐蚀性:若不慎将浓硫酸沾到皮肤或衣服上,应立即用大 量水冲洗,然后再涂上3%~5%的________溶液溶解放热:“酸入水,沿杯壁,慢慢倒,不断搅”
用途:生产化肥、农药、火药、染料以及冶炼金属、精炼石油和 金属除锈等
其他常见的酸:硝酸(HNO3)、醋酸(CH3COOH,食醋的主要成分,可用于 除去水壶中的水垢)
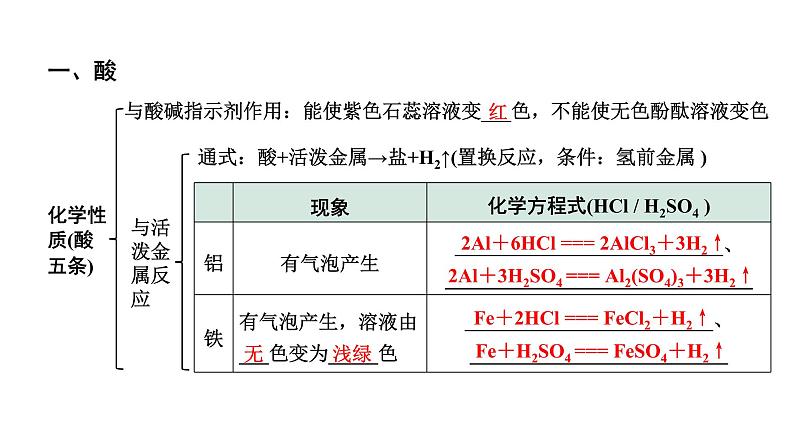
与酸碱指示剂作用:能使紫色石蕊溶液变___色,不能使无色酚酞溶液变色
通式:酸+活泼金属→盐+H2↑(置换反应,条件:氢前金属 )
2Al+6HCl === 2AlCl3+3H2↑
2Al+3H2SO4 === Al2(SO4)3+3H2↑
Fe+2HCl === FeCl2+H2↑
Fe+H2SO4 === FeSO4+H2↑
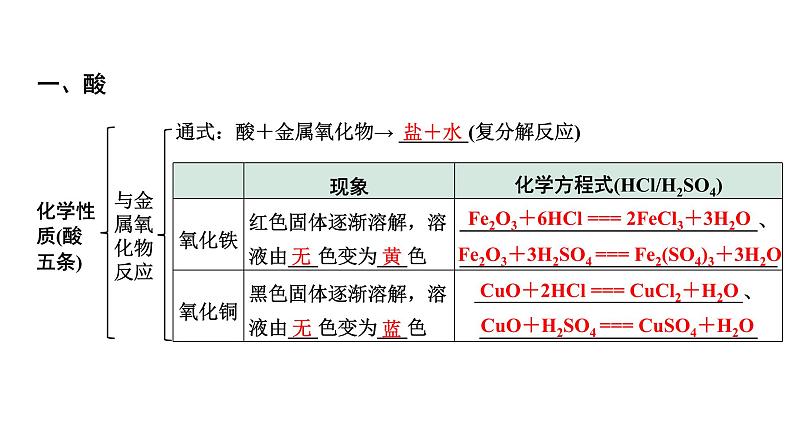
通式:酸+金属氧化物→ _______(复分解反应)
Fe2O3+6HCl === 2FeCl3+3H2O
Fe2O3+3H2SO4 === Fe2(SO4)3+3H2O
CuO+2HCl === CuCl2+H2O
CuO+H2SO4 === CuSO4+H2O
通式:酸+碱→ _______(复分解反应)
NaOH+HCl === NaCl+H2O
H2SO4+Ba(OH)2 === BaSO4↓+2H2O
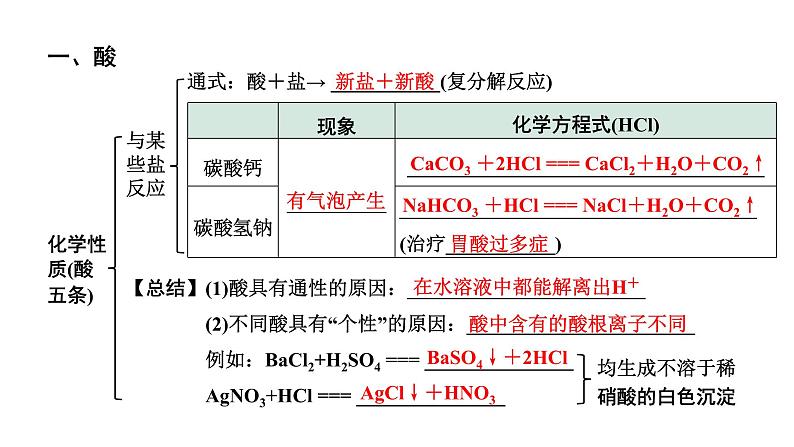
通式:酸+盐→ ___________(复分解反应)
【总结】(1)酸具有通性的原因:________________________ (2)不同酸具有“个性”的原因:_______________________ 例如:BaCl2+H2SO4 === _______________ AgNO3+HCl === _______________
均生成不溶于稀 硝酸的白色沉淀
CaCO3 +2HCl === CaCl2+H2O+CO2↑
NaHCO3 +HCl === NaCl+H2O+CO2↑
在水溶液中都能解离出H+
酸中含有的酸根离子不同
BaSO4↓+2HCl
定义:在水溶液中解离时产生的阴离子全部是__________________的化合物,即碱 →金属离子(或铵根离子) +OH-
NaOH:俗称苛性钠、_____或烧碱。白色块状固体,有强烈的_____性,___ 溶于水,并放出大量的热。易吸收水分而_____(物理性质),故可作 _____剂(不能干燥酸性气体)。作炉具清洁剂去油污、制取肥皂、石 油、造纸、纺织和印染等工业 Ca(OH)2 : 俗称_______、_______。 白色粉末状,___溶于水。溶解度随温度 的升高而_____,可由氧化钙制得,化学方程式为______________ _________。作建筑材料、改良酸性土壤、配制农药波尔多液等
有颜色且不溶于水的碱:如 Cu(OH)2 为___色沉淀,Fe(OH)3 为_____色沉淀
氢氧根离子(或OH-)
CaO+H2O ===
与酸碱指示剂作用:使紫色石蕊溶液变___色,使无色酚酞溶液变___色
与某些非金属氧化物反应
通式:碱+非金属氧化物 →_______
2NaOH+CO2 === Na2CO3+H2O
Ca(OH)2+CO2 === CaCO3↓+H2O
与酸反应 (中和反应)
通式:碱+酸 →_______(复分解反应)
HCl+NaOH === NaCl+H2O
2HCl+Ca(OH)2 === CaCl2+2H2O
H2SO4+2NaOH === Na2SO4+2H2O
H2SO4+Ca(OH)2 === CaSO4+2H2O
通式:碱+盐 →___________(复分解反应)
【总结】(1)碱具有通性的原因:_________________________ (2)不同碱具有“个性”的原因:___________________________ 例如:Na2CO3+Ca(OH)2 === __________________, 现象: _______________
3NaOH+FeCl3===3NaCl+Fe(OH)3↓
2NaOH+CuSO4===Na2SO4+Cu(OH)2↓
在水溶液中都能解离出OH-
碱溶液中解离出的阳离子不同
2NaOH+CaCO3↓
定义:___和___作用生成___和___的反应微观实质:酸中的氢离子(H+)与碱中的氢氧根离子(OH-)结合生成水分子,即H++ OH- === H2O表达式:酸+碱→ 盐+水酸碱中和反应(详见精练本微专题7)
农业:改良土壤的酸碱性;工业:处理工厂废水;医疗:治疗胃酸过多;生活:蚊虫叮咬后涂抹肥皂水
四、溶液酸碱度的表示法—pH
定义:溶液的酸碱度(溶液酸碱性强弱)常用pH表示,pH的范围通常在______之间
方法:(放滴比)_________________________________________________ ______________________________________________________
pH试纸_____(填“能”或“不能”,下同)浸入待测液pH试纸_____用水润湿,否则测酸pH变___,测碱pH变___pH取整数
在玻璃片上放一小片pH试纸,用玻璃棒蘸取少量待测液
滴到pH试纸上,将试纸显示颜色与标准比色卡对照,读出pH
pH与溶液酸碱性的关系
pH
相关课件
这是一份2024贵州中考一轮复习 人教版化学 教材基础复习 主题二 第五讲 课时5 常见的酸和碱 课件,共38页。PPT课件主要包含了考情分析·导航,核心脑图·整合,知识清单·必备,HCl,H2SO4,有刺激性,挥发性,吸水性,氢离子,不变色等内容,欢迎下载使用。
这是一份中考化学复习主题六常见的酸和碱教学课件,共57页。PPT课件主要包含了刺激性,挥发性,吸水性,HCl,干燥剂,纸上显出黑色字迹,蘸有浓硫酸的部位变黑,腐蚀或脱水,盐+氢气,没有明显现象等内容,欢迎下载使用。
这是一份中考化学复习主题六常见的酸和碱练习课件,共34页。PPT课件主要包含了溶液由无色变为红色,CaCl2,稀HCl合理,有气泡产生,产生气泡,溶液变红色等内容,欢迎下载使用。








