



- 暑假作业05 化学与可持续发展-【暑假专题复习】2024年高一化学暑假培优练(人教版2019必修第二册) 试卷 0 次下载
- 暑假作业06 常见气体的制备-【暑假专题复习】2024年高一化学暑假培优练(人教版2019必修第二册) 试卷 0 次下载
- 暑假作业08 同分异构体、反应类型等有机常考问题-【暑假专题复习】2024年高一化学暑假培优练(人教版2019必修第二册) 试卷 0 次下载
- 暑假作业09 原电池原理及其应用 化学电源-【暑假专题复习】2024年高一化学暑假培优练(人教版2019必修第二册) 试卷 0 次下载
- 暑假作业10 化学反应速率和限度图像与计算题-【暑假专题复习】2024年高一化学暑假培优练(人教版2019必修第二册) 试卷 0 次下载
暑假作业07 无机综合题、工艺流程题-【暑假专题复习】2024年高一化学暑假培优练(人教版2019必修第二册)
展开1.A、B、C、D四种物质的相互转化关系如图(部分反应条件及产物略去)。
(1)若A是黄色固体单质,则B为 ,D的浓溶液与铜反应的化学方程式是 。
(2)若A是空气中的主要成分,C是红棕色气体,则A的化学式为 ,D的浓溶液需保存在棕色试剂瓶中,并放置在阴凉处,原因是 (用化学方程式表示)。
2.物质的类别和核心元素的化合价是研究物质性质的两个重要角度。下图所示是硫及其部分化合物的“价类二维图”,根据图示回答下列问题:
(1)足量B通入品红溶液的现象是_______;体现了B的_______性。足量B通入溴水中的现象是_______;体现了B的_______性。
(2)从物质的性质分析,B不可用_______进行干燥(填标号)。
A.浓硫酸 B.碱石灰 C.P2O5固体
(3)硫代硫酸钠(Na2S2O3)俗称海波。从类别的角度分析,其属于_______(填标号)。
A.盐B.碱C.酸D.氧化物
(4)欲制备Na2S2O3,从氧化还原角度分析,下列选项中合理的是_______(填序号)。
A.Na2S+SB.Na2SO3+S
C.Na2SO3+Na2SO4D.SO2+Na2SO4
(5)D的浓溶液与铜单质在加热条件下可以发生化学反应,反应的化学方程式为_______。
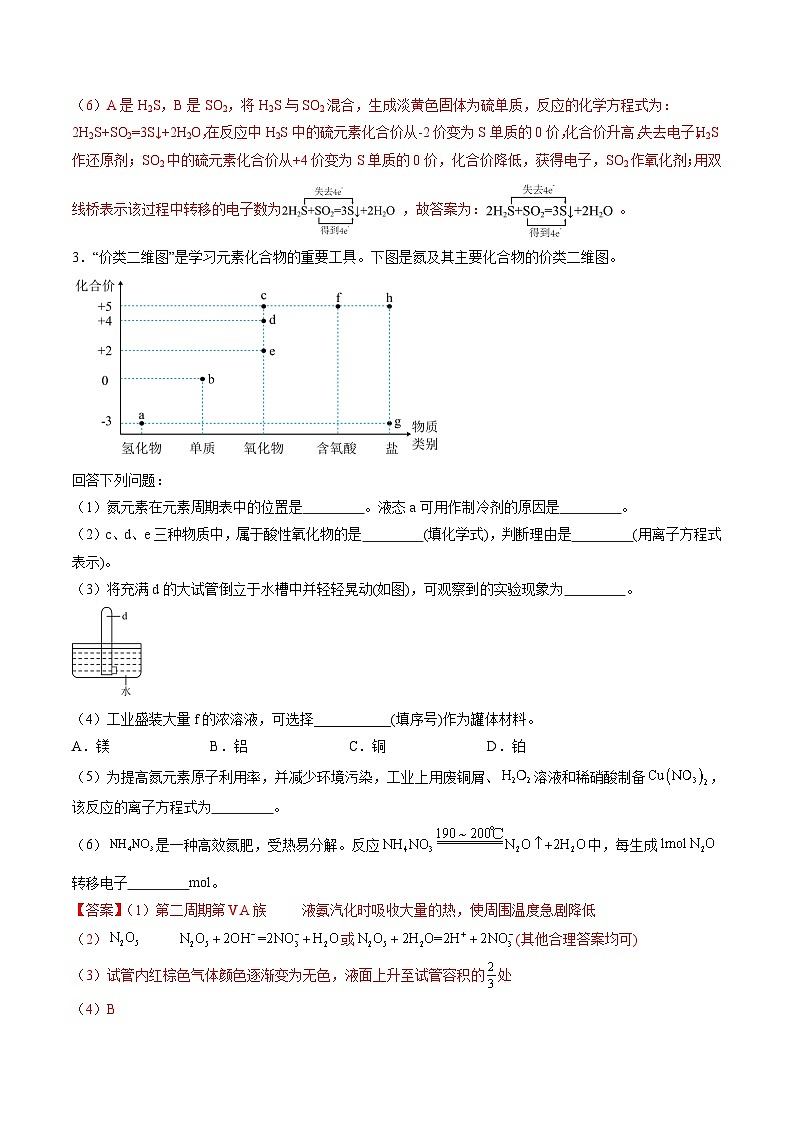
(6)将A的溶液与B混合,可生成淡黄色固体。用双线桥表示该过程中转移的电子数_______。
3.“价类二维图”是学习元素化合物的重要工具。下图是氮及其主要化合物的价类二维图。
回答下列问题:
(1)氮元素在元素周期表中的位置是 。液态a可用作制冷剂的原因是 。
(2)c、d、e三种物质中,属于酸性氧化物的是 (填化学式),判断理由是 (用离子方程式表示)。
(3)将充满d的大试管倒立于水槽中并轻轻晃动(如图),可观察到的实验现象为 。
(4)工业盛装大量f的浓溶液,可选择___________(填序号)作为罐体材料。
A.镁B.铝C.铜D.铂
(5)为提高氮元素原子利用率,并减少环境污染,工业上用废铜屑、溶液和稀硝酸制备,该反应的离子方程式为 。
(6)是一种高效氮肥,受热易分解。反应中,每生成转移电子 ml。
4.Ⅰ.已知下列物质均由短周期元素组成,X无论是盐酸还是氢氧化钠,转化均能进行,又已知C的相对分子质量比D少16,A、B、C、D、E中均含有同一元素。
(1)当X是盐酸时则A中的阴离子的电子式 。
(2)当X是氢氧化钠溶液时,C的化学式 。
(3)写出A和足量氢氧化钠在加热条件下反应的化学方程式 。
Ⅱ.金属及其化合物用途广泛,研究金属的提取、冶炼意义重大。
(4)下列各组金属,冶炼方法一定不同的是 (填字母)。
a.Hg、Ag b.Na、Mg c.Al、Fe d.Na、Ca
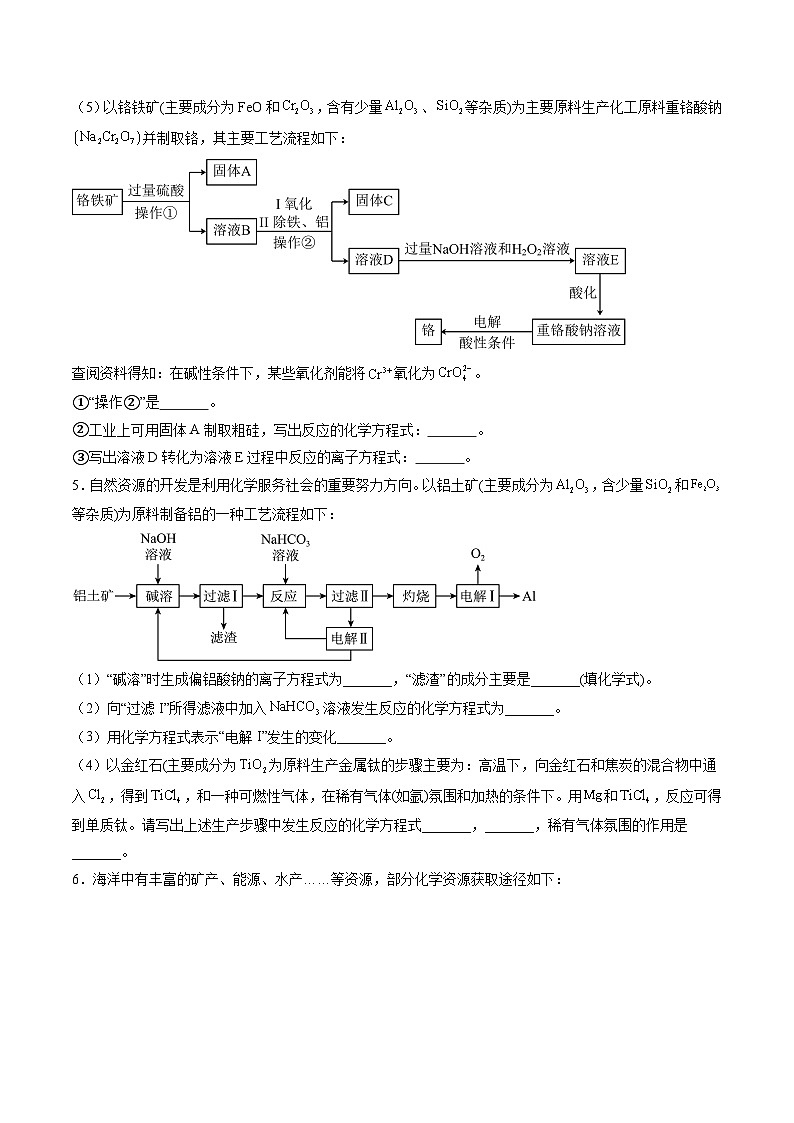
(5)以铬铁矿(主要成分为FeO和,含有少量、等杂质)为主要原料生产化工原料重铬酸钠并制取铬,其主要工艺流程如下:
查阅资料得知:在碱性条件下,某些氧化剂能将氧化为。
①“操作②”是 。
②工业上可用固体A制取粗硅,写出反应的化学方程式: 。
③写出溶液D转化为溶液E过程中反应的离子方程式: 。
5.自然资源的开发是利用化学服务社会的重要努力方向。以铝土矿(主要成分为,含少量和等杂质)为原料制备铝的一种工艺流程如下:
(1)“碱溶”时生成偏铝酸钠的离子方程式为_______,“滤渣”的成分主要是_______(填化学式)。
(2)向“过滤I”所得滤液中加入溶液发生反应的化学方程式为_______。
(3)用化学方程式表示“电解I”发生的变化_______。
(4)以金红石(主要成分为为原料生产金属钛的步骤主要为:高温下,向金红石和焦炭的混合物中通入,得到,和一种可燃性气体,在稀有气体(如氩)氛围和加热的条件下。用和,反应可得到单质钛。请写出上述生产步骤中发生反应的化学方程式_______,_______,稀有气体氛围的作用是_______。
6.海洋中有丰富的矿产、能源、水产……等资源,部分化学资源获取途径如下:
请回答下列有关问题:
(1)下列有关实验室模拟步骤①的说法正确的是 。
a.溶解粗盐时,尽量使溶液稀些,以保证食盐完全溶解
b.滤去不溶性杂质后,将滤液移到坩埚内加热浓缩
c.当蒸发到剩有少量液体时停止加热,利用余热蒸干
d.制得的晶体转移到新过滤器中,需用大量水进行洗涤
(2)“氯碱工业“通过电解饱和食盐水可制得NaOH溶液、Cl2和另一种无色无味的单质气体,该气体的化学式为 。
(3)下列有关说法正确的是 (填字母序号)。
a.在第②、③、④步骤中,溴元素均被氧化
b.用澄清的石灰水可鉴别NaHCO3溶液和Na2CO3溶液
c.除去粗盐中Ca2+、、加入试剂的先后顺序为NaOH、BaCl2、Na2CO3
d.海水中还含有碘元素,将海水中的碘升华可直接制备单质碘
(4)海水获取氯化钠和金属镁的实验流程如图所示,请你根据题意回答下列问题。
(一)写出氯化镁在水中的电离方程式 。
(二)第①步的化学方程式 。
(三)第③步加入的化学试剂为 (填名称)。
7.工业以炼钢废渣(主要含还有等杂质)为原料制备脱硫剂活性,并用该脱硫剂处理沼气中的流程如下:
(1)为加快“酸浸”的反应速率可采取的措施有 (写出两条即可)。
(2)滤渣1的成分有 。
(3)写出“还原”时发生反应的离子的离子符号 。
(4)加热条件下滤渣2可与浓硫酸反应生成一种气体,请写出该气体的电子式 。
(5)写出“沉铁”时生成沉淀的离子方程式 。
(6)“脱硫Ⅰ、再生Ⅱ”的原理如图所示。
工业上要求再生过程中温度不能超过,原因是 。在整个过程中当有完全反应时理论上能处理标况下 L。
8.非金属单质A经如图所示的过程转化为含氧酸D,已知D为强酸,请回答下列问题:
(1)若A在常温下为气体单质,将装满气体C的试管倒扣在水槽中,溶液最终充满试管容积的,另外容积为无色气体。
①A的电子式是 。
②写出C→D的化学方程式: 。
③D的稀溶液在常温下可与铜反应并生成B气体,请写出该反应的离子方程式: 。
(2)若A在常温下为非金属气态氢化物,且能使湿润的红色石蕊试纸变蓝,B遇到空气变成红棕色。
①写出实验室制取A气体的化学方程式: 。
②写出A→B的化学方程式: 。
(3)若A为淡黄色晶体,D为二元强酸。
①将C气体通入溶液产生的白色沉淀的化学式为 。
②将B通入溶液不会产生沉淀。若在通入另一种气体X就会产生沉淀,如产生的沉淀与①产生的沉淀相同,则气体X可能是: 。
A. B. C. D. E.
9.“价一类”二维图是学习元素化合物知识的好方法,依据图中氮元素及其化合物的转化关系,回答问题:
(1)如图中,X的化学式为 ,从N元素的化合价看,X具有 性(填“氧化”或“还原”)。
(2)回答下列关于NH3的问题:
①实验室常用NH4Cl与Ca(OH)2制取氨气,该反应的化学方程式为 。
②下列试剂不能用于干燥NH3的是 (填字母)。
A.浓硫酸 B.碱石灰 C.NaOH固体
③在下图收集装置中将收集NH3装置补充完整 。
④工业上以NH3、空气、水为原料生产硝酸分为三步,请写出第一步NH3→NO的化学方程式 。
(3)依据X的物质类别推断,X 转化为HNO3的化学反应方程式为 。
(4)若要将NH3→N2,从原理上看,下列试剂可行的是 (填选项字母)。
a. HCl b. Na c. H2O d. Cl2
10.从海水中不仅可获得淡水,而且可按如图工艺流程提取溴和镁。
回答下列问题;
(1)海水淡化的方法有 、电渗析法和反渗透法。
(2)步骤(1)中的X是一种黄绿色气体,X为 (填化学式)。步骤(1)主要发生反应的离子方程式为 。
(3)检验某NaCl溶液中是否混有SO的方法是 。
(4)溴单质与热的纯碱溶液反应有气体生成,该反应的氧化产物为 (填化学式)。
(5)步骤(3)发生反应的离子方程式为 。
(6)得到的Mg(OH)2中混有少量的Ca(OH)2,除去少量Ca(OH)2的方法是先将沉淀加入 (填化学式)溶液中,充分搅拌后经过滤、洗涤可得 Mg(OH)2。
(7)写出冶炼金属镁的化学方程式: 。
11.、NO和等氮氧化物是空气污染物,含有氮氧化物的尾气需处理后才能排放。
(1)的处理。是硝酸生产中氨催化氧化的副产物,用特种催化剂能使分解。与在加热和催化剂作用下生成的化学方程式为 。
(2)NO和的处理。已除去的硝酸尾气可用NaOH溶液吸收,主要反应如下:、
①下列措施能提高尾气中NO和去除率的有 (填字母)。
A.加快通入尾气的速率
B.采用气、液逆流的方式吸收尾气
C.吸收尾气过程中定期补加适量NaOH溶液
②吸收后的溶液经浓缩、结晶、 (填操作名称),得到NaNO2晶体,该晶体中的主要杂质是 (填化学式);吸收后排放的尾气中含量较高的氮氧化物是 (填化学式)。
(3)NO的氧化吸收。用NaClO溶液吸收硝酸尾气,可提高尾气中NO的去除率。其他条件相同,NO转化为的转化率随NaClO溶液初始pH(用稀盐酸调节)的变化如图所示。
①在酸性NaClO溶液中,会与结合形成HClO。HClO氧化NO生成和,其离子方程式为 。
②图中曲线所体现的反应规律是 。
12.过量排放含高浓度和的氨氮废水,对环境造成很大影响,工业脱氮方法主要有吹脱法、氧化法等,某氮肥厂处理氨氮废水的方案如图所示。
回答下列问题:
(1)氨氮废水排放最直接的影响是加速水体富营养化,可造成 (填写一个环境问题)。
(2)“调节池”加入“溶液”的目的是 。
(3)“氧化池”中与发生反应的离子方程式为 。
(4)“排放池”中用活性炭去除水中残余的氯,这是利用活性炭的 性。
(5)“硝化池”是在微生物硝化菌(亚硝酸菌和硝酸菌)作用下实现的转化,根据下图判断使用亚硝酸菌的最佳条件为 。
(6)“反硝化池”是在一定条件下向废水中加入有机物甲醇(),与共同作用转化为、而排放,理论上反应生成的与的物质的量之比为 。
13.绿矾()是治疗缺铁性贫血药品的重要成分。现利用如下工艺流程,从主要含Fe、Cu、Al及其氧化物的废旧金属材料回收部分金属,同时制得绿矾。
完成下列问题。
(1)碱浸时发生反应的物质有 (填化学式)。
(2)操作Ⅰ、Ⅱ、Ⅲ的名称是 ,用到的玻璃仪器有 。
(3)酸浸1和酸浸2用到的酸是 (填名称,下同),向酸浸1后的溶液中加入过量的试剂a是 。
(4)由滤液Ⅱ制得绿矾需要经过一系列操作,主要包括 、 、过滤、洗涤、干燥。
(5)向滤液Ⅰ中通入过量的会产生白色沉淀,该反应的化学方程式为 。
(6)已知易被氧化,则与酸性溶液反应的离子方程式为 。
14.M为三种短周期元素组成的化合物,某实验小组按如下流程进行相关实验:
15.8gM与0.1mlH2SO4恰好完全反应,且溶液A中只有一种溶质。气体A是无色有刺激性气味的气体,其体积已折算为标准状况。请回答:
(1)M的组成元素为 ,其化学式为
(2)请写出M与稀硫酸反应的化学方程式
(3)将气体A通入到足量的澄清石灰水中,请写出相应的离子方程式 。
15.以黄铁矿(主要成分)为原料生产硫酸,应将产出的炉渣和尾气进行资源化综合利用,减轻对环境的污染。由尾气可以生产焦亚硫酸钠(,),常用作饼干和蛋糕的漂白剂和膨化剂,在空气中易被氧化,受热易分解。其中一种流程如下图所示。
回答下列问题:
(1)中硫元素的化合价为 。
(2)由炉渣制备还原铁粉的化学方程式为 。
(3)生产,通常是由过饱和溶液经结晶脱水制得。写出该过程的化学方程式 。
(4)①实验制得的固体中含有少量杂质,文字叙述其可能的原因是 。
②葡萄酒酿造过程中要添加作抗氧化剂,此物质会放出一种有刺激性气味的气体,该气体是一种食品添加剂。实验室中检验该气体的方法是 。
(5)纯度测定:取样品溶于水配成溶液,取该溶液,向其中滴加的碘溶液,最终滴加碘溶液将溶液中恰好完全反应。此过程反应的离子方程式为 ;样品中的质量分数为 (已知其它杂质不反应)。
暑假作业03 化学反应的速率和限度-【暑假专题复习】2024年高一化学暑假培优练(人教版2019必修第二册): 这是一份暑假作业03 化学反应的速率和限度-【暑假专题复习】2024年高一化学暑假培优练(人教版2019必修第二册),文件包含暑假作业03化学反应的速率和限度原卷版docx、暑假作业03化学反应的速率和限度解析版docx等2份试卷配套教学资源,其中试卷共28页, 欢迎下载使用。
暑假作业02 化学反应与热能、电能-【暑假专题复习】2024年高一化学暑假培优练(人教版2019必修第二册): 这是一份暑假作业02 化学反应与热能、电能-【暑假专题复习】2024年高一化学暑假培优练(人教版2019必修第二册),文件包含暑假作业02化学反应与热能电能原卷版docx、暑假作业02化学反应与热能电能解析版docx等2份试卷配套教学资源,其中试卷共28页, 欢迎下载使用。
暑假作业01 硫、氮、硅及其化合物的性质与转化-【暑假专题复习】2024年高一化学暑假培优练(人教版2019必修第二册): 这是一份暑假作业01 硫、氮、硅及其化合物的性质与转化-【暑假专题复习】2024年高一化学暑假培优练(人教版2019必修第二册),文件包含暑假作业01硫氮硅及其化合物的性质与转化原卷版docx、暑假作业01硫氮硅及其化合物的性质与转化解析版docx等2份试卷配套教学资源,其中试卷共29页, 欢迎下载使用。












