

衔接点03 物质的转化(原卷版+解析版)2024年初升高化学无忧衔接(通用版)
展开回顾一、单质的化学性质
1. 金属单质的化学性质:
A、金属与氧气的反应
B、金属与盐酸、稀硫酸的反应
C、金属与盐溶液的反应
(1) 铁丝浸入硫酸铜溶液中
Fe +CuSO4 == Cu + FeSO4
应用及说明:
“湿法冶铜”的原理
不能用铁制品放硫酸铜溶液(或农药波尔多液)
现象:铁钉表面有红色物质出现,溶液由蓝色变为浅绿色。
(2)铝丝浸入硫酸铜溶液中
2Al + 3CuSO4 == Al2(SO4)3 + 3Cu
现象:铝丝表面有红色物质出现,溶液由蓝色变为无色。
(3)铜丝浸入硝酸银溶液中
Cu + 2AgNO3 == Cu(NO3)2 + 2Ag
现象:铜丝表面有银白色物质出现,溶液由无色变为蓝色。
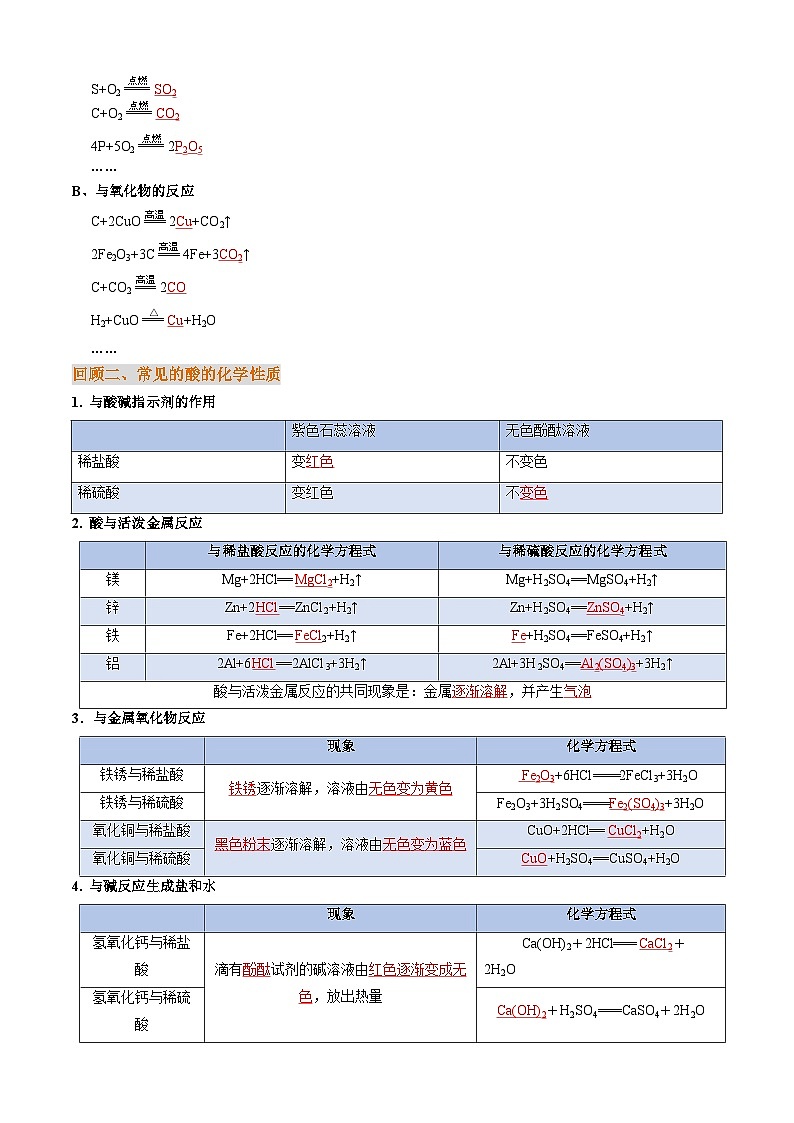
2. 非金属单质的化学性质:
A、与氧气反应
S+O2eq \\ac(\s\up7(点燃),\(===,====))SO2
C+O2eq \\ac(\s\up7(点燃),\(===,====))CO2
4P+5O2eq \\ac(\s\up7(点燃),\(===,====))2P2O5
……
B、与氧化物的反应
C+2CuOeq \\ac(\s\up7(高温),\(===,====))2Cu+CO2↑
2Fe2O3+3Ceq \\ac(\s\up7(高温),\(===,====))4Fe+3CO2↑
C+CO2eq \\ac(\s\up7(高温),\(===,====))2CO
H2+CuOeq \\ac(\s\up7(△),\(===,====))Cu+H2O
……
回顾二、常见的酸的化学性质
1. 与酸碱指示剂的作用
2. 酸与活泼金属反应
3.与金属氧化物反应
4. 与碱反应生成盐和水
5. 与某些盐反应生成新盐和新酸
回顾三、常见的碱化学性质
1.与酸碱指示剂反应
【点拨】
难溶于水的碱不能使酸碱指示剂变色,如氢氧化铜、氢氧化铁、氢氧化镁等。
2.与部分非金属氧化物反应
(1)与二氧化碳的反应
①氢氧化钠:2NaOH+CO2=Na2CO3+H2O
②氢氧化钙:Ca(OH)2+CO2=CaCO3↓+H2O
(2)与二氧化硫的反应
①氢氧化钠:2NaOH+SO2=Na2SO3+H2O
②氢氧化钙:Ca(OH)2+SO2=CaSO3↓+H2O
(3)与三氧化硫的反应
①氢氧化钠:NaOH+SO3=Na2SO4+H2O
②氢氧化钙:Ca(OH)2+SO3=CaSO4↓+H2O
3.与酸反应
①氢氧化钠
NaOH+HCl=NaCl+H2O
2NaOH+H2SO4=Na2SO4+H2O
②氢氧化钙
Ca(OH)2+2HCl=CaCl2+2H2O
Ca(OH)2+H2SO4=CaSO4+2H2O
4.与部分盐反应
①氢氧化钠:2NaOH+CuSO4=Cu(OH)2↓+Na2SO4
②氢氧化钙:Na2CO3+Ca(OH)2=CaCO3↓+2NaOH
回顾四、盐的化学性质
1. 盐跟某些金属的反应:
规律:盐+金属=新盐+新金属
反应条件:
在金属活动性顺序表中,除非常活泼的K、Ca和Na外,排在前面的金属一般可以将位于其后面的、比它不活泼的金属从它们的盐溶液中置换出来。
Zn+CuSO4=ZnSO4+Cu;
Cu+HgNO3)2=Hg+Cu(NO3)2;
ZnSO4+Cu不反应
2.盐跟酸的反应:
规律:盐+酸=新盐+新酸
BaCl2+H2SO4=BaSO4+2HCl
AgNO3+HCl=AgCl+HNO3
Na2CO3+2HCl=2NaCl+H2O+CO2↑
3.盐跟碱的反应:
规律:盐+碱=新盐+新碱
Na2CO3+Ca(OH)2=CaCO3↓+2NaOH
FeCl3+3NaOH=Fe(OH)3↓+3NaCl
4.盐跟另一种盐的反应:
规律:盐+盐=新盐+新盐
Na2CO3+CaCl2=CaCO3↓+2NaCl
AgNO3+NaCl=AgCl+NaNO3
BaCl2+Na2SO4=BaSO4+2NaCl
新知一、物质的转化
1.基本依据:
化学变化过程中,元素是不会改变的。即化学反应中的质量守恒。
2.应用:
确定制取某类物质的可能方法。
3.实例:
(1)以钙为例,用化学方程式表示钙及其化合物之间的转化关系并指明反应类型。
①2Ca+O2===2CaO,化合反应;
②CaO+H2O===Ca(OH)2,化合反应;
③CaO+CO2===CaCO3,化合反应;
④Ca(OH)2+Na2CO3===CaCO3↓+2NaOH,复分解反应;
⑤Ca(OH)2+2HCl===CaCl2+2H2O,复分解反应;
⑥CaCO3+2HCl===CaCl2+CO2↑+H2O,复分解反应。
(2)碳及其化合物间的转化关系如下图所示:
写出图中序号所示转化所需反应物的化学式:
①O2 ②H2O ③Ca(OH)2 ④CaO ⑤Ca(OH)2(答案合理即可)。
(3)单质到盐的一般转化关系:
部分金属单质eq \(――→,\s\up7(O2))碱性氧化物eq \(――→,\s\up7(H2O))碱eq \(――――――→,\s\up7(酸或酸性氧化物))盐
如:Naeq \(――→,\s\up7(O2))Na2Oeq \(――→,\s\up7(H2O))NaOHeq \(――→,\s\up7(H2SO4))Na2SO4
符合上述转化关系的常见金属有Na、K、Ca、Ba等,但Mg、Fe、Al、Cu等不符合上述转化关系。
部分非金属单质eq \(――→,\s\up7(O2))酸性氧化物eq \(――→,\s\up7(H2O))酸eq \(――――――→,\s\up7(碱或碱性氧化物))盐
如:Seq \(――→,\s\up7(O2))SO2eq \(――→,\s\up7(H2O))H2SO3eq \(――→,\s\up7(NaOH))Na2SO3
符合上述转化关系的常见非金属有C、S、P等,但N、Si等不符合上述转化关系。
4.工业生产中的其他因素:
①最适当方法的选择
②实例——工业上制取NaOH
a.一般不采用Na2O与H2O反应的原因:Na2O作为原料,来源少、成本高;
b.主要采用方法:电解饱和食盐水;
c.过去曾采用方法:盐(如Na2CO3)与碱[如Ca(OH)2]反应。
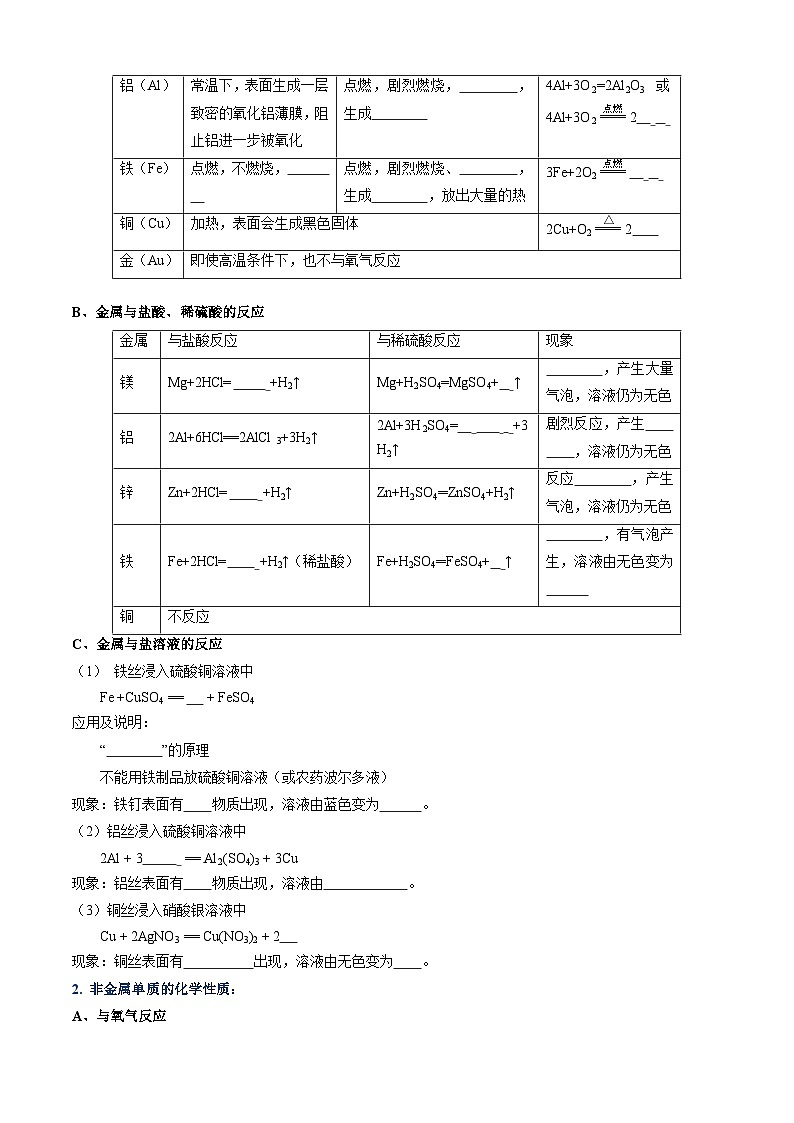
新知二、单质、氧化物、酸、碱、盐之间的转化关系
在上图中所涉及的反应规律可简记为:
两条纵线通到底(七条规律)(1)~(7)
四条横线相联系(四条规律)(8)~(11)
六条交叉成网络(六条规律)(12)~(17)
十七规律须牢记
纵向:
(1)金属+O2eq \\ac(\s\up5(点燃/△),\s\d0(—————→))金属氧化物(碱性氧化物)
4Na+ O2=2Na2O 2Cu+ O2=2CuO
(2)碱性氧化物(可溶)+水→碱(可溶)
Na2O+H2O=2NaOH
(3)碱(难溶)eq \\ac(\s\up5(高温/△),\s\d0(—————→))碱性氧化物(难溶) + 水
Cu(OH)2eq \(===,\s\up7(△))CuO+H2O
(4)酸+碱→盐+水
3NaOH+H3PO4=Na3PO4+3H2O
Cu(OH)2+H2SO4=CuSO4+2H2O
(5)非金属+ O2eq \\ac(\s\up5(点燃),\s\d0(—————→))非金属氧化物(酸性氧化物)
C+O2 eq \(\s\up8(点燃),eq \(\s\up2 (——),——,\s\d0()),\s\d4())CO2
S+O2 eq \(\s\up8(点燃),eq \(\s\up2 (——),——,\s\d0()),\s\d4())SO2
4P+5O2 eq \(\s\up8(点燃),eq \(\s\up2 (——),——,\s\d0()),\s\d4())2P2O5
(6)酸性氧化物(易溶)+水→酸(易溶)
CO2 +H2O=H2CO3
P2O5+3H2O=2H3PO4
(7)酸(易挥发 / 难溶)→酸酐+水(易挥发 / 难溶)
H2CO3 = CO2↑+H2O
H2SiO3eq \(===,\s\up7(△)) H2O+SiO2
从纵向来看,金属→碱性氧化物→盐,其中金属元素相同。
非金属→酸性氧化物→酸(含氧酸)→盐,其中非金属元素相同。
横向:
(8)金属+非金属→(无氧酸)盐
2Na+Cl2 eq \(\s\up8(点燃),eq \(\s\up2 (——),——,\s\d0()),\s\d4())2NaCl
(9)碱性氧化物+酸性氧化物→(含氧酸)盐
Na2O+CO2=Na2CO3
(10)含氧酸盐→碱性氧化物+酸性氧化物
CaCO3eq \(===,\s\up7(△))CaO+ CO2↑
(11)盐+盐→两种新盐
NaCl+AgNO3=NaNO3+AgCl↓
交叉:
(12)酸+碱性氧化物→盐+水
H2SO4+CuO=CuSO4+H2O
(13)碱+酸性氧化物→盐+水
2NaOH+CO2=Na2CO3+H2O
(14)酸+盐→新酸+新盐
Na2CO3+ H2SO4= Na2SO4 +H2CO3
H2CO3 = CO2↑+H2O
(15)碱+盐新碱+新盐
2NaOH+ CuSO4= Na2SO4+Cu(OH)2↓
(16)金属+酸→盐+H2↑
Zn+H2SO4=ZnSO4+H2↑
(17)金属+盐新盐+新金属
Zn+H2SO4=ZnSO4+H2↑
Zn+CuSO4=ZnSO4+Cu
以上十七条规律的应用:
(1)可预知某物质的性质。
(2)可知某物质的制法。如:(4)、(8)、(9)、(11)~(17)为盐的十种制法。
(3)已知各类物质间的相互关系。
说明:
<1> 以上各规律为各物质间相互转化的一般规律,具体到某些物质有些规律要具体分析,未必均适用。
例如:制取ZnCl2的方法与制取CuSO4的方法各有几种?(思考)
<2> 此外,在物质的制取中还有一些常见的规律,如:
对于盐+酸→新盐+新酸,有如下规律:
强酸→弱酸
如:CaCO3+2HCl=CaCl2+H2O+CO2↑
稳定的(不易分解的)酸不稳定的(另分解的)酸。
CaCO3+2HCl=CaCl2+H2O+CO2↑
高沸点(不易挥发的)酸低沸点(易挥发的)酸。
如:H2SO4(浓)+2NaCleq \(===,\s\up7(△)) Na2SO4+2HCl↑
可溶性酸→难溶性酸。
如:Na2SiO3+2HCl=H2SiO3↓+2NaCl
<3> 从反应规律与反应类型的关系来看。
属于化合反应的有:规律(1)、(2)、(5)、(6)、(8)、(9)。
属于分解反应的有:规律(3)、(7)、(10)。
属于置换反应的有:规律(16)、(17)。
属于复分解反应的有:规律(4)、(11)、(12)、(14)、(15)。
规律(13)不属于任何一种基本反应类型。
初中阶段不属于任何一种基本反应类型的反应包括:
CH4+2O2 eq \(\s\up8(点燃),eq \(\s\up2 (——),——,\s\d0()),\s\d4())CO2+2H2O
C2H5OH+3O2 eq \(\s\up8(点燃),eq \(\s\up2 (——),——,\s\d0()),\s\d4())2CO2+3H2O
CO+CuO eq \(\s\up8(△),eq \(\s\up2 (——),——,\s\d0()),\s\d4())Cu+CO2
新知三、化学反应的类型
1.(河北省张家口市2023学年高一上学期期末)下列物质间的转化,不能通过化合反应直接制得的是
A.NaHCO3B.NaOHC.Fe(OH)2D.FeCl2
【答案】C
【解析】A.Na2CO3+CO2+H2O===2NaHCO3,A项正确;
B.Na2O+H2O===2NaOH,B项正确;
C.Fe(OH)2不能通过化合反应制得,C项错误;
D.2FeCl3+Fe===3FeCl2,D项正确。
故选C。
2.(重庆市2023学年高一上学期期末)以下物质间的转化,在一定条件下均能一步实现,且均为氧化还原反应的是
A.Cu→CuO→CuSO4B.CaO→Ca(OH)2→CaCO3
C.Cl2→HClO→HClD.Na2CO3→CaCl→NaNO3
【答案】C
【解析】A.CuO→CuSO4没有化合价变化,非氧化还原反应,选项A错误;
B.CaO→Ca(OH)2→CaCO3均没有变价,非氧化还原反应,选项B错误;
C.Cl2→HClO→HCl氯元素均发生变价,属于氧化还原反应,且一步均能实现(Cl2→HClO:与水反应;HClO→HCl:加还原剂,如SO2),选项C正确;
D.Na2CO3→CaCl→NaNO3:均没有变价,非氧化还原反应,选项D错误;
答案选C。
3.(甘肃省酒泉市2023学年高一上学期期末)在给定的条件下,下列选项所示的物质间转化均能实现的是
A.HClOeq \\ac(\s\up5(光),\s\d0(———→))Cl2eq \\ac(\s\up5(NaOH),\s\d0(———→))NaClO
B.Feeq \\ac(\s\up5(O2),\s\d0(——→),\s\d5(点燃))Fe2O3eq \\ac(\s\up5(HCl(aq)),\s\d0(———→))FeCl3
C.Naeq \\ac(\s\up5(O2),\s\d0(——→),\s\d5(点燃))Na2Oeq \\ac(\s\up5(水),\s\d0(———→))NaOH
D.NaHCO3eq \\ac(\s\up5(△),\s\d0(———→))Na2CO3eq \\ac(\s\up5(Ca(OH)2),\s\d0(———→)) NaOH(aq)
【答案】D
【解析】A.次氯酸见光发生分解反应生成HCl和O2,A不符合题意;
B.Fe在O2与燃烧生成的是Fe3O4,B不符合题意;
C.Na在点燃条件下生成Na2O2,C不符合题意;
D.NaHCO3(s)受热分解得到Na2CO3(s),Na2CO3(s)与Ca(OH)2(aq)发生复分解反应生成NaOH(aq),D符合题意;
故选D。
4.(山东省聊城市2023学年高一上学期期末)下列选项所表示的物质间转化关系不能一步完成的是
A.CaO→Ca(OH)2→CaCl2→CaCO3
B.Na→Na2O2→NaOH→Na2CO3
C.Cl2→NaClO→Na2CO3→NaOH
D.Fe→Fe2O3→Fe(OH)3→FeCl3
【答案】D
【解析】A.CaO与H2O反应产生Ca(OH)2,Ca(OH)2与HCl反应产生CaCl2,CaCl2与Na2CO3反应产生CaCO3沉淀,因此可以一步实现上述物质之间的转化关系,A不符合题意;
B.Na与O2点燃反应产生Na2O2,Na2O2与H2O反应产生NaOH和O2,NaOH与少量CO2气体反应产生Na2CO3,因此可以一步实现上述物质之间的转化关系,B不符合题意;
C.Cl2与NaOH溶液反应产生NaClO,向NaClO溶液中通入少量CO2气体反应产生Na2CO3,Na2CO3与Na2CO3反应产生NaOH和CaCO3沉淀,因此可以一步实现上述物质之间的转化关系,C不符合题意;
D.Fe与O2加热反应产生Fe2O3,但Fe2O3不溶于水,不能与水直接反应产生Fe(OH)3,因此不能一步实现上述物质之间的转化关系,D符合题意;
故合理选项是D。
5.(安徽省淮北市实验高级中学2023学年高一上学期期末)给定条件下,下列选项中所示的物质间转化均能一步实现的是
A.Feeq \\ac(\s\up5(Cl2),\s\d0(——→),\s\d5(△))FeCl2eq \\ac(\s\up5(NaOH),\s\d0(———→))Fe(OH)2
B.Feeq \\ac(\s\up5(稀HCl),\s\d0(———→))H2eq \\ac(\s\up5(Cl2),\s\d0(——→),\s\d5(点燃))HCl
C.Naeq \\ac(\s\up5(空气),\s\d0(——→),\s\d5(常温))Na2O2eq \\ac(\s\up5(CO2),\s\d0(———→))Na2CO3
D.Feeq \\ac(\s\up5(水),\s\d0(——→),\s\d5(高温))Fe3O4eq \\ac(\s\up5(),\s\d0(——→),\s\d5(△))O2
【答案】B
【解析】A.铁与氯气反应生成FeCl3,不能直接反应生成FeCl2,故A错误;
B.Fe+2HCl=FeCl2+H2↑、H2+Cl2eq \\ac(\s\up7(点燃),\(===,====))2HCl故上述流程可实现,,故B正确;
C.金属钠与氧气常温下反应生成Na2O,不能生成Na2O2,故C错误;
D.四氧化三铁高温煅烧条件下会分解,加热条件下不反应,,故D错误;
故答案为B。
6.(山东省聊城市2023学年高一上学期期末)向Na2CO3溶液中依次加入甲、乙、丙三种溶液,进行如下实验:
Na2CO3溶液eq \\ac(\s\up5(甲),\s\d0(———→))白色沉淀eq \\ac(\s\up5(过量乙),\s\d0(———→))沉淀溶解并放出气体eq \\ac(\s\up5(丙),\s\d0(———→))产生白色沉淀
则甲、乙、丙中的溶质可能是
A.CaCl2、HNO3、AgNO3B.BaCl2、H2SO4、MgCl2
C.CaCl2、HNO3、NaClD.Ba(NO3)2、HCl、Na2SO4
【答案】AD
【解析】A.碳酸钠溶液中加入CaCl2生成碳酸钙沉淀和氯化钠,碳酸钙和硝酸反应生成硝酸钙、二氧化碳、水,氯化钠和AgNO3反应生成硝酸银沉淀,故选A;
B.碳酸钠溶液中加入BaCl2生成碳酸钡沉淀和氯化钠,碳酸钡和硫酸反应生成硫酸钡沉淀、二氧化碳、水,沉淀不溶解,故不选B;
C.碳酸钠溶液中加入CaCl2生成碳酸钙沉淀和氯化钠,碳酸钙和硝酸反应生成硝酸钙、二氧化碳、水,再加NaCl不能生成沉淀,故不选C;
D.碳酸钠溶液中加入BaCl2生成碳酸钡沉淀和氯化钠,碳酸钡和盐酸反应生成氯化钡、二氧化碳、水,沉淀溶解,再加Na2SO4生成硫酸钡沉淀,故选D;
选AD。
1.(2023春·江西·高一校联考期中)化学是研究物质及其变化的科学。通常条件下,下列各组物质按右图所示转化关系每一步都能一步实现的是
【答案】D
【解析】A.氯化铁与铁反应生成氯化亚铁,氯化亚铁不能一步反应生成氧化铁,氧化铁也不能一步反应生成氢氧化铁,选项A不符合;
B.硅与氢氧化钠溶液反应生成硅酸钠,硅酸钠不能一步反应生成二氧化硅,选项B不符合;
C.NO不能一步反应生成硝酸,浓硝酸与铜反应生成二氧化氮,二氧化氮不能一步反应生成氨气,选项C不符合;
D.铜与氧气反应生成氧化铜,氧化铜与硫酸反应生成硫酸铜,硫酸铜与氯化钡反应生成氯化铜,氯化铜与铁反应生成铜,铜与浓硫酸反应生成硫酸铜,硫酸铜与铁反应生成铜,转化关系每一步都能一步实现,选项D符合;答案选D。
2.(2023春·天津·高一统考期中)不能实现下列物质间直接转化的氢化物是
氢化物氧化物氧化物酸
A.H2SB.CH4C.HFD.NH3
【答案】C
【解析】A.H2S发生完全燃烧生成二氧化硫,二氧化硫和氧气继续反应生成三氧化硫,三氧化硫溶于水生成硫酸,故A不选;
B.CH4发生不完全燃烧生成一氧化碳,一氧化碳和氧气继续反应生成二氧化碳,二氧化碳和水反应生成碳酸,故B不选;
C.HF不能与氧气反应,故C选;
D.NH3发生催化氧化生成一氧化氮,一氧化氮与氧气生成二氧化氮,二氧化氮与水反应生成硝酸,故D不选;答案选C。
3.(2023春·江苏淮安·高一校联考期中)在指定条件下,下列选项所示的物质间转化能实现的是
A.NO(g)HNO3(aq)B.稀硝酸NO2
C.NO2(g)HNO3(aq)D. (aq) (aq)
【答案】C
【解析】A.NO不与H2O反应,选项A不符合题意;
B.稀HNO3与Cu反应生成NO,3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O,选项B不符合题意;
C. 发生反应为3NO2+H2O= 2HNO3+NO,能实现转化,选项C符合题意;
D.NOeq \\al(-,3)中的N为最高价+5价,O3为氧化剂,因此不能生成NOeq \\al(-,2),选项D不符合题意;答案选C。
4.(2023年河南省郑州市中牟县期中)下列各组内物质的转化,只通过一步反应不能完成的是
A.Zn→H2B.CaO→CaCl2C.CO2→CaCO3D.Cu→Cu(OH)2
【答案】D
【解析】A项,锌和稀硫酸反应生成氢气,Zn+H2SO4=ZnSO4+H2↑,不符合题意;B项,氧化钙和盐酸反应生成氯化钙和水,CaO+2HCl=CaCl2+H2O,不符合题意;C项,二氧化碳和氢氧化钙反应生成碳酸钙,Ca(OH)2+CO2=CaCO3↓+H2O,不符合题意;D项,铜与水或与碱等反应,不能一步生成氢氧化铜,符合题意。
5.(2023年江苏省扬州中学期中)金刚石硬度高、耐磨性好,可广泛用于切割、磨削、钻探等工业中。一种人造金刚石的生产方法为:4Na+CCl4eq \(=====,\s\up6(700℃),\s\d5())C+4NaCl。该反应属于
A.化合反应B.复分解反应C.置换反应D.分解反应
【答案】C
【解析】根据反应方程式4Na+CCl4eq \(=====,\s\up6(700℃),\s\d5())C+4NaCl可知,这是一个单质与化合物反应生成新的单质和新的化合物的反应,符合置换反应的定义,所以属于置换反应,C项符合题意。
6.(2023年山西省长治市第一中学校高一期末)物质之间的相互转化,可以直接实现,也可以间接实现,下列转化可以一步实现的是
A.C―→CaCO3B.CuO―→Cu(OH)2
C.CuSO4―→CuD.CaCO3―→CO
【答案】C
【解析】A项,碳在氧气中燃烧生成二氧化碳,二氧化碳通入石灰水中生成碳酸钙,C不能直接反应产生CaCO3,不符合题意;B项,CuO难溶于水,与水也不发生反应,氧化铜不能直接反应产生Cu(OH)2,不符合题意;C项,Fe与CuSO4发生置换反应产生Cu和FeSO4,可以一步实现上述转化,符合题意;D项,CaCO3高温煅烧反应产生CaO和CO2,二氧化碳与碳高温下反应生成一氧化碳,碳酸钙不能直接反应转化为CO,不符合题意。
7.(2023河北省承德市双滦区实验中学期中)以下表示的是碳及其化合物的转化关系,其中涉及的基本反应类型依次是
Ceq \(\s\up 4(eq \(\s\up 2(CuO),\s\d 4(——→))),\s\d 5(高温))CO2eq \(\s\up 4(eq \(\s\up 3(H2O),\s\d 4(——→))),\s\d 4())H2CO3eq \(\s\up 4(eq \(\s\up 2(Ca(OH)2),\s\d 4(————→))),\s\d 6())CaCO3eq \(\s\up 4(eq \(\s\up 2(高温),\s\d 4(——→))),\s\d 6())CO2
A.化合、置换、分解、复分解B.置换、复分解、化合、分解
C.置换、化合、分解、复分解D.置换、化合、复分解、分解
【答案】D
【解析】该转化关系涉及的化学反应依次为:C+2CuOeq \(====,\s\up7(高温))2Cu+CO2↑、CO2+H2O=H2CO3、H2CO3+Ca(OH)2=CaCO3↓+2H2O、CaCO3eq \(====,\s\up7(高温))CaO+CO2↑,各反应的基本反应类型依次为:置换反应、化合反应、复分解反应、分解反应,答案为D项。
8.(2023北京西域期末)下列变化不能通过一步反应实现的是
A.Na2CO3→NaOHB.Cu→CuCl2
C.Fe→Fe3O4D.Fe2O3→Fe(OH)3
【答案】D
【解析】A项,Na2CO3+Ba(OH)2=BaCO3↓+2NaOH,正确;B项,Cu+Cl2eq \(====,\s\up7(点燃))CuCl2,正确;C项,3Fe+2O2eq \(====,\s\up7(点燃))Fe3O4,正确;D项,氧化铁不溶于水,不能一步转化为氢氧化铁,可以通过:Fe2O3+6HCl=2FeCl3+3H2O、FeCl3+3NaOH=FeCl3+Fe(OH)3↓,实现转化,错误。
9.(2023江西宜春高二上高二中校考阶段练习)下列各选项最后的物质是要制取的物质,其中不可能得到的是
A.溶液
B.溶液沉淀
C.
D.溶液HCl溶液
【答案】C
【解析】A项,碳酸钙高温生成氧化钙和二氧化碳,氧化钙能与水反应生成氢氧化钙,氢氧化钙能与碳酸钠反应生成氢氧化钠,正确;B项,铜在氧气中加热能生成氧化铜,CuO能与硫酸反应生成硫酸铜,硫酸铜能与氢氧化钠反应生成氢氧化铜沉淀,正确;C项,高锰酸钾加热会生成氧气,硫在氧气中点燃生成二氧化硫,二氧化硫与水反应生成亚硫酸,而不是硫酸,错误;D项,碳酸钡与盐酸反应生成氯化钡,氯化钡与硫酸会反应生成硫酸钡沉淀,正确。
10.(2023福建漳州正兴学校期中)实现下列物质的转化时,只有加入酸才能通过一步反应实现的是
A.Zn→ZnCl2B.CaCO3→Ca(NO3)2
C.NaOH→NaClD.BaCl2 →BaSO4
【答案】B
【解析】A项,Zn与盐酸、氯化亚铁均反应生成氯化锌,不加入酸也可实现转化,错误;B项,CaCO3与HNO3反应生成Ca(NO3)2,只有加入酸一步实现转化,正确;C项,NaOH与盐酸、CuCl2均反应生成NaCl,不加入酸也可实现转化,错误;D项,氯化钡与硫酸、硫酸钠等均反应生成硫酸钡,不加入酸也可实现转化,错误。
11.氢氧化钾是我国古代纺织业常用于漂洗的洗涤剂。古代制取氢氧化钾的流程如下:
上述流程中没有涉及的化学反应类型是( )
A.化合反应B.分解反应
C.置换反应D.复分解反应
【答案】C
【解析】该过程中发生的反应依次是
CaCO3CaO+CO2↑(分解反应);
CaO+H2O===Ca(OH)2(化合反应);
Ca(OH)2+K2CO3===CaCO3↓+2KOH(复分解反应)。
12.以下表示的是碳及其化合物的转化关系,其中涉及的基本反应类型依次是
Ceq \(――→,\s\up7(CuO),\s\d5(高温))CO2eq \(――→,\s\up7(H2O))H2CO3eq \(――→,\s\up7(Ca(OH)2))CaCO3eq \(――→,\s\up7(高温))CO2
A.化合、置换、分解、复分解
B.置换、复分解、化合、分解
C.置换、化合、分解、复分解
D.置换、化合、复分解、分解
【答案】选D
【解析】该转化关系中涉及的化学反应有C+2CuO2Cu+CO2↑,CO2+H2O===H2CO3,H2CO3+Ca(OH)2===CaCO3↓+2H2O,CaCO3CaO+CO2↑,反应类型分别为置换反应、化合反应、复分解反应、分解反应。
13.X、Y、Z、W各代表一种物质,若X+Y===Z+W,则X和Y之间不可能是
A.盐和盐的反应B.碱性氧化物和水的反应
C.酸和碱的反应D.酸性氧化物和碱的反应
【答案】B
【解析】碱性氧化物与水发生化合反应只能生成一种物质,选项B不可能。
14.酸式盐是盐中的一类,可看作是多元酸中的氢离子未被完全中和所得到的盐,常见的有NaHCO3、NaHSO4、KH2PO4等。已知H3PO2(次磷酸)与足量的NaOH反应只生成一种盐NaH2PO2,则下列说法正确的是
A.H3PO2属于二元酸
B.H3PO2属于三元酸
C.NaH2PO2属于酸式盐
D.NaH2PO2属于正盐
【答案】D
【解析】H3PO2与足量的NaOH反应只生成NaH2PO2,故H3PO2为一元酸,NaH2PO2属于正盐。
15.下列物质有给定条件下的转化均能一步实现的是
A.Fe2O3FeFeCl3
B.H2O2H2H2O
C.CaCl2溶液CaCO3CO2
D.CuSO4溶液CuCuO
【答案】D
【解析】
A. 铁与稀盐酸反应生成的是氯化亚铁,不是氯化铁,不能一步实现,A错误;
B. 过氧化氢分解生成的是氧气和水,不能生成氢气,B错误;
C. 由于盐酸的酸性大于碳酸,所以氯化钙溶液中通入二氧化碳,不能生成碳酸钙沉淀,C错误;
D. 铁比铜活泼,故铁可以与硫酸铜反应生成硫酸亚铁和铜,铜可以与氧气反应生成氧化铜,D正确;
答案选D。
16.构建知识网络是一种重要的学习方法.如图是关于硫酸化学性质的知识网络:“﹣”表 示相连的两种物质能发生反应,“→”表示一种物质能转化为另一种物质,A,B,C 分别属于不同类别的化合物,则 A,B,C 可能是
A.NaOH,CuSO4,Na2CO3B.KOH,HNO3,K2CO3
C.Ba(OH)2,CuSO4,CuO D.NaOH,HCl,Ba(NO3)2
【答案】B
【解析】
A.CuSO4和Na2CO3都属于盐,属于相同类别的化合物,故A不符合题意;
B.KOH和HNO3能反应,HNO3和K2CO3能反应,硫酸和KOH、K2CO3、Zn也能反应,硫酸可以与硝酸钡反应生成硝酸,故B符合题意;
C.CuSO4和CuO不能反应,故C不符合题意;
D.HCl与Ba(NO3)2不能反应,故D不符合题意;
故选:B。
17.如图中 X、Y、Z 是初中化学常见物质,箭头表示物质之间可以向箭头方向一步转化, 下列说法中不正确的是
A.若 X 是 SO2,则 Z 可能是 O2
B.若 X 是 H2O,则 Z 可能是 O2
C.若 X 是 O2,则 Z 可能是 CO2
D.若 X 是 CO2,则 Z 可能是 H2CO3
【答案】B
【解析】
A.若X是SO2,则Z可能是O2,氧气和硫点燃生成二氧化硫,二氧化硫和氢氧化钠反应生成水,水通电生成氢气和氧气,可以实现转化,故A正确;
B.若X是H2O,则Z可能是O2,氢气和氧气点燃生成水,水无法转化为一种物质,且能生成氧气,故B错误;
C.若X是O2,则Z可能是CO2,二氧化碳与水通过光合作用可得氧气,碳与氧气不完全燃烧生成一氧化碳,一氧化碳燃烧可得二氧化碳,故C正确;
D.若X是CO2,则Z可能是H2CO3,二氧化碳和氢氧化钙反应生成水,水和二氧化碳反应生成碳酸,碳酸分解生成水和二氧化碳,可以实现转化,故D正确;
故选B。
18.I、硫酸和盐酸既是实验室常用的试剂,也是重要的化工原料。它们既有相似之处,又有不同之点。
(1)它们水溶液的pH都___________7(填“大于”、“小于”或“等于”)。
(2)它们都能除铁锈,写出盐酸与铁锈主要成分反应的化学方程式___________。
(3)它们都能与碱反应生成盐和水,该类反应叫___________反应。
(4)打开两瓶分别盛有浓硫酸和浓盐酸的试剂瓶,瓶口出现白雾的是___________。
II、请仔细观察下面溶液的变化并回答问题。
(5)A中的试管___________(填“能”或“不能”)把水加入浓硫酸中。
(6)B中溶液变浑浊的原因是___________。
(7)把A中试管内试剂改为Mg和稀盐酸,___________(填“会”或“不会”)出现与上图相同的现象。
(8)在A、B、C中Ca(OH)2溶液的质量分数的大小关系是___________(用A、B、C和 “>”、“<”、“=”表示)
【答案】(1)小于
(2)Fe2O3+6HCl=2FeCl3+3H2O
(3)中和
(4)浓盐酸
(5)不能
(6)氢氧化钙的溶解度随温度升高而降低、浓硫酸稀释大量放热引起氢氧化钙饱和溶液温度升高、有氢氧化钙晶体析出而产生浑浊。
(7)会
(8)A>B=C
【分析】
(1)它们都属于酸、水溶液的pH都小于。
(2)它们都能与氧化铁反应生成可溶性铁盐和水、因此能除铁锈,盐酸与铁锈主要成分反应的化学方程式为Fe2O3+6HCl=2FeCl3+3H2O。
(3)它们都属于酸,酸与碱反应生成盐和水,该类反应叫中和反应。
(4)浓硫酸难挥发。浓盐酸易挥发,在空气中能形成白雾。故打开两瓶分别盛有浓硫酸和浓盐酸的试剂瓶,瓶口出现白雾的是浓盐酸。
(5)浓硫酸的密度比水大得多、浓硫酸稀释时会大量放热。若把水加入到浓硫酸中,会出现酸液飞溅现象、很不安全。则不能把水加入浓硫酸中。
(6)B中溶液变浑浊的原因是:氢氧化钙的溶解度随温度升高而降低、浓硫酸稀释大量放热引起氢氧化钙饱和溶液温度升高、有氢氧化钙晶体析出而产生浑浊。
(7)镁和盐酸发生反应产生氯化镁和氢气、是放热反应。因此把A中试管内试剂改为Mg和稀盐酸,会出现与上图相同的现象。
(8)从A到B的过程中,澄清石灰水中水分不变、而有晶体析出,因此B中澄清石灰水的质量分数变小;一段时间以后,温度下降、恢复常温,但是B和C两份溶液的成分没有改变,因此两者的质量分数相等。则:在A、B、C中Ca(OH)2溶液的质量分数的大小关系是A>B=C。
19.现有Ca(OH)2、Na2CO3、BaCl2、NaOH、盐酸、稀硫酸六种溶液,它们存在如图所示的相互反应关系,图中每条线两端的物质可以发生化学反应,试将它们的化学式填入图中相应的六个方框中。
【答案】
【解析】由稀硫酸与4种物质反应,但和盐酸不反应,Na2CO3也与4种物质反应,但和NaOH不反应;根据Ca(OH)2能与3种物质反应和BaCl2只能与2种物质反应,可确定题述六种溶液的位置。
20.单质、氧化物、酸、碱、盐,这些不同类别的物质之间反应时可以生成盐,某同学构建了如图所示的知识网络图。
(1)请任写一种符合图中组合⑥关系的化学方程式(要求组合⑥不能与图中已有组合重复):______________________________。
(2)用面粉制作馒头的发酵过程中会产生有机酸,设其化学式为HR,R表示有机酸根成分,若在蒸馒头前加入小苏打,则蒸好的馒头有很多小孔,吃起来松软可口且无酸味。请写出发生反应的化学方程式:__________________________________________________
________________________________________________________________________。
该反应所对应的是图中的哪种组合?________。(从①~⑩中选序号填入)
(3)Fe3O4可看作由Fe2O3和FeO组成。请写出Fe3O4与盐酸反应的化学方程式:________________________________________________________________________
________________________________________________________________________。
【答案】
(1)Fe+CuSO4===FeSO4+Cu(答案合理即可)
(2)HR+NaHCO3===CO2↑+H2O+NaR ①
(3)Fe3O4+8HCl===2FeCl3+FeCl2+4H2O
(或FeO·Fe2O3+8HCl===FeCl2+2FeCl3+4H2O)
【解析】
(1)组合⑥可以是盐+金属,也可以是盐+非金属等其他合理组合,只要是化学方程式合理且正确都可。
(2)碳酸氢钠与HR反应时会生成水、二氧化碳和NaR(R的化合价是-1价),属于盐与酸发生的复分解反应。
(3)根据Fe3O4的化学式也可以写成FeO·Fe2O3,所以可以与盐酸反应生成氯化铁和氯化亚铁,所以化学方程式为Fe3O4+8HCl===2FeCl3+FeCl2+4H2O或FeO·Fe2O3+8HCl===2FeCl3+FeCl2+4H2O。
21.在稀硫酸、二氧化碳、铜片、食盐、生石灰、一氧化碳、纯碱、铁片和木炭粉9种物质间存在如图所示关系,给①~⑤选择适当的物质,使有连线的两种物质之间能发生反应。
(1)它们的化学式分别为①________;②________;③________;④________;⑤________。
(2)写出下列物质之间反应的化学方程式:
①和②_________________________________________________________________;
②和④_________________________________________________________________;
②和⑤__________________________________________________________________;
③和④__________________________________________________________________。
(3)“盐⑤”与二氧化硅(SiO2)在高温下发生化学反应,生成一种新的盐和一种新的非金属氧化物。写出该反应的化学方程式:_______________________________________________。
【答案】
(1)Fe H2SO4 CO2 CaO Na2CO3
(2)Fe+H2SO4===FeSO4+H2↑
H2SO4+CaO===CaSO4+H2O
H2SO4+Na2CO3===Na2SO4+CO2↑+H2O
CO2+CaO===CaCO3
(3)Na2CO3+SiO2Na2SiO3+CO2↑
【解析】该题结合物质的性质,考查物质分类的应用。据单质①能和酸②发生化学反应,推知①应为活泼金属单质,即为铁;而酸只有稀H2SO4,即②为稀H2SO4,则氧化物④应为金属氧化物,即④为CaO(生石灰),氧化物③为酸性氧化物,即为CO2;⑤属于盐且既能与稀H2SO4反应,又能与CaO在水溶液中反应,则⑤应为Na2CO3(纯碱)。
22.多种多样的化学物质组成了丰富多彩的物质世界。
(1)下列元素在自然界中既存在游离态,又存在化合态的是________(填序号)。
①氮 ②氧 ③钠 ④碳 ⑤铁 ⑥氯
(2)含上述元素的下列物质分类正确的是________(其中“××”表示不存在或没有列出)。
(3)①钠元素所形成的物质有Na2O、Na2O2、NaOH、Na2CO3、NaHCO3。②碳元素所形成的物质有CO、CO2、CH3COOH。①中所有物质(固体或溶液)和②中所有物质(气体或溶液)间能发生的化学反应共有________种。(已知:CO2+H2O+Na2CO3===2NaHCO3,2Na2O2+2H2O===4NaOH+O2↑)
A.7B.8
C.9D.10
【答案】 (1)①②④⑤ (2)D (3)C
【解析】本题考查元素与物质的关系、物质的分类及物质间的反应。
(1)钠元素和氯元素在自然界中没有游离态,只有化合态。
(2)A选项中,NH3不属于碱;B选项中,NaHSO4不属于酸;C选项中,“苏打”不属于碱;D选项正确;E选项中,NaClO不属于碱。
(3)CO2与Na2O、Na2O2、NaOH、Na2CO3的固体或溶液均反应;CH3COOH与Na2O、Na2O2、NaOH、Na2CO3、NaHCO3的固体或溶液均反应,共9个化学反应。
23.(2023年贵州毕节)实验室现有BaCl2、NaNO3、HNO3、HCl、NaHCO3、AgNO3六种溶液,现从中任取四种溶液,编号为A、B、C、D并进行相关实验。其中A属于盐类且能与B反应生成气体,B、C、D间反应现象的记录如表。回答下列问题:
(1)根据实验现象及已知条件,可推断出四种溶液中落质的化学式:A:_______B:_______ C:_______D:_______。
(2)按要求写出下列反应的化学化学方程式:
①A和B的反应:__________________________________。
②B和D的反应:________________________________________。
③C和D的反应:________________________________________。
【答案】
(1)NaHCO3 HCl BaCl2 AgNO3
(2)①NaHCO3+HCl=NaCl+CO2↑+H2O ②HCl+AgNO3=HNO3+AgCl↓ ③BaCl2+2AgNO3=2AgCl↓+Ba(NO3)2
【解析】A属于盐类且能与B反应生成气体,由题干给的物质可知A为NaHCO3,B为HNO3或HCl,由表可知B和D生成沉淀,所有的硝酸盐都可溶,说明B是HCl,D是AgNO3,C与D也生成沉淀,说明C组成中含有Cl-,则C为BaCl2。
(1)由分析可知,A为NaHCO3,B为HCl,C为BaCl2,D为AgNO3;
(2)①A和B反应的化学方程式:NaHCO3+HCl=NaCl+CO2↑+H2O;②B和D反应的化学方程式:HCl+AgNO3=HNO3+AgCl↓;③C和D反应的化学方程式:BaCl2+2AgNO3=2AgCl↓+Ba(NO3)2。
24.(2022秋·福建省南平市高级中学校考期中)2021年在四川广汉三星堆新发现大量青铜器,如青铜面具、青铜神树等等。如图中的文物是三星堆出土的青铜面具之一,由于时间久远,表面有一层“绿锈”,“绿锈”俗称“铜绿”,是铜和空气中的水蒸气、O2、CO2作用产生的,其化学式为Cu2(OH)2CO3,请用学过的方法对其展开探究。
(1)根据以上信息可知Cu2(OH)2CO3的物理性质(写“色、态”)_______。
(2)为了探究物质的性质,先要了解物质所属的类别,从不同分类标准分析“铜绿”不属于_______。
A.铜盐 B.碳酸盐 C.碱式盐 D.碱 E.含氧酸盐 F.无氧酸盐
(3)你从“铜绿”的组成和类别预测它可能具有的性质是_______(如热稳定性或与哪些物质反应,任写2点)。
(4)经过实验探究,以“铜绿”为反应物可以实现以下物质转化:
“铜绿CuOCu”
经观察反应①固体物质溶解,有气泡产生,写出反应方程式_______。
(5)请从不同角度分析反应④的变化(仔细对比,写出其中一个变化)_______。
【答案】
(1)绿色固体
(2)DF
(3)受热易分解,与酸反应
(4) Cu2(OH)2CO3+4HCl=2CuCl2+3H2O+CO2↑
(5)颜色由黑色变为红色,氧化物变成单质或铜元素由+2价变为0价
【解析】(1)铜器表面有一层“绿锈”,说明Cu2(OH)2CO3的物理性质为:绿色固体;
(2)铜绿属于铜盐、碳酸盐、碱式盐、含氧酸盐,不属于碱、无氧酸盐,故选DF;
(3)铜绿受热易分解,为碱式盐,故可能具有的性质为:受热易分解,与酸反应;
(4)铜绿与盐酸反应生成氯化铜、二氧化碳和水;氯化铜与氢氧化钠反应生成氢氧化铜,氢氧化铜受热分解生成氧化铜,氧化铜被还原生成铜。反应①的反应方程式为:Cu2(OH)2CO3+4HCl=2CuCl2+3H2O+CO2↑;
(5)氧化铜被还原为铜,固体颜色由黑色变为红色,氧化物变成单质(铜元素由+2价变为0价)。初中要求
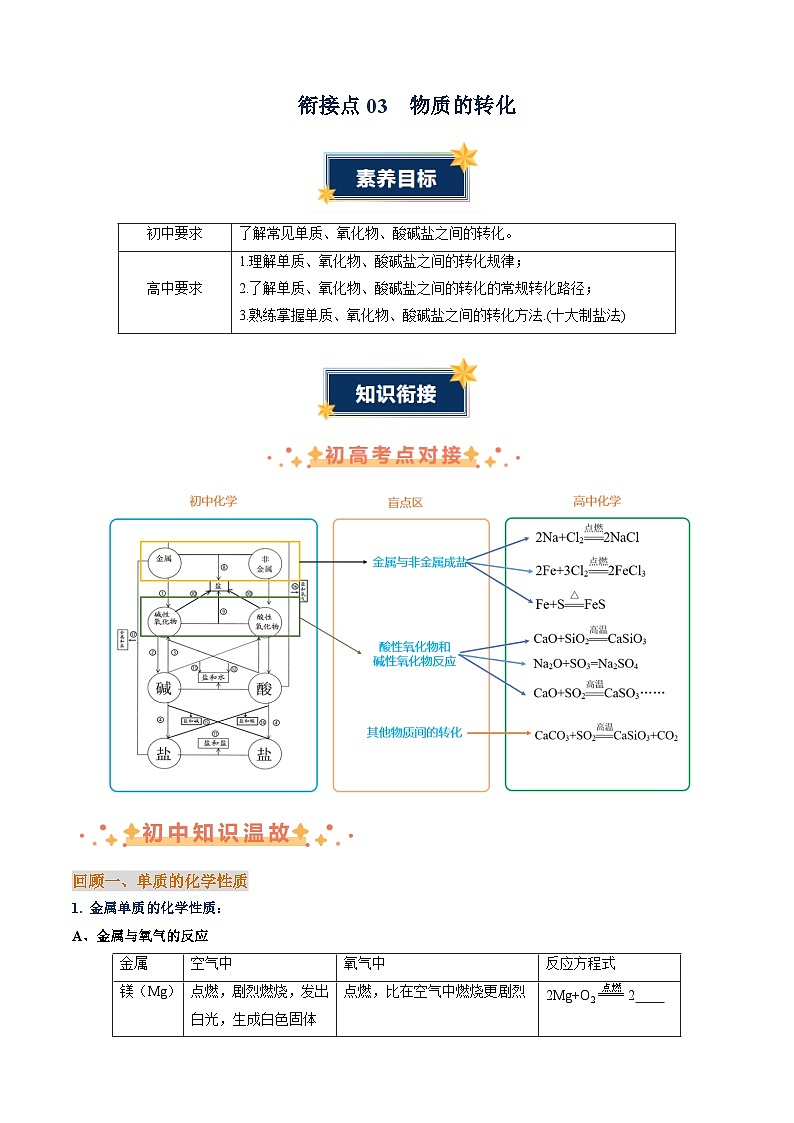
了解常见单质、氧化物、酸碱盐之间的转化。
高中要求
1.理解单质、氧化物、酸碱盐之间的转化规律;
2.了解单质、氧化物、酸碱盐之间的转化的常规转化路径;
3.熟练掌握单质、氧化物、酸碱盐之间的转化方法.(十大制盐法)
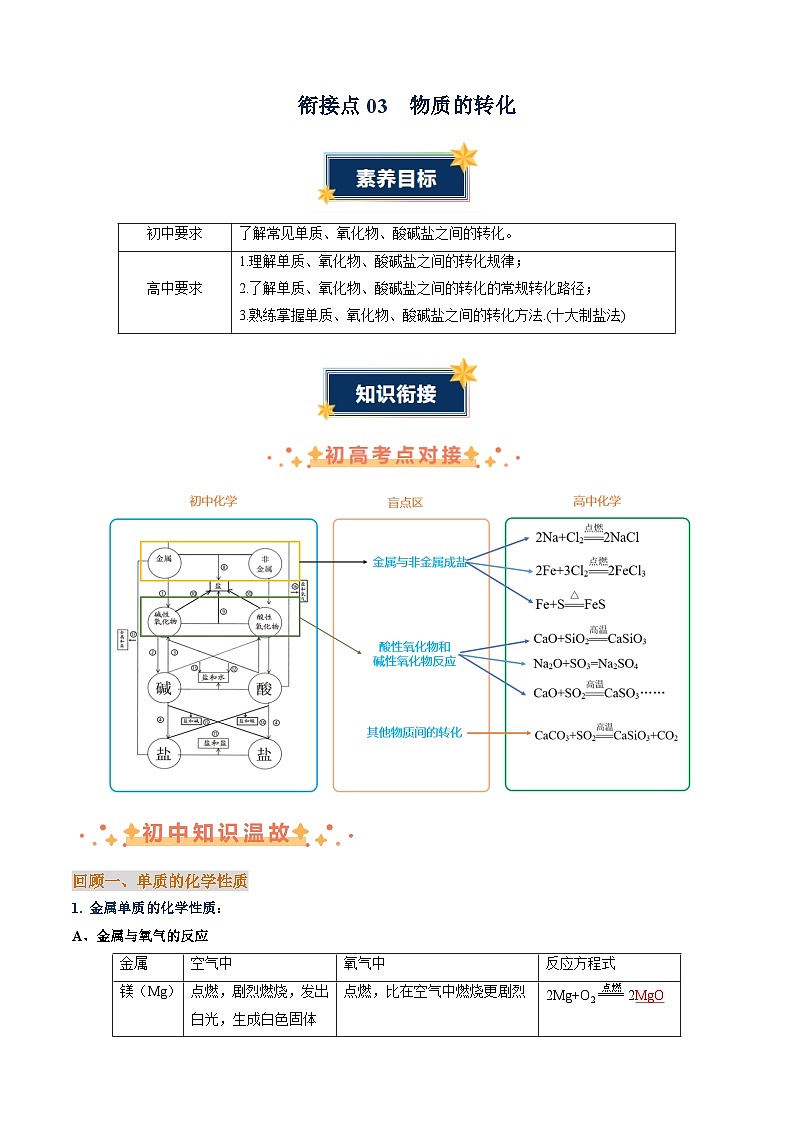
金属
空气中
氧气中
反应方程式
镁(Mg)
点燃,剧烈燃烧,发出白光,生成白色固体
点燃,比在空气中燃烧更剧烈
2Mg+O2eq \\ac(\s\up7(点燃),\(===,====))2MgO
铝(Al)
常温下,表面生成一层致密的氧化铝薄膜,阻止铝进一步被氧化
点燃,剧烈燃烧,发出白光,生成白色固体
4Al+3O2=2Al2O3或4Al+3O2eq \\ac(\s\up7(点燃),\(===,====))2Al2O3
铁(Fe)
点燃,不燃烧,只发红热
点燃,剧烈燃烧、火星四射,生成黑色固体,放出大量的热
3Fe+2O2eq \\ac(\s\up7(点燃),\(===,====))Fe3O4
铜(Cu)
加热,表面会生成黑色固体
2Cu+O2 eq \\ac(\s\up7(△),\(===,====))2CuO
金(Au)
即使高温条件下,也不与氧气反应
金属
与盐酸反应
与稀硫酸反应
现象
镁
Mg+2HCl=MgCl2+H2↑
Mg+H2SO4=MgSO4+H2↑
剧烈反应,产生大量气泡,溶液仍为无色
铝
2Al+6HCl==2AlCl3+3H2↑
2Al+3H2SO4=Al2(SO4)3+3H2↑
剧烈反应,产生大量气泡,溶液仍为无色
锌
Zn+2HCl=ZnCl2+H2↑
Zn+H2SO4═ZnSO4+H2↑
反应比较剧烈,产生气泡,溶液仍为无色
铁
Fe+2HCl=FeCl2+H2↑(稀盐酸)
Fe+H2SO4═FeSO4+H2↑
反应缓慢,有气泡产生,溶液由无色变为浅绿色
铜
不反应
紫色石蕊溶液
无色酚酞溶液
稀盐酸
变红色
不变色
稀硫酸
变红色
不变色
与稀盐酸反应的化学方程式
与稀硫酸反应的化学方程式
镁
Mg+2HCl==MgCl2+H2↑
Mg+H2SO4==MgSO4+H2↑
锌
Zn+2HCl==ZnCl2+H2↑
Zn+H2SO4==ZnSO4+H2↑
铁
Fe+2HCl==FeCl2+H2↑
Fe+H2SO4==FeSO4+H2↑
铝
2Al+6HCl==2AlCl3+3H2↑
2Al+3H2SO4==Al2(SO4)3+3H2↑
酸与活泼金属反应的共同现象是:金属逐渐溶解,并产生气泡
现象
化学方程式
铁锈与稀盐酸
铁锈逐渐溶解,溶液由无色变为黄色
Fe2O3+6HCl====2FeCl3+3H2O
铁锈与稀硫酸
Fe2O3+3H2SO4====Fe2(SO4)3+3H2O
氧化铜与稀盐酸
黑色粉末逐渐溶解,溶液由无色变为蓝色
CuO+2HCl==CuCl2+H2O
氧化铜与稀硫酸
CuO+H2SO4==CuSO4+H2O
现象
化学方程式
氢氧化钙与稀盐酸
滴有酚酞试剂的碱溶液由红色逐渐变成无色,放出热量
Ca(OH)2+2HCl===CaCl2+2H2O
氢氧化钙与稀硫酸
Ca(OH)2+H2SO4===CaSO4+2H2O
氢氧化铜与稀盐酸
蓝色固体消失,溶液由无色变为蓝色
Cu(OH)2+2HCl===CuCl2+2H2O
氢氧化铁与稀硫酸
红褐色固体消失,溶液由无色变为黄色
2Fe(OH)3+3H2SO4===Fe(SO4)3+3H2O
现象
化学方程式
碳酸钠与稀盐酸
有气泡产生
Na2CO3+2HCl===2NaCl+CO2↑+H2O
碳酸氢钠与稀硫酸
2NaHCO3+H2SO4===Na2SO4+2CO2↑+2H2O
紫色石蕊溶液
无色酚酞溶液
氢氧化钠溶液
蓝色
红色
氢氧化钙溶液
蓝色
红色
选项
甲
乙
丙
丁
A
B
Si
C
NO
D
Cu
CuO
选项
元素
酸性
氧化物
碱性
氧化物
酸
碱
盐
A
氮
N2O5
××
HNO3
NH3
KNO3
B
钠
××
Na2O
NaHSO4
NaOH
NaCl
C
碳
CO2
××
H2CO3
苏打
小苏打
D
铁
××
Fe2O3
××
Fe(OH)3
K2FeO4
E
氯
Cl2O7
××
HClO
NaClO
KClO3
溶液
B
C
D
B
—
不反应
↓
C
不反应
—
↓
D
↓
↓
—
衔接点04 电解质和电离(原卷版+解析版)2024年初升高化学无忧衔接(通用版): 这是一份衔接点04 电解质和电离(原卷版+解析版)2024年初升高化学无忧衔接(通用版),文件包含衔接点04电解质和电离原卷版docx、衔接点04电解质和电离解析版docx等2份试卷配套教学资源,其中试卷共31页, 欢迎下载使用。
衔接点02 分散系和胶体(原卷版+解析版)2024年初升高化学无忧衔接(通用版): 这是一份衔接点02 分散系和胶体(原卷版+解析版)2024年初升高化学无忧衔接(通用版),文件包含衔接点02分散系和胶体原卷版docx、衔接点02分散系和胶体解析版docx等2份试卷配套教学资源,其中试卷共32页, 欢迎下载使用。
衔接点01 物质的分类(原卷版+解析版)2024年初升高化学无忧衔接(通用版): 这是一份衔接点01 物质的分类(原卷版+解析版)2024年初升高化学无忧衔接(通用版),文件包含衔接点01物质的分类原卷版docx、衔接点01物质的分类解析版docx等2份试卷配套教学资源,其中试卷共32页, 欢迎下载使用。












