

衔接点22 化学键讲义(原卷版+解析版)2024年初升高化学无忧衔接(通用版)
展开回顾一、原子的结构
1.原子的结构
1897年,英国科学家汤姆生发现电子,证明原子的可分性。
原子结构模拟图
原子eq \b\lc\{\rc\ (\a\vs4\al\c1(原 子 核\b\lc\{\rc\ (\a\vs4\al\c1(质子eq \b\lc\{\rc\ (\a\vs4\al\c1(带正电荷,质子数=核电荷数))
,中子(不带电))),核外电子\b\lc\{\rc\ (\a\vs4\al\c1(核外电子数=核内质子数(原子不显电性的原因),在原子核外分层运动))))
2.原子中核电荷数、质子数与核外电子数的关系
(1)核电荷数指的是原子核所带的正电荷数,由于原子核是由质子和中子构成的,每个质子带一个 单位的正电荷,中子不带电,所以原子的核电荷数等于质子数。
(2)原子不显电性,每个质子带一个单位正电荷,每个电子带一个单位负电荷,所以质子数等于核 外电子数。
(3)所以:质子数=核电荷数=核外电子数
回顾二、离子
1. 氯化钠的形成过程
钠原子的最外层电子数为1,倾向于失去1个电子;氯原子的最外层电子数为 7,倾向于得到1个电子。当钠原子和氯原子化合时,钠原子就会失去1个电子形成 Na+,氯原子得到1个电子形成Cl-,最外层都达到8个电子的相对稳定结构,两种离子在静电作用下互相结合成为NaC1,如上图所示。
2. 离子的定义
(1)离子:带电荷的原子或原子团,如 Cl-、 Cu2+ 、SOeq \\al(2-,4)等。
(2)原子团:由两种或两种以上原子按照一定的个数比例组成的整体,在一般的化学反应中,作为一 个整体参与反应,常见的原子团离子如下表所示:
3. 离子的分类与书写
(1)离子的形成与分类
离子的形成eq \b\lc\{\rc\ (\a\vs4\al\c1(原子eq \\ac(\s\up5(失电子),\s\d0(———→))阳离子\b\lc\{\rc\ (\a\vs4\al\c1(质子数>核外电子数,带正电)), 原子eq \\ac(\s\up5(得电子),\s\d0(———→))阴离子\b\lc\{\rc\ (\a\vs4\al\c1(质子数<核外电子数,带负电))))
①表示方法:
在元素符号(或原子团)的右上角标明离子所带的电荷,数值在前,正、负号在后。离子带 1个单位的正电荷或 1个单位的负电荷时,“1”省略不写,如:阳 离子:Na+、Mg2+、Al3+等;阴离子: Cl、SOeq \\al(2-,4)等。
②含义:镁离子(Mg2+)中数字“2”的意义表示 一个镁离子带两个单位的正电荷。
新知一、离子键和离子化合物
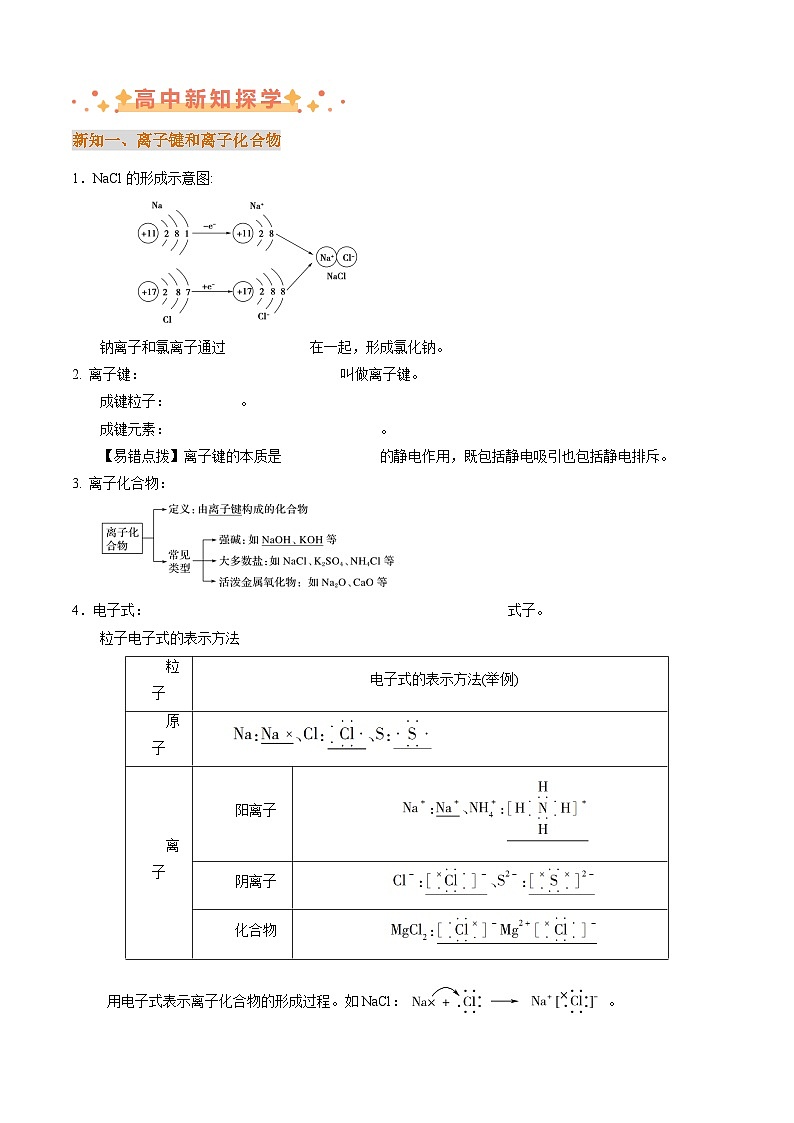
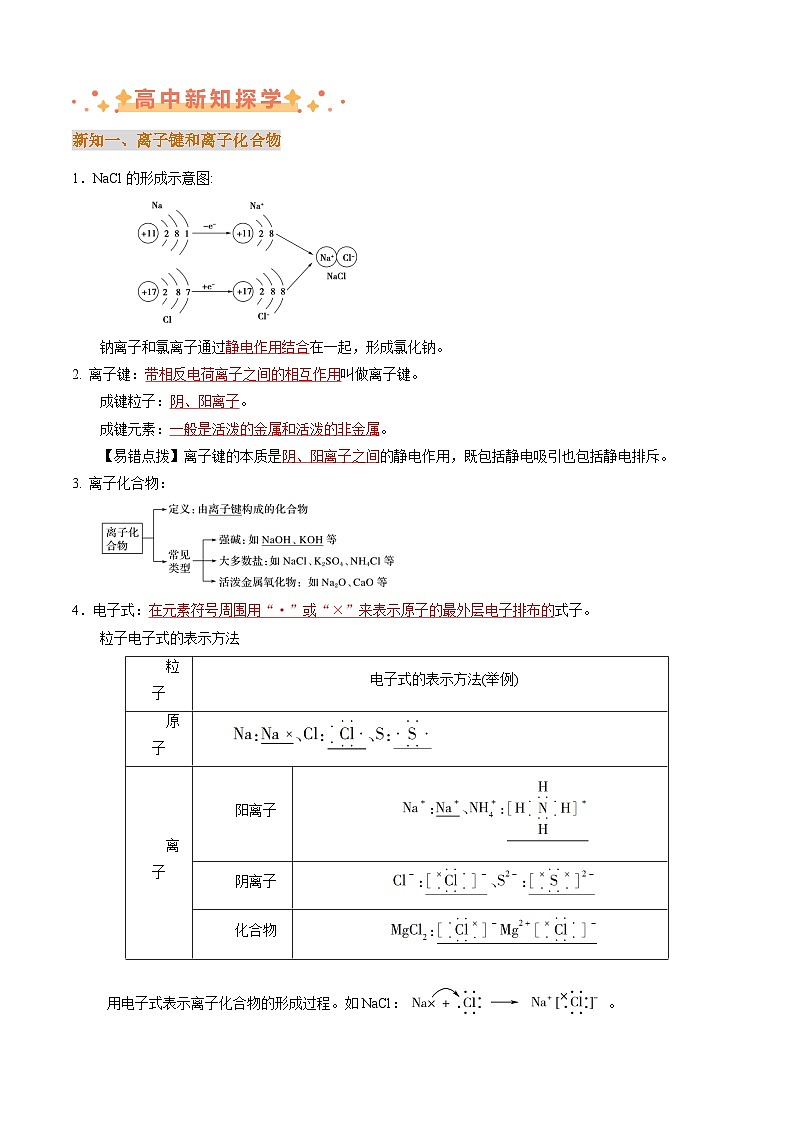
1.NaCl的形成示意图:
钠离子和氯离子通过静电作用结合在一起,形成氯化钠。
2. 离子键:带相反电荷离子之间的相互作用叫做离子键。
成键粒子:阴、阳离子。
成键元素:一般是活泼的金属和活泼的非金属。
【易错点拨】离子键的本质是阴、阳离子之间的静电作用,既包括静电吸引也包括静电排斥。
3. 离子化合物:
4.电子式:在元素符号周围用“·”或“×”来表示原子的最外层电子排布的式子。
粒子电子式的表示方法
用电子式表示离子化合物的形成过程。如NaCl:。
新知二、共价键和共价化合物
1.共价键
形成过程(以Cl2的形成为例):
定义:原子间通过共用电子对所形成的相互作用。
成键粒子:原子。
成键元素:一般是同种的或不同种的非金属元素。
2.分类
3.共价化合物
4.电子式
(1)非金属单质:Cl2:, N2:。
(2)共价化合物:H2O:, CO2:。
(3)用电子式表示形成过程:HCl: 。
5.结构式:用短线“—”表示分子中共用电子对的式子如H2O:H—O—H。
6.以共价键形成的分子的表示方法
新知三、化学键
1.概念:相邻的原子之间强烈的相互作用叫做化学键。
2.分类
【判断物质中所含化学键类型的思路】
(1)首先看物质的类型。只含有共价键的物质有非金属单质(稀有气体除外)、非金属氧化物、酸、大部分有机物;只含有离子键的物质有大多数金属氧化物、简单的盐(如NaCl)、金属氢化物等;既含共价键又含离子键的物质有碱、含复杂离子的盐(如NH4Cl)、含活泼金属的特殊化合物(如Na2O2)。
(2)其次看物质的构成元素。非金属元素原子之间一般形成共价键,活泼金属与活泼非金属元素原子之间一般形成离子键。
(3)化学反应的过程,既有旧化学键断裂,又有新化学键形成,二者缺一不可。有化学键断裂或形成的过程不一定发生化学变化。例如:①离子化合物的熔化过程。离子化合物熔化后电离成自由移动的阴、阳离子,离子键被破坏,只发生了物理变化。②电解质的溶解过程。电解质溶于水后,形成自由移动的阴、阳离子,化学键断裂,只发生了物理变化。
3.化学反应的本质
(1)表象:反应物中的原子重新组合为产物分子。
(2)本质:旧化学键的断裂和新化学键的形成。
新知四、分子间作用力
1.定义:分子之间还存在一种把分子聚集在一起的作用力叫做分子间作用力,最初叫范德华力。
2.规律:一般说来,对于组成和结构相似的物质,相对分子质量越大,分子间作用力越大,物质的熔、沸点也就越高,如卤素单质的熔、沸点:F2<Cl2<Br2<I2。
3.氢键:如液态NH3、H2O和HF中分子之间存在的一种比分子间作用力稍强的相互作用,叫氢键,氢键不是化学键,可看作一种较强的分子间作用力。
(1)氢键的形成条件:①化合物中有氢原子,即氢原子处在X—H···Y之间。
②氢只有跟非金属性强的并且其原子半径小的元素化合后,才能形成较强的氢键,这样的元素有N、O、F等。
(2)氢键对物质性质的影响:①氢键对物质熔、沸点的影响:分子间形成的氢键会使物质的熔点和沸点升高,这是因为固体熔化或液体汽化时必须破坏分子间的氨键,从而需要消耗更多的能量。
②分子间形成氢键对物质的水溶性、溶解度等也有影响。如NH3极易溶于水,主要是因为氨分子与水分子之间易形成氢键。
③水中氢键对水的密度也有影响,水结成冰时体积膨胀,密度减小,主要是因为冰中水分子间形成的氢键更多,使水分子间空隙变大。
新知五、化学键与物质类别的关系
(1)存在离子键的化合物一定是离子化合物。
(2)离子化合物中一定存在离子键,可能存在共价键,如NaOH、Na2O2、(NH4)2SO4等。
(3)共价化合物中只有共价键,一定没有离子键。
(4)熔融状态能导电的化合物一定是离子化合物;证明某化合物是离子化合物的实验方法,将化合物加热至熔融状态,检测其导电性。如果能导电,证明是离子化合物;否则不是离子化合物。溶解时能导电的化合物,不能判定其类别。
(5)全部由非金属元素组成的化合物也可能是离子化合物,如铵盐。由金属元素和非金属元素形成的化合物也可能是共价化合物,如AlCl3。
(6)非金属单质中只有共价键(稀有气体除外)。
1.(2023·天津南开·高一天津市第九中学校考期末)下列物质中,含有非极性键的是
A.Na2OB.HClC.CH4D.N2
【答案】D
【解析】A.Na2O中钠离子和氧离子之间以离子键结合,不存在非极性键,故A错误;
B.HCl中氢原子和氯原子之间以极性共价键结合,故B错误;
C.CH4中氢原子和碳原子之间以极性共价键结合,故C错误;
D.氮气分子中氮原子和氮原子之间以非极性共价键结合,故D正确;
故选D。
2.(2023秋·江苏徐州·高一统考期末)下列化学用语正确的是
A.中子数为8的碳原子:eq \\al(8,6)CB.HClO的结构式是
C.的球棍模型为D.的电子式为
【答案】B
【解析】A.中子数为8的碳原子,其质量数是14,可表示为eq \\al(14,6)C,A错误;
B.HClO的电子式为,其结构式是,B正确;
C.该模型是水的比例模型,C错误;
D.Na2O2的电子式应该为,D错误;
答案选B。
3.(2023秋·广东江门·高一江门市第一中学校考期末)下列各组物质中,化学键类型完全相同的是
A.HI和NaIB.Na2O2和NaOH
C.NaCl和CO2D.H2S和CH4
【答案】D
【解析】A.HI含有共价键,NaI含有离子键,化学键类型不同,A错误;
B.Na2O2含有离子键和非极性共价键,NaOH含有离子键和极性键,B错误;
C.NaCl含有离子键,CO2含有极性键,化学键不同,C错误;
D.H2S和CH4都只含有极性共价键,D正确;
故选D。
4.(2023·广东广州·高一广州市广外附设外语学校校考期末)下列说法正确的是
A.某物质的水溶液能导电,则该物质中一定含有离子键
B.MgCl2晶体中存在共价键和离子键
C.NH3和Cl2两种分子中,每个原子的最外层都具有8电子稳定结构
D.H2S和CO2化学键类型完全相同
【答案】D
【解析】A.溶于水能导电的物质,可能是因为其溶于水电离出自由移动的离子,如HCl等,不含离子键,属于共价化合物;也可能是与水反应,生成电解质,发生电离,如CO2+H2O=H2CO3,碳酸能电离,所以CO2的水溶液能导电,但是CO2属于共价化合物,且也不是电解质,故A错误;
B.MgCl2属于离子化合物,不含共价键,只含离子键,故B错误;
C.NH3中H元素位于第一周期,最外层最多2个电子,故C错误;
D.H2S和CO2均为共价化合物,均含极性共价键,故D正确;
故选D。
5.(2023·重庆沙坪坝·高一重庆一中期末)X、Y、Z、W、R属于短周期主族元素,X的原子半径在短周期主族元素中最大,Y元素位于元素周期表的第二周期,Y元素原子的最外层电子数为m,次外层电子数为n,Z元素原子的L层电子数为m+n,M层电子数为m-n,W元素与Z元素同主族,R元素原子与Y元素原子的核外电子数之比为2∶1。下列叙述不正确的是
A.WY2、RY2都属于共价化合物
B.X、Z、W、Y原子半径依次减小
C.X与Y形成的两种化合物中阳、阴离子的个数比均为2∶1
D.Z、W、R最高价氧化物对应水化物的酸性由强到弱的顺序是R>Z>W
【答案】D
【分析】X、Y、Z、W、R属于短周期主族元素,其中X的原子半径是短周期主族元素中最大的,则X为Na;Y元素位于元素周期表的第二周期,Y元素原子的最外层电子数为m,次外层电子数为n,则n=2,Z元素的原子L层电子数为 m+n,M层电子数为 m-n,则m+n=8,则m=8-2=6,故Y为O元素,Z的M层电子数为6-2=4,故Z为Si元素;W元素与Z元素同主族,则W为C元素;R元素原子与Y元素原子的核外电子数之比为2:1,Y的核外电子数为8,R的核外电子数为16,则R为S元素,据此分析解题。
【解析】由分析可知,X为Na、Y为O、Z为Si、W为C、R为S;
A.由分析可知,Y为O、W为C、R为S ,CO2、SO2都属于共价化合物,A正确;
B.由分析可知,X为Na、Z为Si、R为S 、Y为O,根据电子层数越多半径越大,电子层数相同,核电荷数越大半径越小,X、Z、W、Y原子半径依次减小,B正确;
C.X与Y形成的两种化合物分别为Na2O、Na2O2,两种化合物中阳、阴离子的个数比均为2:1,C正确;
D.非金属性:S>C>Si,元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强,故酸性:硫酸>碳酸>硅酸即R>W>Z,D错误;
故答案为:D。
6.(2022秋·吉林长春·高一东北师大附中校考期末)回答下列问题:
(1)下列变化:①升华;②烧碱熔化;③溶于水;④溶于水;⑤溶于水;⑥受热分解。其中仅共价键被破坏的是_______;(填序号,下同)仅离子键被破坏的是_______;
(2)在下列物质中:①、②、③、④、⑤、⑥、⑦、⑧、⑨、⑩(用物质前序号填空)。其中只存在非极性键的分子是_______;既存在离子键又存在极性键的是_______
(3)写出下列物质的电子式。
①_______②_______
(4)用电子式表示下列物质的形成过程。
①_______②_______
【答案】
(1) ④ ②③
(2) ② ⑥⑦
(3)
(4)
【解析】(1)①I2升华破坏的是分子间作用力,与分子内的化学键无关;
②烧碱熔化断裂离子键变为自由移动的Na+、OH-,与共价键无关;
③NaCl是离子化合物,其溶于水时,断裂离子键变为自由移动的Na+、Cl-,没有断裂共价键;
④HCl溶于水时,在水分子作用下断裂共价键,变为自由移动的H+、Cl-,没有断裂离子键;
⑤O2溶于水时,破坏的是分子间作用力,与分子内的化学键无关;
⑥NH4HCO3受热分解变为NH3、H2O、CO2,断裂的是离子键、共价键。因此其中仅发生共价键破坏的是④;仅发生离子键破坏的是②③;
(2)①在HCl分子中仅存在极性共价键;
②在N2分子中仅存在非极性共价键;
③中NH3分子中仅存在极性共价键;
④Na2O2是离子化合物,在Na2O2中存在离子键和非极性共价键;
⑤H2O2是共价化合物,在该物质分子中含有极性共价键、非极性共价键;
⑥NH4Cl是离子化合物,其中含有离子键和极性共价键;
⑦NaOH是离子化合物,其中含有离子键和极性共价键;
⑧Ar是由分子构成的物质,物质分子是单原子分子,不存在化学键;
⑨CO2是共价化合物,在该物质分子中只含有极性共价键;
⑩N2H4是由分子构成的物质,在物质分子中含有极性共价键和非极性共价键;
综上所述可知:其中只存在非极性键的分子是②N2;既存在离子键又存在极性键的是⑥NH4Cl、⑦NaOH;
(3)Na2O2是离子化合物,在Na2O2中,2个Na+与之间以离子键结合,在阴离子中,2个O原子之间以共价单键结合,故Na2O2的电子式为:;
②HClO是共价化合物,在HClO分子中,O原子与H、Cl原子分别形成1对共用电子对,使分子中的原子达到最外层2个或8个电子的稳定结构,故HClO的电子式为:;
(4)Na2S是离子化合物,2个Na原子失去最外层的1个电子变为Na+,S原子获得2个电子,使原子最外层达到8个电子的稳定结构而变为S2-,S2-与2个Na+之间以离子键结合,故用电子式表示Na2S的形成过程为:;
在H2O分子中,H原子核外只有1个电子,O原子最外层有6个电子,2个H原子的2个电子与1个O原子形成2对共用电子对,使物质分子中各个原子都达到最外层2个或8个电子的稳定结构,故用电子式表示H2O的形成过程为:。
1.(2023秋·北京西城·高一统考期末)下列化学用语不正确的是
A.Mg的原子结构示意图是:
B.NH3的电子式是:
C.CH4的分子结构模型是:
D.NaCl的形成过程是:
【答案】B
【解析】A.Mg为12号元素,原子结构示意图是:,A正确;
B.NH3为共价化合物且氮原子为8电子稳定结构,电子式是:,B错误;
C.CH4分子为正四面体形,分子结构模型是:,C正确;
D.NaCl为钠离子和氯离子形成的离子化合物,形成过程是:,D正确;
故选B。
2.(2023秋·上海浦东新·高一上海市进才中学校考期末)下列变化不需要破坏化学键的是
A.碳酸钙受热分解B.干冰气化
C.食盐熔化D.氯化氢溶于水
【答案】B
【解析】A.碳酸钙受热分解破坏离子键和共价键,A不符合题意;
B.干冰气化破坏分子间作用力,不需要破坏化学键,B符合题意;
C.食盐熔化破坏离子键,C不符合题意;
D.氯化氢溶于水破坏共价键,D不符合题意;
答案选B。
3.(2023·北京·高一汇文中学期末)X、Y、Z、W为四种短周期主族元素,它们在周期表中的位置如图所示。Z元素原子核外K层与M层电子数相等。下列说法中不正确的是
A.原子半径由小到大的顺序为:Y<X<W<Z
B.与同浓度的盐酸反应,Z比W更剧烈
C.X、Z两种元素的氧化物中所含化学键类型相同
D.Y的氢化物受热分解过程中,极性共价键断裂,非极性共价键生成
【答案】C
【分析】X、Y、Z、W为四种短周期主族元素,它们在周期表中的位置如图所示。Z元素原子核外K层与M层电子数相等,则Z为Mg,W为Al,X为C,Y为N。
【解析】A.根据层多径大,同电子层结构核多径小,则原子半径由小到大的顺序为:Y<X<W<Z,故A正确;
B.同周期从左到右金属性逐渐减弱,因此与同浓度的盐酸反应,Z比W更剧烈,故B正确;
C.X、Z两种元素的氧化物分别为CO、MgO,前者含共价键,后者含离子键,因此两者所含化学键类型不相同,故C错误;
D.氨气分解生成氮气和氢气,Y的氢化物受热分解过程中,极性共价键断裂,非极性共价键生成,故D正确。
综上所述,答案为C。
4.(2023·湖北武汉·高一期末)2022年5月,人类首次利用月球土壤成功种活了植物,未来的宇航员们有可能在月球上种植食物,月壤中所含短周期主族元素X、Y、Z、W的原子序数依次增大,X、Y、W的原子核外最外层电子数为互不相等的偶数,X原子的最外层电子数是其内层电子总数的3倍,W元素在地壳中的含量位居第二,常见元素乙的单质是目前使用量最大的主族金属元素,下列叙述正确的是
A.原子半径大小顺序:
B.Y、Z、W的最高价氧化物的水化物均显碱性,且碱性逐渐减弱
C.元素W和X的简单氢化物的沸点:
D.元素X与Y、Z、W形成的二元化合物的化学键依次为离子键、离子键、共价键
【答案】D
【分析】X原子的最外层电子数是其内层电子总数的3倍,所以X为O元素,W元素在地壳中的含量位居第二,所以W为Si,元素Z的单质是目前使用量最大的主族金属元素,Z为Al,X、Y、W的原子核外最外层电子数为互不相等的偶数,X最外层电子数为6,W最外层电子数为4,所以Y为主族元素,且原子序数介于X与Z之间,所以Y最外层电子数为2,Y为Mg,综上,X为O,Y为Mg,Z为Al,W为Si,据此分析解题。
【解析】A.一般电子层数多,半径大,同周期,从左到右原子半径依次减小,所以Y>Z>W>X,A错误;
B.Y、Z、W的最高价氧化物的水化物即Mg(OH)2、Al(OH)3、H2SiO3,Mg(OH)2显碱性,Al(OH)3为两性氢氧化物,H2SiO3显酸性,B错误;
C.由分析可知,W为Si、X为O,由于H2O分子间能够形成分子间氢键,而SiH4不能,故元素W和X的简单氢化物的沸点:X>W,C错误;
D.由分析可知,X为O,Y为Mg,Z为Al,W为Si,则元素X与Y、Z、W形成的二元化合物分别为:MgO、Al2O3、SiO2,故它们的化学键依次为离子键、离子键、共价键,D正确;
故答案为:D。
5.(2023秋·上海浦东新·高一上海市进才中学校考期末)下列关于化学键的说法中正确的是
A.离子晶体中只有离子键
B.共价化合物分子中一定不含离子键
C.硫、氢、氧只能形成一种化合物
D.离子化合物中一定含有金属元素
【答案】B
【解析】A. 有些离子晶体中只有离子键,例如氯化钠,有些离子晶体中既有离子键又有共价键,例如氯化铵,A错误;
B. 共价化合物分子中只有共价键、一定不含离子键,B正确;
C. 硫、氢、氧能形成多种化合物,例如H2SO4、H2SO3等,C错误;
D. 离子化合物中不一定含有金属元素,例如氯化铵,D错误;
答案选B。
6.(2023陕西省黄陵县中学期中)下列叙述中正确的是
A. 含有共价键的化合物一定是共价化合物
B. 含有极性键的化合物一定不是离子化合物
C. 含有离子键的化合物一定是离子化合物
D. 含有非极性键的分子一定是共价化合物
【答案】C
【解析】含有共价键的化合物可能还含有离子键,所以不一定是共价化合物,如过氧化钠,A错误;含有极性键的化合物也可能是离子化合物,如NaOH是离子化合物, O原子与H原子之间存在极性键,B错误;由离子键构成的化合物是离子化合物,所以含有离子键的化合物一定是离子化合物,C正确;含有非极性键的分子可能是共价化合物,也可能是单质如H2等,D错误。
7.(2023江苏徐州高一期末)下列化学用语正确的是
A.中子数为8的碳原子: B.HClO的结构式是
C.的球棍模型为 D.的电子式为
【答案】B
【解析】中子数为8的碳原子,其质量数是14,可表示为,A错误;HClO的电子式为,其结构式是,B正确;该模型是水的比例模型,C错误;的电子式应该为,D错误;
8.(2023上海浦东新上海市进才中学高一期末)下列关于化学键的说法中正确的是
A.离子晶体中只有离子键
B.共价化合物分子中一定不含离子键
C.硫、氢、氧只能形成一种化合物
D.离子化合物中一定含有金属元素
【答案】B
【解析】有些离子晶体中只有离子键,例如氯化钠,有些离子晶体中既有离子键又有共价键,例如氯化铵,A错误;共价化合物分子中只有共价键、一定不含离子键,B正确;硫、氢、氧能形成多种化合物,例如H2SO4、H2SO3等,C错误;离子化合物中不一定含有金属元素,例如氯化铵,D错误。
9.(双选)(2023上海金山中学高一期末)下列物质发生所述变化时,所克服的微粒间作用力,属于同类型的是
A.干冰和碘的升华 B.NaBr和HI分别在水中电离
C.Na2SO4和CaO的熔化 D.将氯化氢和乙醇分别加入水中
【答案】AC
【解析】干冰和I2(s)的升华,均破坏分子间作用力,A符合题意;氯化钠属于离子晶体,溶解在水中克服离子键;HI属于共价化合物,溶解在水中克服共价键,B不符合题意;Na2SO4和CaO均属于离子化合物,熔化时破坏的是离子键,C符合题意;氯化氢加入水中,会破坏共价键,而乙醇与水互溶,在水中仍以分子形式存在,所以不破坏化学键,D不符合题意。
10.(2023重庆九龙坡·高一重庆实验外国语学校校考期末)下列关于离子化合物的叙述正确的是
A.离子化合物中可能存在共价键 B.离子化合物中阳离子一定是金属离子
C.离子化合物的水溶液一定能导电 D.离子键在形成过程中一定有电子的得失
【答案】A
【解析】离子化合物中存在离子键也可能同时存在共价键,例如过氧化钠中含有离子键和共价键,A正确;离子化合物中阳离子不一定是金属离子,例如氯化铵中的铵根离子,B错误;溶液导电的原因是存在自由移动的离子,离子化合物的水溶液不一定能导电,例如难溶性硫酸钡的溶液几乎不导电,C错误;离子键是阴阳离子通过静电作用形成的,在形成过程中不涉及电子的得失,在离子形成的过程中涉及电子得失,D错误。
11.(2023广东广州市广外附设外语学校高一期末)下列说法正确的是
A.某物质的水溶液能导电,则该物质中一定含有离子键
B.MgCl2晶体中存在共价键和离子键
C.NH3和两种分子中,每个原子的最外层都具有8电子稳定结构
D.H2S和CO2化学键类型完全相同
【答案】D
【解析】溶于水能导电的物质,可能是因为其溶于水电离出自由移动的离子,如HCl等,不含离子键,属于共价化合物;也可能是与水反应,生成电解质,发生电离,如CO2+H2O=H2CO3,碳酸能电离,所以CO2的水溶液能导电,但是CO2属于共价化合物,且也不是电解质,A错误;MgCl2属于离子化合物,不含共价键,只含离子键,B错误;NH3中H元素位于第一周期,最外层最多2个电子,C错误;H2S和CO2均为共价化合物,均含极性共价键,D正确。
12.(2023重庆沙坪坝重庆一中高一期末)反应3Cl2+8NH3=N2+8NH4Cl常用于检验运输氯气的管道是否发生泄漏。下列表示反应中相关微粒的化学用语正确的是
A.中子数为18的氯原子:Cl
B.用电子式表示氨气分子的形成过程:
C.N2的结构式:N=N
D.NH4Cl中有离子键和非极性键
【答案】B
【解析】质量数=质子数+中子数,故中子数为18的氯原子的质量数为17+18=35,故表示为,A错误;氨气为共价化合物,氮原子和氢原子共用1对电子对,用电子式表示氨气分子的形成过程:,B正确;氮气中N原子间为三键,故其结构式为N≡N,C错误;NH4Cl中铵根离子与氯离子之间形成离子键,N和H原子形成极性共价键,D错误。
13.(2023天津南开第九中学高一期末)下列物质中,含有非极性键的是
A.Na2O B.HCl C.CH4 D.
【答案】D
【解析】Na2O中钠离子和氧离子之间以离子键结合,不存在非极性键,A错误;HCl中氢原子和氯原子之间以极性共价键结合,B错误;CH4中氢原子和碳原子之间以极性共价键结合,故C错误;氮气分子中氮原子和氮原子之间以非极性共价键结合,D正确。
14.(2023湖北武汉高一期末)2022年5月,人类首次利用月球土壤成功种活了植物,未来的宇航员们有可能在月球上种植食物,月壤中所含短周期主族元素X、Y、Z、W的原子序数依次增大,X、Y、W的原子核外最外层电子数为互不相等的偶数,X原子的最外层电子数是其内层电子总数的3倍,W元素在地壳中的含量位居第二,常见元素乙的单质是目前使用量最大的主族金属元素,下列叙述正确的是
A.原子半径大小顺序:
B.Y、Z、W的最高价氧化物的水化物均显碱性,且碱性逐渐减弱
C.元素W和X的简单氢化物的沸点:X
【答案】D
【解析】X原子的最外层电子数是其内层电子总数的3倍,所以X为O元素,W元素在地壳中的含量位居第二,所以W为Si,元素Z的单质是目前使用量最大的主族金属元素,Z为Al,X、Y、W的原子核外最外层电子数为互不相等的偶数,X最外层电子数为6,W最外层电子数为4,所以Y为主族元素,且原子序数介于X与Z之间,所以Y最外层电子数为2,Y为Mg,综上,X为O,Y为Mg,Z为Al,W为Si。一般电子层数多,半径大,同周期,从左到右原子半径依次减小,所以Y>Z>W>X,A错误;Y、Z、W的最高价氧化物的水化物即Mg(OH)2、Al(OH)3、H2SiO3,Mg(OH)2显碱性,Al(OH)3为两性氢氧化物,H2SiO3显酸性,B错误;由分析可知,W为Si、X为O,由于H2O分子间能够形成分子间氢键,而SiH4不能,故元素W和X的简单氢化物的沸点:X>W,C错误;由分析可知,X为O,Y为Mg,Z为Al,W为Si,则元素X与Y、Z、W形成的二元化合物分别为:MgO、Al2O3、SiO2,故它们的化学键依次为离子键、离子键、共价键,D正确。
15.(2023天津南开中学高一期末)短周期主族元素W、X、Y、Z、Q原子序数依次增大,W原子没有中子,X元素为地壳中含量最多的元素,Y、Z、Q同周期,且Y、Z、Q最外层电子数之和为14,Y与W同主族,下列结论不正确的是
A.原子半径大小顺序为:Y>Z>Q>X>W
B.X、Y形成的化合物中一定有离子键,可能有共价键
C.简单氢化物的稳定性:X>Z
D.氧化物对应的水化物酸性:Z<Q
【答案】D
【解析】W、X、Y、Z、Q,W原子没有中子,所以W时H元素,X元素为地壳中含量最多的元素,所以X为O元素,Y、Z、Q同周期,且Y、Z、Q最外层电子数之和为14,Y与W同主族,所以Y为Na,Z为S元素,Q为Cl元素。Y、Z、Q同周期,则原子半径Y>Z>Q,再根据第三周期>第二周期>第一周期,原子半径大小顺序为Y>Z>Q>X>W,A正确;O、Na可以形成化合物Na2O,Na2O2,Na2O中只含有离子键,Na2O2中既含有离子键又含有共价键,故一定有离子键,可能有共价键,B正确;非金属性越强,氢化物越稳定,非金属性:O>S,简单氢化物的稳定性:H2O>H2S,C正确;S和Cl的最高价氧化物对应的水化物的酸性与非金属性一致,不是最高价氧化物对应水化物的酸性没有这样的规律,D错误。
16.(2023广东广州第一中学高一期末)W、X、Y、Z、M为原子序数依次增大的短周期主族元素,其原子半径和最外层电子数的关系如图所示。下列说法正确的是
A.简单离子半径:
B.简单氢化物的稳定性:
C.与的化学键类型完全相同
D.最高价氧化物对应水化物的碱性:
【答案】A
【解析】W、X、Y、Z、M为原子序数依次增大的短周期主族元素,W和Y的最外层电子数均为1,则W为H,Y为Na;Z的最外层为3,原子半径比Na略小,应为第三周期的Al;M和X的最外层电子数均为6,根据原子半径大小关系及原子序数可知,X为O,M为S。根据上述分析可知,W、X、Y、Z、M分别为H、O、Na、Al、S,则电子层数相同时,核电荷数越大,简单离子半径越小,则简单离子半径:O2->Na+>Al3+,A正确;元素非金属性越强,简单氢化物的稳定性越强,非金属性:O>S,则稳定性:H2O>H2S,即X>M,B错误;H2O2分子存在极性共价键和非极性共价键,而Na2O2存在离子键和非极性共价键,二者的化学键类型不相同,C错误;元素金属性越强,其最高价氧化物对应水化物的碱性越强,则碱性:NaOH>Al(OH)3,D错误。
17.(2023重庆沙坪坝重庆一中高一期末)X、Y、Z、W、R属于短周期主族元素,X的原子半径在短周期主族元素中最大,Y元素位于元素周期表的第二周期,Y元素原子的最外层电子数为m,次外层电子数为n,Z元素原子的L层电子数为m+n,M层电子数为m-n,W元素与Z元素同主族,R元素原子与Y元素原子的核外电子数之比为2∶1。下列叙述不正确的是
A.WY2、RY2都属于共价化合物
B.X、Z、W、Y原子半径依次减小
C.X与Y形成的两种化合物中阳、阴离子的个数比均为2∶1
D.Z、W、R最高价氧化物对应水化物的酸性由强到弱的顺序是R>Z>W
【答案】D
【解析】X、Y、Z、W、R属于短周期主族元素,其中X的原子半径是短周期主族元素中最大的,则X为Na;Y元素位于元素周期表的第二周期,Y元素原子的最外层电子数为m,次外层电子数为n,则n=2,Z元素的原子L层电子数为 m+n,M层电子数为 m-n,则m+n=8,则m=8-2=6,故Y为O元素,Z的M层电子数为6-2=4,故Z为Si元素;W元素与Z元素同主族,则W为C元素;R元素原子与Y元素原子的核外电子数之比为2:1,Y的核外电子数为8,R的核外电子数为16,则R为S元素。X为Na、Y为O、Z为Si、W为C、R为S;由分析可知,Y为O、W为C、R为S ,CO2、SO2都属于共价化合物,A正确;由分析可知,X为Na、Z为Si、R为S 、Y为O,根据电子层数越多半径越大,电子层数相同,核电荷数越大半径越小,X、Z、W、Y原子半径依次减小,B正确;X与Y形成的两种化合物分别为Na2O、Na2O2,两种化合物中阳、阴离子的个数比均为2:1,C正确;非金属性:S>C>Si,元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强,故酸性:硫酸>碳酸>硅酸即R>W>Z,D错误。
18.(2023广东广州实验中学高一期末)科学家合成的一种化合物是很多表面涂层的重要成分,其结构如图所示,其中W、X、Y、Z为原子序数依次增大的短周期主族元素,只有X、Y在同一周期。下列说法错误的是
A.原子半径:X>Y
B.Y与W形成的所有化合物仅含有极性共价键
C.W、X、Y形成的某种化合物可使澄清石灰水变浑浊
D.作为一种高效安全绿色杀菌剂,在自来水消毒等方面应用广泛
【答案】B
【解析】W、X、Y、Z均为短周期主族元素,且只与X、Y在同一周期,则根据元素周期表的结构,可知X、Y为第二周期元素,则W为H元素;如图,X连4根键,Y连2根键,Z连1根键且为第三周期元素,为Cl元素,X为C元素,Y为O元素。X为C元素,Y为O元素,同周期元素原子半径从左到右依次减小,同主族元素原子半径从上到下依次增大,所有原子半径:C>O,A正确;W为H元素,Y为O元素,其形成的化合物有H2O、H2O2,其中H2O2中存在极性键H-O和非极性键O_O,B错误;W为H元素,X为C元素,Y为O元素,其形成的化合物H2C2O4能与石灰水反应生成草酸钙和水,使澄清石灰水变浑浊,C正确;Z为Cl元素,Y为O元素,其化合物ClO2具有强氧化性,作为一种高效安全绿色杀菌剂,在自来水消毒等方面应用广泛,D正确。
19.(2023广东广州第一中学高一期末)W、X、Y、Z是原子序数依次增大的短周期主族元素,W、X、Z组成的一种化合物与蒸馏水按体积比3∶1混合后可用于杀灭新型冠状病毒,Y的一种单质在空气中含量最高。下列有关说法正确的是
A.简单离子的半径:
B.简单氢化物的稳定性:
C.最高价氧化物对应水化物的酸性:
D.W、Y、Z既能形成共价化合物又能形成离子化合物
【答案】D
【解析】Y的一种单质在空气中含量最高,Y为N;W、X、Z组成的一种化合物与蒸馏水按体积比3∶1混合后可用于杀灭新型冠状病毒,化合物为乙醇,则W、X、Z分别为H、C、O,因此W、X、Y、Z分别为H、C、N、O。简单离子半径:N3->O2-,选项A错误;
B.非金属性越强简单气态氢化物的稳定性越强,则简单氢化物的稳定性:H2O>NH3>CH4,B错误;最高价氧化物对应水化物的酸性:HNO3>H2CO3,C错误;H、N、O能形成共价化合物HNO3、离子化合物NH4NO3,D正确。
20.(2023春·福建莆田·高一校考期中)下列物质中,既有离子键,又有共价键的是
A.Ca(OH)2B.NaClC.H2OD.CH4
【答案】A
【解析】A.Ca(OH)2中钙离子和氢氧根离子之间是离子键,氢原子和氧原子之间是共价键,A正确;
B.NaCl只含有离子键,B错误;
C.H2O中只含共价键,C错误;
D.CH4中只含有共价键,D错误;
故选A。
21.(2023春·福建莆田·高一校考期中)关于化学键的叙述中,下列说法正确的是
A.化学键存在于相邻原子之间,也存在于相邻分子之间
B.共价化合物中一定含有共价键,离子化合物中可能含有共价键
C.阴、阳离子间通过静电引力所形成的化学键是离子键
D.由非金属元素形成的化合物中一定只含共价键
【答案】B
【解析】A.化学键存在于相邻原子之间,不存在于相邻分子之间,A错误;
B.只存在共价键的化合物是共价化合物,所以共价化合物中一定含有共价键,存在离子键的化合物是离子化合物,所以离子化合物中可能含有共价键,B正确;
C.阴、阳离子间通过静电作用所形成的化学键是离子键,C错误;
D.非金属元素的原子之间可能形成离子键,如氯化铵中铵根离子与氯离子间存在离子键,D错误;
故选B。
22.(2023春·贵州遵义·高一校联考期中)三氟化硼的电子式为
A. B.
C. D.
【答案】C
【解析】A.为其结构式,故A不符合题意;
B. 为其空间结构模型,故B
C. 是三氟化硼的电子式,故C符合题意
D.为的形成过程,故D不符合题意。
综上所述,答案为C。
23.(2023春·福建厦门·高一厦门一中校考期中)下列有关化学基本概念的判断依据正确的是
A.氧化还原反应:元素化合价是否变化
B.共价化合物:是否含有共价键
C.离子化合物:熔化状态是否能导电
D.金属单质:固体是否能够导电
【答案】A
【解析】A.根据元素化合价是否变化判断是否为氧化还原反应,若化合价变化,则为氧化还原反应,故A正确;
B.共价化合物主要根据化合物中是否有离子键,若没有离子键的化合物就是共价化合物,故B错误;
C.离子化合物主要根据化合物中是否含有离子键,故C错误;
D.石墨能导电,因此不能通过固体是否能够导电来判断是否为金属单质,故D错误。
综上所述,答案为A。
24.(2023春·江苏连云港·高一统考期中)反应Cl2+Na2SO3+H2O=Na2SO4+2HCl可用于污水脱氯。下列说法正确的是
A.中子数为20的氯原子:B.H2O的空间构型为V形
C.Na+的结构示意图: D.HCl的电子式:
【答案】B
【解析】A.中子数为20的氯原子,质量数为37,其符号:,故A错误;
B.H2O中氧和氢原子不是直线形结构,其空间构型为V形,故B正确;
C.Na+的核外电子有10个,其结构示意图: ,故C错误;
D.HCl是共价化合物,其电子式: ,故D错误。
综上所述,答案为B。
25.(2023春·福建宁德·高一校联考期中)短周期主族元素A、C、D、E、F和G原子序数依次递增,其中A的原子半径最小,C是空气中含量最多的元素,D是地壳中含量最多的元素,E、F和G同周期,E在该周期中原子半径最大,F的单质中有一种是淡黄色的固体。下列说法错误的是
A.原子半径:E>F>G>C>D>A
B.氧化物对应的水化物酸性:F
D.A与E形成的化合物电子式为
【答案】B
【分析】短周期主族元素A、C、D、E、F和G原子序数依次递增,其中A的原子半径最小,则A为H,C是空气中含量最多的元素,则C为N,D是地壳中含量最多的元素,则D为O,E、F和G同周期,E在该周期中原子半径最大,则E为Na,F的单质中有一种是淡黄色的固体,则F为S,G为Cl。
【解析】A.根据层多径大,同电子层结构核多径小,则原子半径:E>F>G>C>D>A,故A正确;
B.氧化物对应的水化物酸性不一定是F<G,比如硫酸酸性大于次氯酸酸性,若是最高价氧化物对应的水化物酸性,则有F<G,故B错误;
C.D与E形成氧化钠或过氧化钠,E与G形成氯化钠,都为离子化合物,故C正确;
D.A与E形成的化合物NaH,NaH是离子化合物,其电子式为,故D正确。
综上所述,答案为B。
26.(2023春·福建南平·高一统考期中)下表物质与其所含化学键类型、所属化合物类型完全正确的一组是
A.AB.BC.CD.D
【答案】B
【解析】A.氯化镁中只含有氯离子和镁离子形成的离子键,故A错误;
B.CO2只含碳原子和氧原子形成的共价键,属于共价化合物,故B正确;
C.NH4Cl中只铵根和氯离子间形成离子键,铵根内氢原子和氮原子形成的共价键,属于离子化合物,故C错误;
D.NaOH中除含有离子键外,还含有氧原子和氢原子形成的共价键,故D错误;
综上所述答案为B。
27.(2023秋·陕西西安·高一校联考期末)Ⅰ.已知有下列物质:①HNO3;②硫单质;③NaOH;④液氦;⑤Na2O2;⑥H2O2;⑦CCl4;⑧NH4Cl;⑨KBr;⑩O2,分别将正确的序号填入相应的位置。
(1)以上物质中只含有离子键的是___________;
(2)只含有共价键的是___________;
(3)既含有离子键又含有极性共价键的是___________;其电子式分别为___________、___________;
(4)含有非极性共价键的化合物是___________;
(5)不含化学键的是___________。
Ⅱ.下表为元素周期表的一部分。
请回答下列问题:
(6)⑦⑧⑨三种元素最高价氧化物对应的水化物中酸性最强的是___________(填化学式)。
(7)③⑥⑨三种元素的简单离子半径由大到小排序为___________(填离子符号);
(8)元素④和⑥最高价氧化物对应的水化物反应的离子方程式为___________;
(9)从原子结构的角度分析④与⑤的金属性强弱:___________。
(10)②、⑦的气态氢化物中较稳定的是___________(填化学式),判断依据是___________
【答案】
(1)⑨
(2)②⑥⑦⑩
(3) ③、⑧
(4)⑤⑥
(5)④
(6)HClO4
(7)Cl->O2->Al3+
(8)Al(OH)3+OH-=AOeq \\al(-,2)+2H2O
(9)钠原子半径大于镁,钠原子更容易失去最外层电子的1个电子
(10) NH3 同主族由上而下,金属性增强,非金属性逐渐减弱;非金属性越强,其简单氢化物稳定性越强
【分析】①HNO3为共价化合价,只含共价键;②硫单质是只含共价键的单质;③NaOH中钠离子和氢氧根离子间存在离子键,氢氧根中存在氢氧共价键;④液氦是氮原子分子,不存在共价键;⑤Na2O2是由钠离子和过氧根离子构成的,过氧根离子中存在氧氧共价键;⑥H2O2是氢氧构成共价化合物,过氧根中存在氧氧共价键,只存在共价键;⑦CCl4是含有碳氯极性共价键的共价化合物;⑧NH4Cl是由铵根离子和氯离子构成的,铵根离子中存在氮氢共价键;⑨KBr是由钾离子和溴离子构成的;⑩O2是只含氧氧非极性共价键的单质;
由图可知,①-⑨分别为碳、氮、氧、钠、镁、铝、磷、硫、氯元素;
【解析】(1)由分析可知,以上物质中只含有离子键的是⑨;
(2)由分析可知,只含有共价键的是②⑥⑦⑩;
(3)由分析可知,既含有离子键又含有极性共价键的是③、⑧,其电子式分别为 、 ;
(4)由分析可知,含有非极性共价键的化合物是⑤⑥;
(5)由分析可知,不含化学键的是④;
(6)同周期从左到右,金属性减弱,非金属性变强,非金属性越强,最高价氧化物对应水化物的酸性越强,⑦⑧⑨三种元素最高价氧化物对应的水化物中酸性最强的是HClO4;
(7)电子层数越多半径越大,电子层数相同时,核电荷数越大,半径越小;③⑥⑨三种元素的简单离子半径由大到小排序为Cl->O2->Al3+;
(8)元素④和⑥最高价氧化物对应的水化物分别为氢氧化钠、氢氧化铝,反应生成偏铝酸根离子和水,离子方程式为Al(OH)3+OH-=AOeq \\al(-,2)+2H2O;
(9)钠原子半径大于镁,钠原子更容易失去最外层电子的1个电子,故其金属性大于镁;
(10)同主族由上而下,金属性增强,非金属性逐渐减弱;非金属性越强,其简单氢化物稳定性越强,②、⑦的气态氢化物中较稳定的是NH3。
28.(2023海南省枫叶国际学校高一期中)A、B、C、D均是短周期元素,A和B同周期,B和C同族,A元素族序数是周期数的三倍,B原子最外层电子数是内层电子数的二倍,B与A能生成化合物BA2,C与A生成化合物CA2, A的阴离子与D的阳离子电子层结构相同,都与氖原子的电子层结构相同,D 的单质与A 的单质在不同条件下反应,可生成D2A或D2A2。请回答
(1)写出元素符号B:________C:________
(2)BA2的电子式____________,BA2分子中化学键属于________键.。
(3)D2A2的化学式___________.
(4)C在元素周期表中的位置是第_______周期,______族,其原子结构示意图为__________
【答案】(1)C Si (2) 共价 (3)Na2O2 (4)三 ⅣA
【解析】A、B、C、D均是短周期元素,A元素族序数是周期数的三倍,A只能处于第二周期,族序数为Ⅵ,故A为O元素;A和B同周期,B原子最外层电子数是内层电子数的二倍,最外层电子数为4,则B为C元素;B和C同族,则C为Si;A的阴离子与D的阳离子电子层结构相同,都与氖原子的电子层结构相同,D的单质与A的单质在不同条件下反应,可生成D2A或D2A2,则D为Na。(1)由上述分析可知,B为C元素,C为Si元素。
(2)CO2分子中碳原子与氧原子之间形成2对共用电子对,电子式为,CO2分子中化学键属于共价键。(3)D为Na元素,A为O元素,D2A2的化学式为Na2O2。
(4)C为Si,在元素周期表中的位置是第三周期ⅣA族,其原子结构示意图为。
29.(2023重庆九龙坡重庆实验外国语学校高一期末)I.现有下列十种物质:①液态氯化氢;②小苏打;③固体纯碱;④氨气;⑤葡萄糖;⑥氯化镁;⑦;⑧氯水;⑨;⑩硫酸铁溶液。
(1)上述十种物质中,属于电解质的有_______,属于非电解质的有_______。
(2)④的电子式为_______。
(3)用电子式表示⑥的形成过程_______。
(4)除去③中少量②的相应化学方程式为_______。
(5)⑦中含有的化学键为_______。
II.写出下列反应的离子方程式(已知还原性:):
(6)向溶液中通入少量(与的微粒数的比值)_______;
(7)向溶液中通入,与的化学计量数之比为1∶l∶_______。
【答案】
(1)①②③⑥⑦⑨ ④⑤
(2)
(3)
(4)2NaHCO3Na2CO3+H2O+CO2↑
(5)离子键、共价键
(6)Cl2+2Fe2+=2Cl-+2Fe3+
(7)2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl-
【解析】(1)1)①液态氯化氢溶于水形成的水溶液能导电,是电解质;
②小苏打是NaHCO3,在水溶液或熔融状态下都能导电,是电解质;
③固体纯碱是Na2CO3,在水溶液或熔融状态下都能够导电,是电解质;
④氨气在水溶液中与水反应生成一水合氨,能够导电,但导电的离子不是氨气自身电离的,是非电解质;
⑤葡萄糖在熔融状态和水溶液中都不能导电,是非电解质;;
⑥氯化镁在水溶液或熔融状态下都能够导电,是电解质;
⑦Na2O2在熔融状态下能导电,属于电解质;
⑧氯水属于混合物,既不是电解质也不是非电解质;
⑨NaHSO4在水溶液和熔融状态下都能导电,属于电解质;
⑩硫酸铁溶液属于混合物,既不是电解质也不是非电解质;
综上所述,属于电解质的有①②③⑥⑦⑨,属于非电解质的有④⑤;
(2)氨气是共价化合物,N别与3个H共用3对电子,电子式为;
(3)⑥为MgCl2,属于离子化合物,Cl得到Mg的电子形成,形成过程为;
(4)NaHCO3受热易分解,因此除去Na2CO3中的NaHCO3,可使用加热的方法,方程式为2NaHCO3Na2CO3+H2O+CO2↑;
(5)Na2O2中Na+和之间为离子键,中O与O之间为非极性共价键;
(6)向FeBr2溶液中通入少量Cl2(Fe2+与Cl2的微粒数的比值≥2),只有Fe2+被氧化,反应的离子方程式为Cl2+2Fe2+=2Cl-+2Fe3+;
(7)还原性Fe2+>Br->Cl-,FeBr2与Cl2的化学计量数之比为1::1,假设FeBr2和Cl2均为1ml,根据得失电子守恒可知,1ml Fe2+、1ml Br-被氧化,反应的离子方程式为Fe2++Br-+Cl2=Fe3++Br2+2Cl-,化简可得2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl-。
30.(2023河北邢台一中高一期末)下表列出了a~h八种元素在周期表中的位置
(1)h元素在周期表中的位置是___________。
(2)元素c、f、g的简单离子半径从大到小的顺序:___________(填写离子符号)。
(3)e的离子结构示意图为___________。
(4)写出f、g的最高价氧化物的水化物反应的化学方程式___________。
(5)写出由a、c、e三种元素组成的化合物的电子式___________;
(6)a、c组成的一种化合物既能用作实验室制备氧气,也能用作绿色的氧化剂和还原剂,请用电子式表示该化合物的形成过程______________,该化合物能使酸性高锰酸钾溶液褪色同时有无色气体生成,写出该反应的离子方程式:________________。
【答案】
(1)第三周期0族
(2)
(3)
(4)
(5)
(6)
【解析】根据元素在周期表中的位置,a是H元素、b是C元素、c是O元素、d是Na元素、e是Mg元素、f是Al元素、g是Cl元素、h是Ar元素;
【解析】(1)h是Ar元素,在周期表中的位置是第三周期0族;
(2)电子层数越多半径越大,电子层数相同时,质子数越多半径越小,离子半径从大到小的顺序;
(3)是Mg元素,Mg2+核外有10个电子,离子结构示意图为;
(4)Al、Cl的最高价氧化物的水化物分别是Al(OH)3、HClO4,反应的化学方程式;
(5)由H、O、Na三种元素组成的化合物是NaOH,NaOH是离子化合物,电子式为;
(6)、组成的一种化合物既能用作实验室制备氧气,也能用作绿色的氧化剂和还原剂,该化合物是H2O2,用电子式表示该化合物的形成过程,H2O2被酸性高锰酸钾氧化为氧气,反应的离子方程式为。
31.(2023吉林长春东北师大附中高一期末)回答下列问题:
(1)下列变化:①升华;②烧碱熔化;③溶于水;④溶于水;⑤溶于水;⑥受热分解。其中仅共价键被破坏的是_______;(填序号,下同)仅离子键被破坏的是_______;
(2)在下列物质中:①、②、③、④、⑤、⑥、⑦、⑧、⑨、⑩(用物质前序号填空)。其中只存在非极性键的分子是_______;既存在离子键又存在极性键的是_______
(3)写出下列物质的电子式。
①_______②_______
(4)用电子式表示下列物质的形成过程。
①_______②_______
【答案】(1)④ ②③
(2)② ⑥⑦
(3)
(4)
【解析】(1)①I2升华破坏的是分子间作用力,与分子内的化学键无关;
②烧碱熔化断裂离子键变为自由移动的Na+、OH-,与共价键无关;
③NaCl是离子化合物,其溶于水时,断裂离子键变为自由移动的Na+、Cl-,没有断裂共价键;
④HCl溶于水时,在水分子作用下断裂共价键,变为自由移动的H+、Cl-,没有断裂离子键;
⑤O2溶于水时,破坏的是分子间作用力,与分子内的化学键无关;
⑥NH4HCO3受热分解变为NH3、H2O、CO2,断裂的是离子键、共价键。因此其中仅发生共价键破坏的是④;仅发生离子键破坏的是②③;
(2)①在HCl分子中仅存在极性共价键;
②在N2分子中仅存在非极性共价键;
③中NH3分子中仅存在极性共价键;
④Na2O2是离子化合物,在Na2O2中存在离子键和非极性共价键;
⑤H2O2是共价化合物,在该物质分子中含有极性共价键、非极性共价键;
⑥NH4Cl是离子化合物,其中含有离子键和极性共价键;
⑦NaOH是离子化合物,其中含有离子键和极性共价键;
⑧Ar是由分子构成的物质,物质分子是单原子分子,不存在化学键;
⑨CO2是共价化合物,在该物质分子中只含有极性共价键;
⑩N2H4是由分子构成的物质,在物质分子中含有极性共价键和非极性共价键;
综上所述可知:其中只存在非极性键的分子是②N2;既存在离子键又存在极性键的是⑥NH4Cl、⑦NaOH;
(3)Na2O2是离子化合物,在Na2O2中,2个Na+与之间以离子键结合,在阴离子中,2个O原子之间以共价单键结合,故Na2O2的电子式为:;
②HClO是共价化合物,在HClO分子中,O原子与H、Cl原子分别形成1对共用电子对,使分子中的原子达到最外层2个或8个电子的稳定结构,故HClO的电子式为:;
(4)Na2S是离子化合物,2个Na原子失去最外层的1个电子变为Na+,S原子获得2个电子,使原子最外层达到8个电子的稳定结构而变为S2-,S2-与2个Na+之间以离子键结合,故用电子式表示Na2S的形成过程为:;
在H2O分子中,H原子核外只有1个电子,O原子最外层有6个电子,2个H原子的2个电子与1个O原子形成2对共用电子对,使物质分子中各个原子都达到最外层2个或8个电子的稳定结构,故用电子式表示H2O的形成过程为:。
32.(2023吉林长春吉大附中实验学校高一期末)现有下列十种物质:①液态氯化氢;②小苏打;③固体纯碱;④二氧化碳;⑤葡萄糖;⑥氯化镁;⑦;⑧氨水;⑨;⑩硫酸铁溶液。
(1)上述十种物质中,属于电解质的有___________;
(2)⑨的电子式为___________,④的结构式为___________,H2O的空间构型为___________;
(3)用电子式表示⑥的形成过程___________;
(4)除去③中少量②的方法为___________(用化学方程式表示);
(5)⑦中含有的化学键为___________。
【答案】
(1)①②③⑥⑦⑨
(2) O=C=O V形
(3)
(4)
(5)离子键和共价键
【解析】(1)①液态氯化氢是纯净物,液态氯化氢水溶液中能导电的化合物,是电解质;
②小苏打为碳酸氢钠,在水溶液中或熔融状态下能导电的化合物是电解质;
③固体纯碱为碳酸钠,在水溶液中或熔融状态下能导电的化合物是电解质;
④二氧化碳本身不能电离产生自由移动的离子,是非电解质;
⑤葡萄糖在水溶液中和熔融状态下不能导电的化合物,是非电解质;
⑥氯化镁在水溶液中或熔融状态下能导电的化合物,是电解质;
⑦是在熔融状态下能导电的化合物,是电解质;
⑧氨水是混合物,不是电解质也不是非电解质;
⑨在水溶液中或熔融状态下能导电的化合物,是电解质;
⑩硫酸铁溶液是混合物,不是电解质也不是非电解质;
所以属于电解质的有①②③⑥⑦⑨;
(2)⑨为离子化合物,钡离子和氢氧根离子形成离子键,其电子式为;④二氧化碳中C和O原子共用2对电子对,结构式为O=C=O;的结构式为H-O-H,空间构型为V形;
(3)MgCl2属于离子化合物,Mg原子最外层两个电子被两个Cl原子得到形成两个氯离子,用电子式表示⑥氯化镁的形成过程为;
(4)碳酸氢钠受热易分解,碳酸钠热稳定性较好,除去③碳酸钠中少量②碳酸氢钠的方法为加热,反应方程式为:;
(5)⑦中钠离子和过氧根离子内含有离子键,过氧根内氧原子与氧原子存在共价键,则该物质含有的化学键为离子键和共价键。
初中要求
初中不做要求。
高中要求
1. 认识构成物质的微粒之间存在相互作用,结合典型实例认识离子键和共价键的形成,建立化学键概念;
2. 能判断简单离子化合物和共价化合物中的化学键类型;
3. 认识化学键的断裂和形成是化学反应中物质变化的实质。
符号
OH_
NOeq \\al(-,3)
COeq \\al(2-,3)
SOeq \\al(2-,4)
NHeq \\al(+,4)
名称
氢氧根
硝酸根
碳酸根
硫酸根
铵根
粒子
电子式的表示方法(举例)
原子
离子
阳离子
阴离子
化合物
分子
电子式
结构式
分子结构模型
分子空间构型
H2
H—H
直线形
HCl
H—Cl
直线形
CO2
O===C===O
直线形
H2O
V形
CH4
正四面体形
X
Y
Z
W
选项
A
B
C
D
物质
化学键类型
离子键、共价键
共价键
共价键
离子键
化合物类型
离子化合物
共价化合物
共价化合物
离子化合物
ⅠA
ⅡA
ⅢA
ⅣA
ⅤA
ⅥIA
ⅦA
0
二
①
②
③
三
④
⑤
⑥
⑦
⑧
⑨
衔接点20 原子的结构与元素的性质讲义(原卷版+解析版)2024年初升高化学无忧衔接(通用版): 这是一份衔接点20 原子的结构与元素的性质讲义(原卷版+解析版)2024年初升高化学无忧衔接(通用版),文件包含衔接点20原子的结构与元素的性质原卷版docx、衔接点20原子的结构与元素的性质解析版docx等2份试卷配套教学资源,其中试卷共39页, 欢迎下载使用。
衔接点18 物质的量浓度讲义(原卷版+解析版)2024年初升高化学无忧衔接(通用版): 这是一份衔接点18 物质的量浓度讲义(原卷版+解析版)2024年初升高化学无忧衔接(通用版),文件包含衔接点18物质的量浓度原卷版docx、衔接点18物质的量浓度解析版docx等2份试卷配套教学资源,其中试卷共40页, 欢迎下载使用。
衔接点17 气体摩尔体积讲义(原卷版+解析版)2024年初升高化学无忧衔接(通用版): 这是一份衔接点17 气体摩尔体积讲义(原卷版+解析版)2024年初升高化学无忧衔接(通用版),文件包含衔接点17气体摩尔体积原卷版docx、衔接点17气体摩尔体积解析版docx等2份试卷配套教学资源,其中试卷共33页, 欢迎下载使用。












