

取代反应 (提高班) 课件 2024年化学奥林匹克竞赛
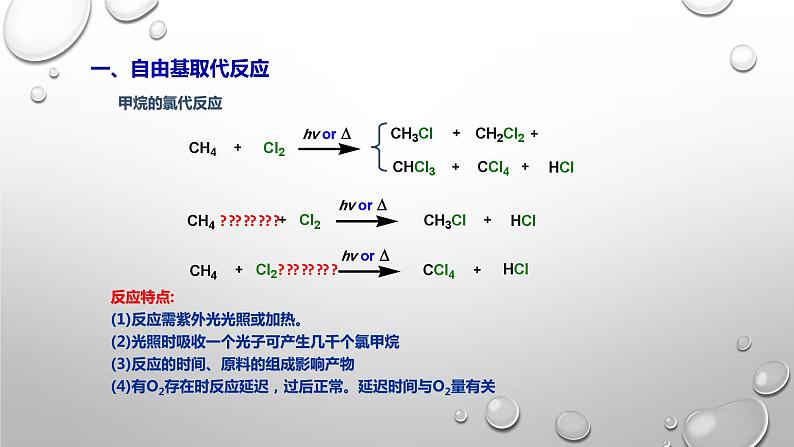
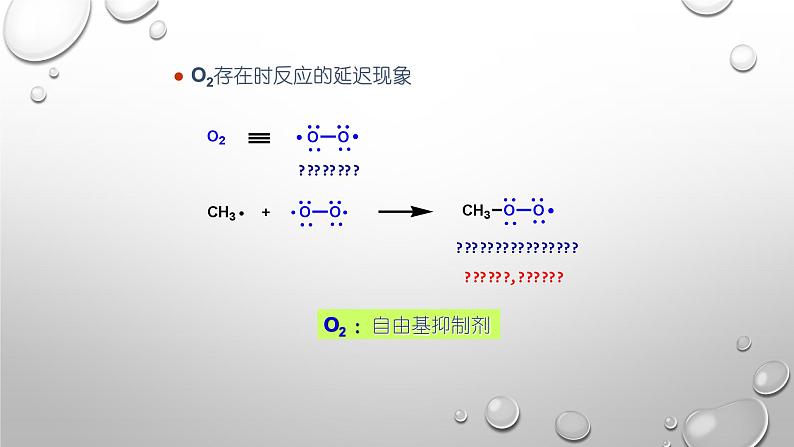
展开反应特点: (1)反应需紫外光光照或加热。(2)光照时吸收一个光子可产生几千个氯甲烷(3)反应的时间、原料的组成影响产物(4)有O2存在时反应延迟,过后正常。延迟时间与O2量有关
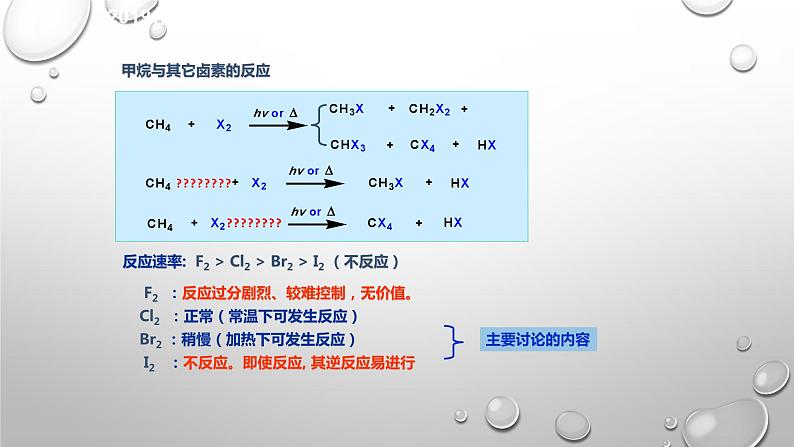
反应速率: F2 > Cl2 > Br2 > I2 (不反应)
F2 :反应过分剧烈、较难控制,无价值。Cl2 :正常(常温下可发生反应)Br2 :稍慢(加热下可发生反应) I2 :不反应。即使反应, 其逆反应易进行
甲烷的卤代反应机理(反应机制,反应历程)
什么是反应机理: 反应机理是对反应过程的详细描述,应解释以下问题:
研究反应机理的意义: 了解影响反应的各种因素,最大限度地提高反应的产率。 发现反应的一些规律,指导研究的深入。
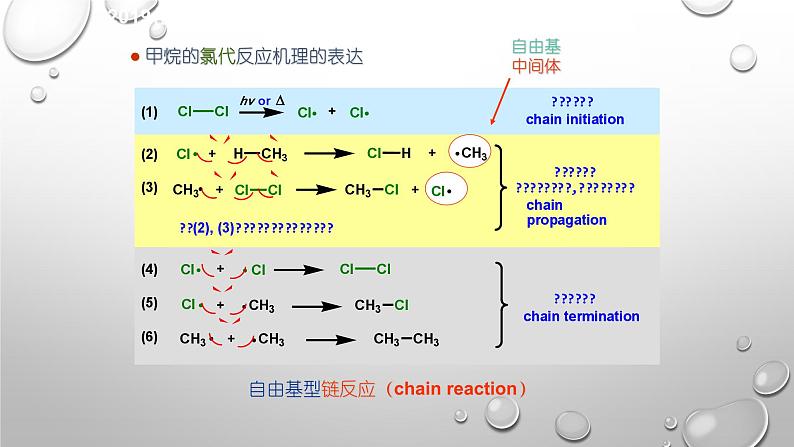
甲烷的氯代反应机理的表达
自由基型链反应(chain reactin)
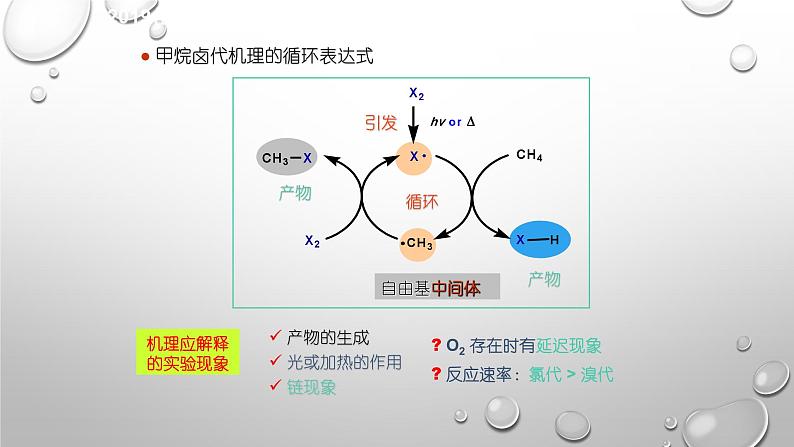
甲烷卤代机理的循环表达式
O2 存在时有延迟现象 反应速率:氯代 > 溴代
产物的生成 光或加热的作用 链现象
O2存在时反应的延迟现象
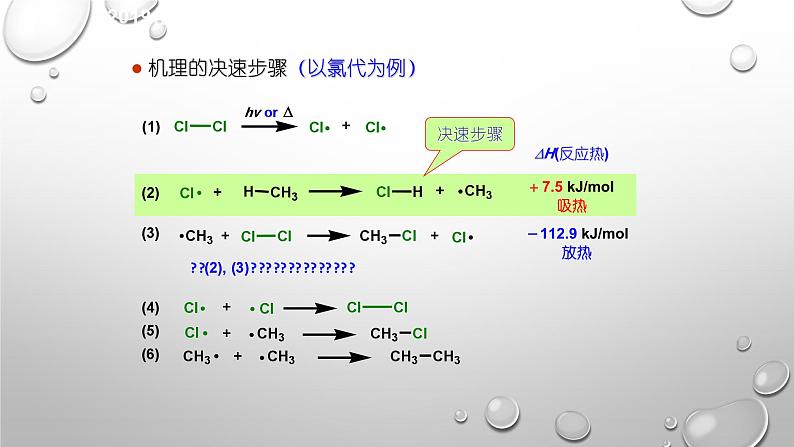
机理的决速步骤(以氯代为例)
甲烷氯代的势能变化图
过渡态: 势能最高处的原子排列
Ea:活化能( activatin energy); DH: 反应热
氯代和溴代反应速率的差别 ——决速步骤速率的差别
3 H, 2 H, 1 H:哪种氢易被取代?Cl 和 Br:哪个卤素的选择性好?
烷烃卤代反应的选择性问题
自由基的稳定性与不同类型H的反应活性
自由基生成的相对速度决定反应的选择性
自由基的相对稳定性:3 > 2 > 1
不同类型自由基的相对稳定性
-p 0 3 6 9
自由基稳定性:3° R· > 2° R· > 1° R· > CH3·
超共轭效应对自由基稳定性的影响
苯甲基自由基 烯丙基自由基 三级丁基自由基 异丙基自由基
乙基自由基 甲基自由基 苯基自由基
常见自由基的稳定性顺序
只考虑氢原子的类型, 忽略烷烃结构的影响
氯代选择性(25C):3 H : 2 H : 1 H = 5.0 : 4 : 1
溴代选择性(127C):3 H : 2 H : 1 H = 1600 : 82 : 1
总之,氯代反应反应迅速,但选择性差;溴代反应反应温和,选择性好
二、饱和碳上的亲核取代反应(SN 反应,Nuclephilic Substitutin Reactin)
底物 (substrate)
与负离子型亲核试剂的反应
与分子型亲核试剂的反应
同时充当试剂和溶剂——溶剂解反应
R-X为重要有机中间体(intermediates)
实验证据:存在两种类型的反应
2.1 亲核取代反应机理
SN1、SN2机理SN2中的2,表示双分子,即这个亲核取代反应控制反应速率一步(即慢的一步)是由两种分子控制的。SN1中的1表示单分子,即这个亲核取代反应控制反应速率一步(即慢的一步)是由一种分子控制的。
SN2机理C-X 键先解离,再与亲核试剂成键(二步机理)
反应经过碳正离子中间体。第一步应为决速步骤
SN2反应机制:SN2反应是同步过程,即亲核试剂从反应物离去基团的背面向与它连接的碳原子进攻,先与碳原子形成比较弱的键,同时离去基团与碳原子的键有一定程度的减弱,两者与碳原子成一直线形,碳原子上另外三个键逐渐由伞形转变成平面,这需要消耗能量,当反应进行和达到能量最高状态即过渡态后,亲核试剂与碳原子之间的键开始形成,碳原子与离去基团之间的键断裂,碳原子上三个键由平面向另一边偏转,释放能量,形成产物。反应的立体化学:SN2反应手性底物反应发生构型转换。
SN1机理旧键的解离与新键的形成同时进行(一步机理)
反应一步完成,不经过任何其它中间体
SN1反应机制:SN1反应是分步过程,反应物首先离解为碳正离子与带负电荷的离去基团,这个过程需要能量,是控制反应速率的一步,也是慢的一步,当分子离解后,碳正离子马上与亲核试剂结合,速率极快,是快的一步。反应的立体化学:SN1反应手性底物反应发生消旋化。
亲核取代反应机理小结
卤代烷亲核取代的两种机理: SN2 和 SN1 机理
SN2 机理:双分子取代,一步机理 反应速率 = k[RX][Nu-] 手性底物反应发生构型转换 SN1 机理:单分子取代,二步机理 反应速率 = k[RX] 手性底物反应发生消旋化
2.2 碳正离子(Carbnium in)
碳正离子:一类碳上只带有六个电子的活泼中间体
碳正离子一般无法分离得到,可通过实验方法捕获:
碳正离子的相对稳定次序:
补充:苄基和烯丙基碳正离子的相对稳定性:
烷基对碳正离子的稳定作用——(诱导)给电子效应
(通过单键传递的)诱导给电子效应
一些使碳正离子不稳定的因素
碳正离子的重排性 —— Wagner-Meerwein重排
迁移动力:生成更稳定的正碳离子
其它形式的碳正离子的重排
1, 2-CH3 迁移
溴乙烷与NaOH的反应(SN2机理)
希望通过这些例子,学习并基本掌握反应机理的表达方法
叔丁基溴在80%EtOH水溶液中的水解反应(SN1机理)
写出反应机理解释下列主要反应产物的形成
2.3 影响亲核取代反应机理和反应速率的因素
烷基结构的影响、亲核试剂的影响、溶剂极性的影响、离去基团的影响
R的结构 C-X键强度 体积 浓度
亲核能力 浓度
对亲核试剂的影响 对反应的影响
绝对的按 SN2 或 SN1 机理的例子不多,一般情况下两种机理并存,并依反应条件而改变。
C-X键强度: F >> Cl > Br > I
R 的空间位阻小α-碳正电性大C-X键易解离
生成的正碳离子稳定C-X键易解离
SN2机理与烷基的结构
空间位阻效应 电子效应
SN1机理与烷基的结构
正碳离子稳定性空助效应(消除X减少基团拥挤)
注意反应条件改变对机理的影响
新戊基SN1, SN2均慢
亲核能力、浓度与决速步骤无关
SN2速率 = k[RX][Nu]
SN1速率 = k[RX]
极性大:对极性大(电荷密度集中)体系有利。极性小:对极性小(电荷密度分散)体系有利。
电荷密度集中(极性大)
电荷密度分散(极性减小)
低极性溶剂对稳定过渡态有利
极性溶剂对稳定过渡态有利
各种影响亲核取代机理的因素总结
离去基团Leaving Grup
好离去基团的条件:是稳定的弱碱
10-2 1 50 150
其它底物的亲核取代问题
稳定的络合物好离去基团
转变为磺酸酯(常用对甲基苯磺酸酯)
苯环上的亲电取代机理通式
3.1 常见的几类苯环上的亲电取代反应
Friedel-Crafts 反应(傅-克反应)
与自由基取代反应的区别
芳环上的卤代在合成上的重要性
是芳环引入卤素(Cl、Br)的主要方法之一Ar-X是合成其它类型的化合物的重要中间体
无 H2SO4时反应很慢
浓H2SO4作用:产生NO2除去生成的水
硝化反应在合成上的重要性
制备硝基苯类化合物(炸药)
2, 4, 6-三硝基甲苯
苯胺类化合物的主要制备方法
注意:磺化反应是可逆的
苯环的磺化机理(逆向为去磺酸基机理)
磺化反应可逆性在合成上的应用
④ 苯环上的烷基化反应(Friedel-Crafts烷基化反应)
其它催化剂:SnCl4, FeCl3, ZnCl2, TiCl4, BF3等
问题:碳正离子的产生途径还有那些?
⑤ 苯环上的酰基化反应(Friedel-Crafts酰基化反应)
AlCl3用量: 用酰氯时,用量 > 1 eqv. 用酸酐时,用量 > 2 eqv.
比较:烷基化AlCl3用量为催化量
eqv. = equivalent
酮与AlCl3络合,消耗1eqv. AlCl3
消耗1eqv. AlCl3
Friedel-Crafts酰基化反应在合成中的应用
直接法不足之处:(1)有重排。 (2)易进一步取代
⑥ 芳环的氯甲基化反应和Gattermann-Kch反应
氯甲基化反应(与Friedel-Crafts烷基化类似)
Gattermann-Kch反应
与Friedel-Crafts酰基化类似
苯环上的亲电取代反应小结
问题:苯环上已有取代基时,取代在何处?
3.2 芳环上的亲电取代反应规律
取代基对反应有两方面影响——反应活性和反应取向
3.2.1 取代基对亲电取代位置的影响
3.2.2 取代基的分类
致活基团和致钝基团(考虑对反应活性及速度的影响)(activating grups and deactivating grups)
致活基团(亲电取代反应比苯快)
致钝基团(亲电取代反应比苯慢)
邻对位定位基和间位定位基(考虑对反应取向的影响)
邻对位定位基(邻对位产物为主)
间位定位基(间位产物为主)
Orth- and para-directing activatrs
Orth- and para-directing deactivatrs
Meta-directing deactivatrs
3.2.3 取代基对反应活性及定位的分析和解释
取代基的电子效应对苯环电荷密度的影响
诱导给电子(使苯环活化)
诱导吸电子(使苯环钝化)
共轭给电子效应(使苯环邻、对位活化)
例:-NH2的致活作用
例:-NO2的致钝作用
共轭吸电子效应(使苯环邻、对位钝化)
取代基的电子效应对中间体稳定性的影响
最稳定的共振式(CH3起稳定作用)
CH3 的给电子效应未起作用
-CH3(致活基团)使得邻、对、间三个位置均活化。
最稳定的共振式(满足八隅体)
中间体稳定(有四个共振式)
中间体只有三个共振式,-OR未起作用
-OR使得邻、对位活化(共轭效应)。-OR使得间位钝化(诱导吸电子效应)
-NO2使得邻、对、间三个位置均钝化,间位受到影响较小。
卤素的双重作用:邻对位致钝基
苯环钝化,反应慢。邻位受影响最大。
邻位取代(对位取代情况类似)
最稳定 (满足八隅体)
中间体只有三个共振式,不稳定
邻、对、间三个位置均钝化,对位位受到影响较小。
3.3 取代基的定位作用在合成中的应用
存在问题:(1)苯胺易被硝酸氧化(2)苯环钝化,反应难, 生成少量间位产物
优点:(1)氨基保护后不易被氧化 (2)N的碱性减弱,不与H+反应 (3)保护后为弱致活基,反应易控制
第一步不合理:(1) 直接接丙基,有重排产物(2)丙基为致活基团,易多取代
第二步反应难(为什么?)
有致钝基团,不会多取代。
Wlff-Kishner还原(碱性体系)
Clemmensen还原(酸性体系)
不被氧化(因为无a-H)
2.3 苯及其同系物的氧化和还原
芳环侧链氧化在合成上的应用——制备苯甲酸衍生物
先硝化,再氧化,符合定位取向
配位化合物(提高班) 课件 2024年化学奥林匹克竞赛: 这是一份配位化合物(提高班) 课件 2024年化学奥林匹克竞赛,共60页。PPT课件主要包含了配位化合物,磁矩的计算,化学结构异构等内容,欢迎下载使用。
化学反应速率和化学平衡(基础班)课件 2024年化学奥林匹克竞赛: 这是一份化学反应速率和化学平衡(基础班)课件 2024年化学奥林匹克竞赛,共60页。PPT课件主要包含了一化学反应速率,碰撞次数,有效碰撞次数,能量活化分子,取向有效,反应速率,反应分子数,反应级数,半衰期,基元反应的活化能等内容,欢迎下载使用。
热化学与电化学(基础班)课件 2024年化学奥林匹克竞赛: 这是一份热化学与电化学(基础班)课件 2024年化学奥林匹克竞赛,共60页。PPT课件主要包含了组织建设,热化学与电化学,交流与讨论,构成原电池的条件,原电池的改进,第三级要求电量等内容,欢迎下载使用。











