


2024山东中考化学二轮专题复习 微专题 中和反应及反应后溶液成分的探究(课件)
展开命题点1 实验原理中和反应过程中往往没有明显现象,无法确定是否发生反应或反应是否完全,因此需借助酸碱指示剂来判断反应的发生。
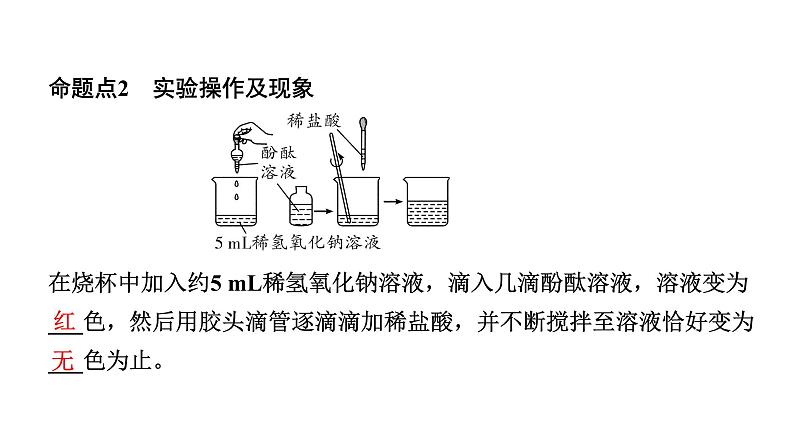
命题点2 实验操作及现象 在烧杯中加入约5 mL稀氢氧化钠溶液,滴入几滴酚酞溶液,溶液变为___色,然后用胶头滴管逐滴滴加稀盐酸,并不断搅拌至溶液恰好变为___色为止。
命题点3 实验结论及反思(1)氢氧化钠溶液能与稀盐酸发生中和反应,反应的化学方程式为____________________________。(2)在药品滴加过程中发现有气泡产生,可能的原因是____________________。(3)实验中不用紫色石蕊溶液代替无色酚酞溶液的原因是___________________________________________________。
HCl+NaOH === NaCl+H2O
氢氧化钠溶液部分变质
石蕊遇碱变蓝、遇酸变红,本身是紫色,颜色变化不明显
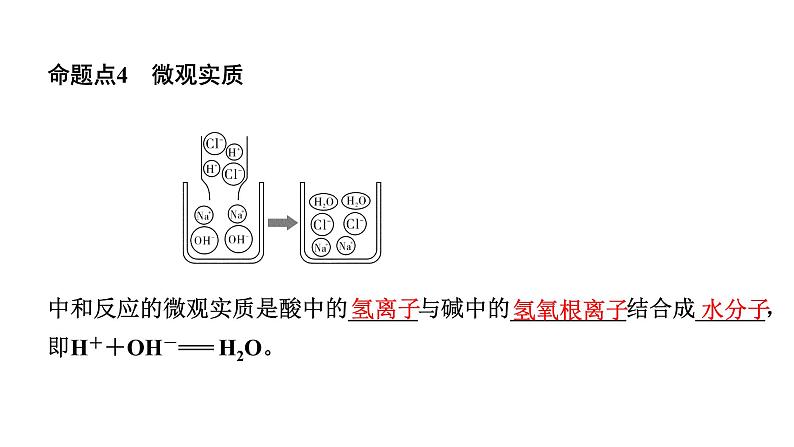
命题点4 微观实质 中和反应的微观实质是酸中的______与碱中的__________结合成______,即H++OH-=== H2O。
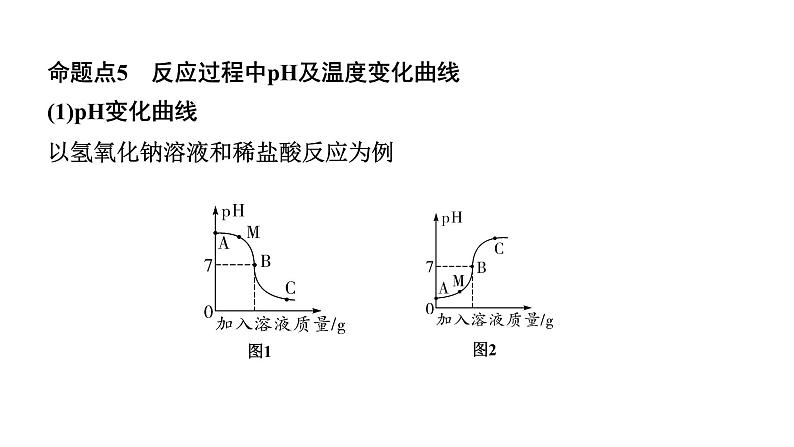
命题点5 反应过程中pH及温度变化曲线(1)pH变化曲线以氢氧化钠溶液和稀盐酸反应为例
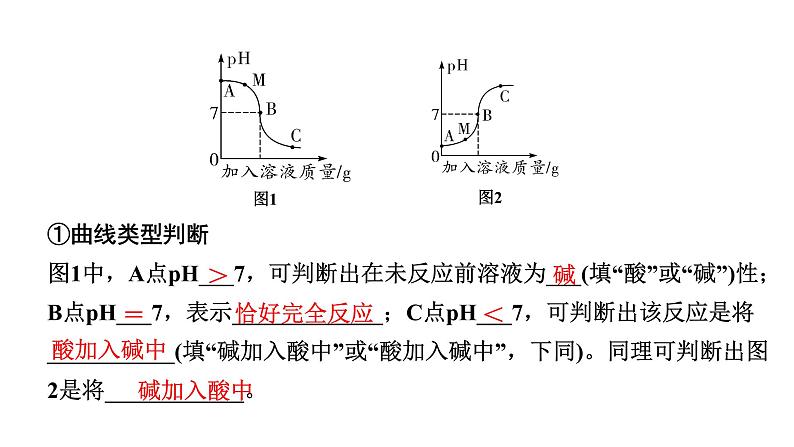
①曲线类型判断图1中,A点pH___7,可判断出在未反应前溶液为___(填“酸”或“碱”)性;B点pH___7,表示_____________;C点pH___7,可判断出该反应是将___________(填“碱加入酸中”或“酸加入碱中”,下同)。同理可判断出图2是将____________。
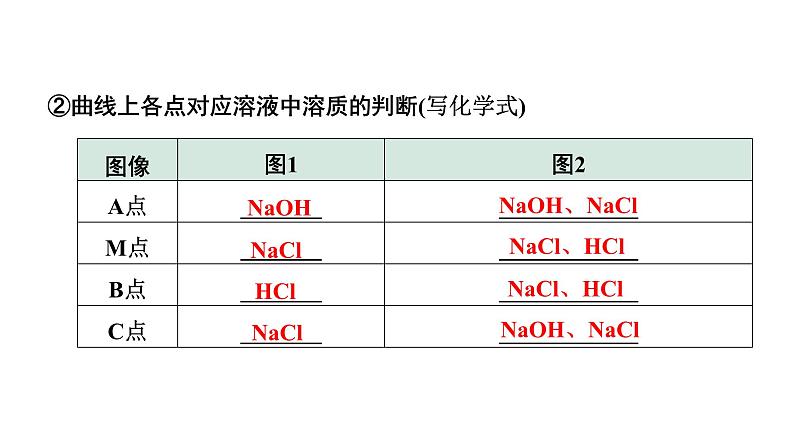
②曲线上各点对应溶液中溶质的判断(写化学式)
(2)温度变化曲线将稀盐酸慢慢滴入装有氢氧化钠溶液的烧杯中,利用温度计测出烧杯中溶液的温度随加入稀盐酸的质量变化曲线如图所示:分析:从A到B温度升高的原因是_____________,B到C 过程中溶液pH逐渐_____。B点表示_____________。该实验不能用固体氢氧化钠代替氢氧化钠溶液的原因是_______________________。
氢氧化钠固体溶于水放热
命题点6 反应后溶液成分的猜想及检验(1)提出猜想(以NaOH和HCl反应为例)第一步:写出化学方程式___________________________。第二步:进行猜想恰好完全反应:反应后溶质成分为______;NaOH过量:反应后溶质成分为_____________;HCl过量:反应后溶质成分为____________。
HCl+NaOH === NaCl+H2O
(1)猜想存在两种情况:①只有生成物;②生成物和其中一种过量的反应物。注意:作出猜想时,反应生成的沉淀、气体、水以及反应物中不溶于水的物质均排除。 (2)不合理猜想的判断: ①猜想的物质中含有反应物中未涉及的元素;②猜想的物质之间能反应。
(2)成分检验生成物不需要检验,只需要检验过量反应物①生成物对反应物的检验不造成干扰:直接检验反应物。②生成物对反应物的检验造成干扰:先排除干扰再检验反应物。
1. (2023潍坊改编)稀盐酸与氢氧化钠溶液反应时溶液pH的变化如图所示。下列说法正确的是( )A. 该反应的基本类型是中和反应B. p点所示溶液中的溶质为NaCl、NaOHC. n点表示的溶液中的微粒只有Na+和Cl-D. 向m点处加入AgNO3溶液后,有白色沉淀生成,说明m点显酸性
2. (2022德州20题5分)向NaOH溶液中滴入HCl溶液至恰好完全反应。(1)如图表示该反应前后溶液中存在的主要离子,在上面横线上写出每种图形表示的离子(填离子符号)。(2)发生反应的化学方程式是__________________________。(3)下列物质中只有一种能与KOH溶液发生上述类似反应,应是____(填序号)。①HNO3 ②CuSO4 ③CaCl2
NaOH+HCl=== NaCl+H2O
3. (2021黄石)某班同学在做“某些酸、碱、盐之间是否发生反应”的探究实验时发现,酸碱之间的反应,往往没有明显的现象。那么,如何判断酸碱发生了化学反应呢?【提出问题】如何判断酸、碱溶液发生了化学反应?【实验药品】一定质量分数的稀盐酸、一定质量分数的氢氧化钠溶液(稀)、酚酞溶液、蒸馏水
【实验探究】(1)甲小组在烧杯中加入50 mL氢氧化钠溶液,滴入几滴酚酞溶液,用滴管慢慢滴入稀盐酸,发现___________________________(填现象),证明氢氧化钠溶液与稀盐酸发生了化学反应,该反应的化学方程式为__________________________。(2)乙小组进行了以下三个实验,并用温度传感器测定实验过程中的温度变化情况,得到了如图所示的三条曲线。实验1:50 mL稀盐酸与50 mL氢氧化钠溶液混合(曲线a);实验2:50 mL稀盐酸与50 mL蒸馏水混合(曲线b);实验3:50 mL氢氧化钠溶液与50 mL蒸馏水混合(曲线c)。`
溶液先变为红色,后变为无色
结合实验目的分析,增加实验2、实验3的目的是____________________ ____________________________________________。对比三条曲线,可以得到如下结论:①氢氧化钠溶液和稀盐酸一定发生了化学反应。②酸碱中和反应是____反应(填“放热”或“吸热”)。【交流与反思】(3)甲小组认为,通过实验探究(2)得出“中和反应是放热反应”的结论不严谨,应该补充________________________实验。
盐酸、盐酸、氢氧化钠溶液稀释时也会放出少量热,作对照实验氢氧化钠
一个其他酸和碱的中和反应
4. (2023湘潭节选)我国制碱工业先驱侯德榜发明了“侯氏制碱法”,为纯碱和氮肥工业技术的发展作出了杰出的贡献。纯碱的用途非常广泛,某化学兴趣小组的同学对它产生了浓厚的兴趣,设计了如下两个实验,并对反应后试管中残留废液进行探究。
【实验1】往一支盛有碳酸钠溶液的试管中滴加无色酚酞溶液,观察到溶液变成___色。【实验2】往另一支盛有碳酸钠溶液的试管中滴加稀盐酸,观察到的现象是__________。同学们对实验2·反应后的废液中溶质成分进行探究。【提出问题】废液中所含溶质是什么?【作出猜想】猜想一:废液中的溶质可能是NaCl、HCl猜想二:废液中的溶质可能是NaCl、Na2CO3猜想三:废液中的溶质可能是_____
【设计实验】同学们为验证猜想,设计了如下实验:方案一:
Ca(OH)2+Na2CO3=== CaCO3↓+2NaOH
方案二:小明取少量废液于试管中,滴加几滴无色酚酞溶液,发现溶液不变红色,小明认为猜想一正确。【进行讨论】同学们一致认为小明的实验结论不正确,理由是________ _______________________________________________________。【进行总结】分析反应后溶液中溶质成分,除要考虑生成物外,还需考虑______________。
废液中只含氯化钠时,氯化钠溶液显中性,也不能使无色酚酞溶液变色
5. 早在战国时期,《周礼·考工记》就记载了我国劳动人民制取氢氧化钾以漂洗丝帛的工艺。大意是:先将干燥的木头烧成灰(含K2CO3),用其灰汁浸泡丝帛,再加入石灰乳即可(木头烧成灰其他成分不与石灰乳反应也不溶于水)。利用草木灰的浸出液与石灰乳混合,对反应后的混合液进行过滤即得KOH溶液,该反应的化学方程式是__________________________________。【提出问题】K2CO3溶液与石灰乳充分反应后所得溶液中含哪些溶质?
Ca(OH)2+K2CO3=== CaCO3↓+2KOH
【作出猜想】猜想Ⅰ:只含有KOH;猜想Ⅱ:含有KOH和K2CO3;猜想Ⅲ:含有KOH和Ca(OH)2;猜想Ⅳ:含有KOH、Ca(OH)2和K2CO3。无需实验验证分析就可知道猜想___(填序号) 肯定错误。【查阅资料】K2CO3溶液显碱性。
二氧化碳(或CO2)
【讨论交流】(1)大家经过讨论一致认为甲同学的实验操作不够严谨,稍作改进才能得出猜想Ⅱ错误的结论,改进为________________________。(2)还有同学提出他可以选用其他试剂,也能证明猜想Ⅲ正确。你认为他选择的试剂是__________________________________。【拓展延伸】将鲜鸭蛋浸入草木灰与石灰乳的混合物中,一段时间后就制得了皮蛋。食用皮蛋时口感发涩源于其中含有的碱性物质,可以加入适量厨房里的_____使其口味更佳。
加入足量(或过量)的稀盐酸
K2CO3溶液(或Na2CO3溶液合理即可)
6. (2021菏泽)某化学兴趣小组为验证硫酸的部分化学性质,使用氢氧化钠、碳酸钠、金属铝和另外一种不同类别的物质A进行了相关实验。(1)实验时观察到稀硫酸与A反应有蓝色溶液生成,则A物质是_____________。
(2)稀硫酸与氢氧化钠溶液反应时没有明显现象,为了证明二者发生了反应,该组同学设计了如图一所示实验,传感器测定的pH和温度随溶液质量变化的情况见图二、图三。则B溶液是_______溶液,图三中的M与图二中X、Y、Z中的___数值相等。
(3)该化学兴趣小组又做了如图所示实验:
【提出问题】②号试管中无色溶液的溶质是什么?【作出猜想】猜想一:硫酸钠猜想二:硫酸钠、硫酸猜想三:_________________【实验验证】该小组同学用试管取适量②号试管中的无色溶液,加入一种试剂后,根据产生的现象推断出了②号试管中溶质的成分,该试剂是____________。
2024山东中考化学二轮专题复习 微专题 金属与盐溶液反应后滤液、滤渣成分的判断(课件): 这是一份2024山东中考化学二轮专题复习 微专题 金属与盐溶液反应后滤液、滤渣成分的判断(课件),共19页。PPT课件主要包含了ZnFeAg,ZnNO32,FeNO32,AgNO3,ZnCuAg,CuAg等内容,欢迎下载使用。
2024宁夏中考化学二轮重点专题突破 微专题 中和反应及反应后成分的探究(课件): 这是一份2024宁夏中考化学二轮重点专题突破 微专题 中和反应及反应后成分的探究(课件),共43页。PPT课件主要包含了H+或氢离子,H2O或水分子,熟石灰,溶液变红,碱加入酸中,酸碱恰好完全反应,酸加入碱中,NaOH,NaCl,HCl等内容,欢迎下载使用。
2024宁夏中考化学二轮重点专题突破 微专题 金属与盐溶液反应后滤液、滤渣成分的判断(课件): 这是一份2024宁夏中考化学二轮重点专题突破 微专题 金属与盐溶液反应后滤液、滤渣成分的判断(课件),共19页。PPT课件主要包含了镁>锌>铜>银,CuZn,锌>铁>铜,ZnNO32,ZnFe,Ag和Fe,FeNO32,AgNO3,Zn2+,Fe2+和Ag+等内容,欢迎下载使用。












