

福建省福州市福州九县(市、区)一中2023-2024学年高一下学期7月期末考试化学试题(含答案)
展开考试日期:7月4日;完卷时间:75分钟 满分:100分
可能用到的相对原子质量:H 1 C 12 N 14 O 16 S 32 Fe 56 Cu 64
第I卷(选择题)
一、单选题(每题3分,共45分)
1. 化学与人类生产、生活、社会可持续发展密切相关,下列说法错误的是( )
A. 北京奥运会礼仪服内胆添加了第二代石墨烯发热材料,石墨烯属于新型无机非金属材料
B. 一定浓度的含氯消毒液可使病毒中的蛋白质变性
C. 锌具有还原性和导电性,所以可用作锌锰干电池的负极材料
D. 为防止中秋月饼等富脂食品因被氧化而变质,常在包装袋里放入硅胶
2. 甲酸和乙醇在浓硫酸作用下反应生成甲酸乙酯,该反应各物质的化学用语错误的是( )
A. 甲酸的结构式为: B. 乙醇的球棍模型:
C. 甲酸乙酯的结构简式:CH3COOCH3 D. H2O的电子式:
3. 以下过程没有发生化学反应的是( )
A. 石油裂解 B. 植物油皂化 C. 煤的干馏 D. 蛋白质盐析
4. 是一种常用氮肥,下列关于说法正确的是( )
A. 氯离子的结构示意图: B. 中含有个质子
C. 不宜与碱性化肥混合使用 D. 人工固氮的反应:
5. 下列关于乙醇的反应中,不涉及电子转移的是( )
A. 乙醇与乙酸反应生成乙酸乙酯 B. 乙醇使酸性溶液变绿
C. 乙醇使酸性溶液褪色 D. 乙醇与金属钠反应产生气体
6. 下列除杂方法(括号内为杂质)正确的是( )
A. 乙烷(乙烯) 通过酸性高锰酸钾溶液,洗气 B. 乙醇(水) 加新制生石灰,蒸馏
C. 乙酸乙酯(乙酸) 加饱和碳酸钠溶液,蒸馏 D. 苯(溴) 加水,振荡后静置分液
7. 以下物质间的每步转化通过一步反应能实现的是( )
A. B.
C. D.
8.下列关于有机化合物的认识中,正确的是( )
A. 分子式为C4H10O的醇共有4种
B. 淀粉、纤维素的分子式都是(C6H10O5)n,二者互为同分异构体
C. 乙酸( CH3COOH)与油酸(C17H33COOH)互为同系物
D. 包装用的材料聚乙烯和聚氯乙烯都属于烃
9. 下列离子方程式中正确的是( )
A.过量铁粉加入稀硝酸中:Fe + 4H+ + NO3-=Fe3+ + NO↑+ 2H2O
NH4HCO3溶液与过量KOH浓溶液共热: NH4++OH﹣NH3↑+H2O
用浓氯化铁溶液制作印刷电路板: 2Fe3+ + Cu = 2Fe2+ + Cu2+
向溶液中加入少量氯水:
10. 废水脱氮工艺中有一种方法是在废水中加入过量NaClO使完全转化为N2,该反应可表示为+3ClO﹣═N2+3Cl﹣+2H++3H2O。下列说法中,不正确的是( )
A.反应中氮元素被氧化,氯元素被还原
B.还原性NH4+ >Cl﹣
C.反应中每生成1ml N2,转移6ml电子
D.经此法处理过的废水可以直接排放
11.下列关于金属冶炼的说法正确的是( )
A.用电解熔融AlCl3的方法来冶炼金属铝
B.铜的湿法冶炼是将金属钠投入到溶液中,从而置换出铜
C. 通常采用CO高温还原法冶炼金属铁
D.用海水为原料制得精盐,再电解纯净的NaCl溶液可制得金属钠
12. 一种高活性有机物中间体分子结构如图:
下列有关该物质说法错误的是( )
A. 含有两种官能团 B. 1ml该有机物与足量金属Na反应可产生H2 22.4L(标况下)
C. 分子式为C10H12O2 D. 苯环上的一氯代物有4种
13. 如图所示的实验方案能达到实验目的的是 ( )
A. 图甲验证对分解反应有催化作用
B. 图乙用Cu和稀硝酸制取NO
C. 图丙是实验室制取氨气的发生装置
D. 图丁可用于收集氨气
14. 我国科学家研发了一种室温下“可呼吸”的Na-CO2二次电池。将NaClO4溶于有机溶剂作为电解质溶液,钠和负载碳纳米管的镍网分别作为电极材料,电池的总反应为3CO2+4Na=2Na2CO3+C。下列说法错误的是( )
A.放电时,ClO4-向负极移动
B.放电时,Na极发生氧化反应
C.放电时,正极反应为3CO2+4e-=2CO32-+C
D.电子从Na极经导线到Ni极,再经电解质溶液回到Na极
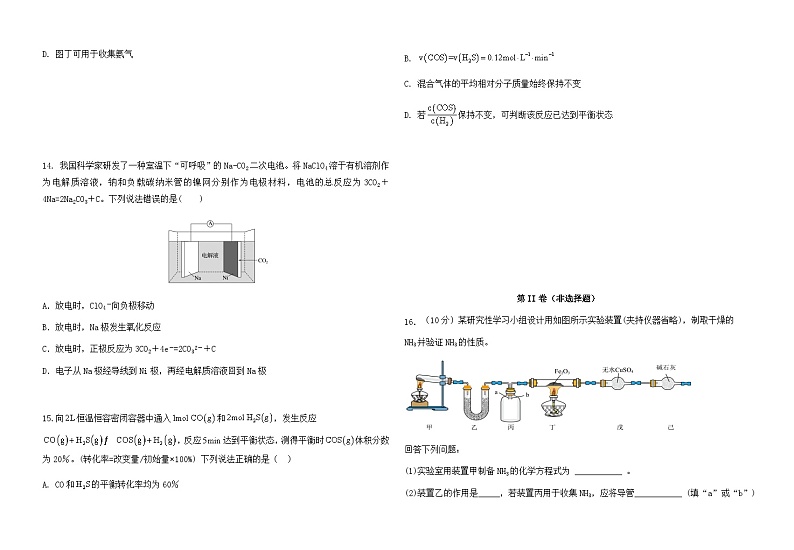
15.向恒温恒容密闭容器中通入和,发生反应,反应达到平衡状态,测得平衡时体积分数为20%。(转化率=改变量/初始量×100%) 下列说法正确的是( )
A. CO和的平衡转化率均为60%
B.
C. 混合气体的平均相对分子质量始终保持不变
D. 若保持不变,可判断该反应已达到平衡状态
第II卷(非选择题)
(10分)某研究性学习小组设计用如图所示实验装置(夹持仪器省略),制取干燥的
NH3并验证NH3的性质。
回答下列问题:
(1)实验室用装置甲制备NH3的化学方程式为 ___________ 。
(2)装置乙的作用是_____,若装置丙用于收集NH3,应将导管___________ (填“a”或“b”)延长至集气瓶底部。
(3)装置戊所用仪器的名称为 ___________。
(4)观察到丁中红色Fe2O3粉末变黑,戊中无水硫酸铜变蓝,同时收集到一种无色无味的气体,取反应后的黑色粉末加入稀盐酸,产生气泡,证明NH3具有 _________ 性,写出NH3和Fe2O3反应的化学方程式___________ 。
(5)为防止环境污染,可用以下装量(盛放的液体均为水)吸收多余NH3的是 ___ (填标号)。
a. b. c. d.
17.(11分)氮、硫的氧化物都会引起环境问题,越来越引起人们的重视。
Ⅰ.某一兴趣小组用Fe2(SO4)3溶液吸收含SO2的尾气(SO2的体积分数约为10%,其余为空气),实验装置如图所示:
(1)装置A中SO2与Fe2(SO4)3溶液反应生成FeSO4,写出该反应的离子方程式:___________ 。
(2)反应后,若要检验装置A中Fe3+是否过量,可用试剂为___________ (填化学式);若要检验SO2是否过量,可用试剂为 ___________(填名称) 。
(3)装置B中所用X溶液常为碱溶液,其作用是 ___________。
(4)若实验测得反应后的装置A中不再含有SO2,为测定其中所含FeSO4的物质的量浓度,现进行如下实验:取20.00 mL装置A中溶液,向其中逐滴加入0.100 0 ml/L Ce(SO4)2溶液,发生反应Fe2++Ce4+= Ce3++Fe3+,当反应恰好完全时,共消耗Ce(SO4)2溶液18.00 mL。则FeSO4的物质的量浓度为 ___________。
Ⅱ.工业制硝酸时尾气中含有NO、NO2,可用以下方法吸收:
(5)水吸收法。请用化学方程式说明用水吸收NO2的缺陷: ___________。
(6)工厂里常采用NaOH溶液吸收NO、NO2的混合气体,使其转化为化工产品NaNO2,试写出其离子方程式:___________ 。
18.(12分) 高分子化合物H是一种重要工业原料,其单体A不溶于水,可以发生如图变化。请回答下列问题:
(1)有机物C的分子式是___________。
(2)有机物A 中官能团的名称为___________、___________。
(3)反应①的反应类型为___________;反应⑤的反应类型为___________。
(4)反应②的化学方程式是___________。
(5)反应 = 4 \* GB3 \* MERGEFORMAT ④的化学反应方程式___________。
(6)有机物E的结构简式是___________。
(7)的某种同分异构体符合下列条件,其结构简式为___________。
①能发生银镜反应
②分子中含两个甲基
③能和金属钠反应生成氢气
(10分) 某工厂的废金属屑中主要成分为Cu、Fe和Al,此外还含有少量Al2O3和Fe2O3,为探索工业废料的再利用,某化学兴趣小组设计了如下实验流程,用该工厂的合金废料制取氯化铝、胆矾晶体(CuSO4·5H2O)和水处理剂高铁酸钾(K2FeO4)。
请回答:
(1)试剂X是___(填化学式);试剂Y是___(填化学式); 步骤Ⅰ涉及到的分离操作是_______。
(2)写出溶液A转化为固体C的离子方程式_______。
(3)在步骤Ⅱ时,若用大理石与浓盐酸制取并直接通入溶液A中,一段时间后,观察到烧杯中产生的白色沉淀会逐渐减少,可能的原因是_______(用化学方程式表示)。
(4)由溶液E制取时,不同的温度下,不同质量浓度的对生成率有以下影响,由图可知工业生产中最佳条件为_______(填温度和的质量浓度)。
(5)在固体F中加入稀硫酸和来制备溶液是一种环保工艺,该反应的总的化学方程式为_______。
(12分)研究NOX、SO2、CO等气体的无害化处理对建设生态文明有重要意义。
利用反应2NO(g)+2CO(g)⇌2CO2(g)+N2(g),可实现汽车尾气的无害化处理。一定温度下,在体积为2L的恒容密闭容器中加入等物质的量的NO和CO,测得部分物质的物质的量随时间的变化如左下图所示
①X代表的物质是______(填化学式)②从反应开始到达到平衡,______。
(2)可用电化学原理处理SO2制备硫酸,装置图如右上图,电极为多孔材料。写出N极的电极方程式_________,若电路中有2ml电子转移,理论上可制得硫酸_____g。
转化反应CO(g)+N2O(g)⇌CO2(g)+N2(g),在的催化作用下反应历程可分为:
第一步:;
第二步:+_________=________+_________(将化学方程式补充完整)
(4)已知反应CO(g)+2H2(g)⇌CH3OH(g)中相关的化学键键能数据如表:
①若有1mlCH3OH生成,该反应放出___________kJ能量。
②一定温度下,在恒容的密闭容器中充入1mlCO和2mlH2发生上述反应,对于该反应,下列说法正确的是___________(填序号)。
A.反应过程中n(CO):n(H2)不变
B.容器内混合气体的密度不再发生变化时,说明在该条件下,此反应已达到了最大的限度
C.往容器中充入He,压强增大,反应速率加快
D.容器内混合气体的压强保持不变时说明反应已达平衡
高中一年化学科评分细则
一、单选题(每题3分,共45分)
二、非选择题(共55分)
【方程式未配平、条件未写等累计扣1分;有机化学方程式未用结构简式表示不得分;不定项选择多选、错选不给分,漏选给1分】
16.(10分)
(1) (2分)
(2) 干燥NH3 (1分) b(1分) (3)球形干燥管(1分) (干燥管给1分)
(4) 还原(1分) (2分) (5)bd (2分)
17.(11分)
(1) SO2+2Fe3++2H2O =2Fe2++SO42-+4H+(2分)
(2) KSCN(1分) 品红溶液(1分)(未写“溶液”也得分)
(3)吸收未完全反应的SO2,防止污染空气 (1分) (4)0.09 ml/L (2分)
(5)3NO2+H2O =2HNO3+NO (2分)
(6) NO+NO2+2OH -= 2NO2-+H2O (2分)
18.(12分)
(1) (1分)
(2)碳碳双键 (1分) 酯基 (1分)(出现错别字不得分)
(3)取代反应(水解) (1分) 加成反应 (1分)
(4) (2分)
(5)CH3COOH + C2H5OH CH3COOC2H5 + H2O (2分)
(6)CH3CH(CH3)COOH (1分) (7) (2分)
(10分)
(1)NaOH或KOH(1分) HCl或H2SO4(1分) 过滤(1分)
(2) (2分)
(3)Al(OH)₃+3HCl==AlCl₃+3H2O (2分)
(4) 26℃,75 (1分) (5)(2分)
20.(12分)
(1)① CO2 (1分) ② 0.016 (2分)(单位没有写扣1分)
(2) (2分) 98 (1分)
(3)CO(g)、Fe+、CO2(g) (2分)(不标注状态也得分)
(4) 99 (2分) ②AD (2分)
化学键
H-H
C-O
C≡O(CO)
H-O
C-H
E(kJ·ml)
436
343
1076
465
413
题号
1
2
3
4
5
答案
D
C
D
C
A
题号
6
7
8
9
10
答案
B
B
A
C
D
题号
11
12
13
14
15
答案
C
D
B
D
C
福建省福州市闽侯县第一中学2023-2024学年高一下学期5月月考化学试题: 这是一份福建省福州市闽侯县第一中学2023-2024学年高一下学期5月月考化学试题,共4页。
福建省福州九县(区、市)一中(高中)2023-2024学年高一下学期4月期中联考化学试题(含答案): 这是一份福建省福州九县(区、市)一中(高中)2023-2024学年高一下学期4月期中联考化学试题(含答案),文件包含福建省九县一中2023-2024学年高一下学期期中考试化学试题docx、2023-2024学年度第二学期九县区市一中高中期中联考化学科评分细则pdf等2份试卷配套教学资源,其中试卷共5页, 欢迎下载使用。
福建省福州九县(区、市)一中(高中)2023-2024学年高一下学期4月期中联考化学试题: 这是一份福建省福州九县(区、市)一中(高中)2023-2024学年高一下学期4月期中联考化学试题,共8页。












