




2024沈阳中考化学二轮专题突破 专题二 实验探究题(课件)
展开
这是一份2024沈阳中考化学二轮专题突破 专题二 实验探究题(课件),共60页。PPT课件主要包含了没有固体被吸引,氧化铁和铜,方案二,H2O,吸收并完全,无水硫酸铜变蓝色,阴离子,阳离子,不溶物,有气泡产生等内容,欢迎下载使用。
类型1 控制变量和对比实验(10年3考)
1. 有如图所示的两个实验。某同学取一些实验1反应后的溶液和一些实验2反应后硬质玻璃管中的固体,将它们一同倒入容器M中,发现有明显现象产生,且最终还有固体存在。他对M中反应后的物质成分进行如下探究。
实验1:铜与硝酸银溶液反应(铜过量)
实验2:CO还原氧化铁
【提出猜想】反应后,M中剩余的固体是什么?猜想Ⅰ:Cu 猜想Ⅱ:Cu和Fe猜想Ⅲ:Cu和Fe2O3 猜想Ⅳ:______________
Cu、Fe、Fe2O3
【进行实验】进行如下实验,请完成填空。
(或Fe2O3和Cu)
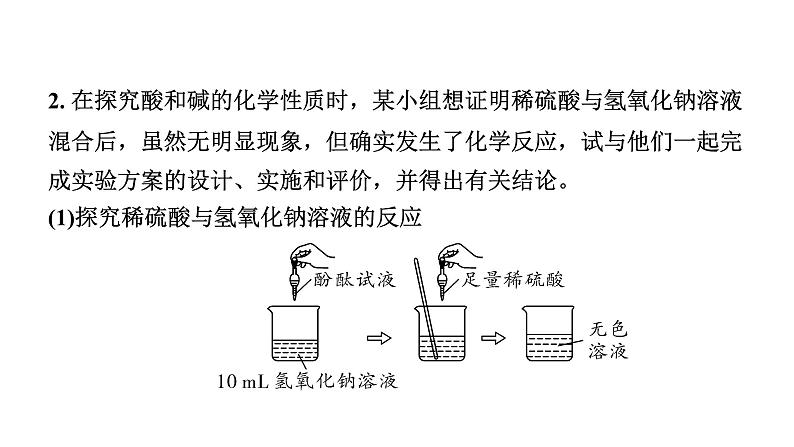
2. 在探究酸和碱的化学性质时,某小组想证明稀硫酸与氢氧化钠溶液混合后,虽然无明显现象,但确实发生了化学反应,试与他们一起完成实验方案的设计、实施和评价,并得出有关结论。(1)探究稀硫酸与氢氧化钠溶液的反应
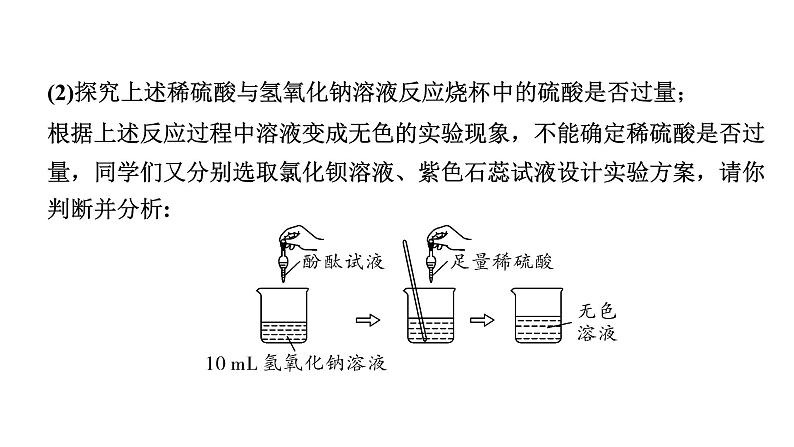
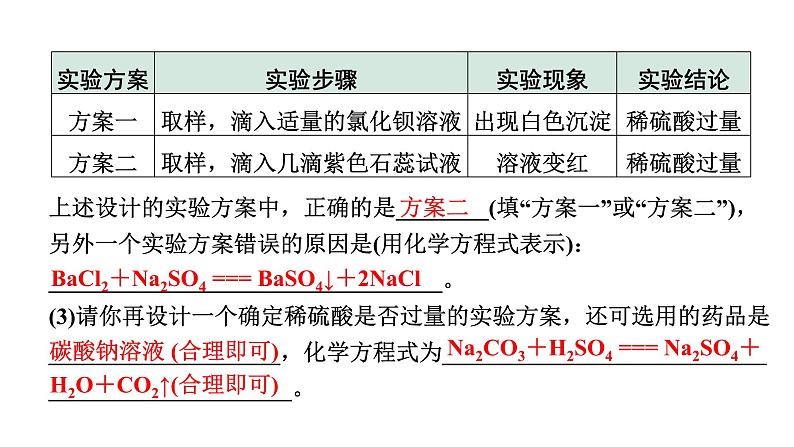
(2)探究上述稀硫酸与氢氧化钠溶液反应烧杯中的硫酸是否过量;根据上述反应过程中溶液变成无色的实验现象,不能确定稀硫酸是否过量,同学们又分别选取氯化钡溶液、紫色石蕊试液设计实验方案,请你判断并分析:
上述设计的实验方案中,正确的是________(填“方案一”或“方案二”),另外一个实验方案错误的原因是(用化学方程式表示):__________________________________。(3)请你再设计一个确定稀硫酸是否过量的实验方案,还可选用的药品是____________________,化学方程式为_________________________________________________。
BaCl2+Na2SO4 === BaSO4↓+2NaCl
碳酸钠溶液 (合理即可)
H2O+CO2↑(合理即可)
Na2CO3+H2SO4 === Na2SO4+
3. (2023黔东南)乙醇俗称酒精,燃烧时放出大量的热,因而被用作酒精灯、火锅和内燃机等的燃料,工业上常用高粱、玉米等淀粉含量较高的物质发酵生产,属于可再生资源,为解决能源危机开辟了新的道路。某化学小组的同学对乙醇燃烧的产物产生兴趣,进行了如下探究。【提出问题】乙醇燃烧生成哪些物质?【猜想与假设】猜想一:CO、H2O;猜想二:__________;猜想三:CO2、CO、H2O。
(1)先将乙醇放入盛有一定量氧气的容器中燃烧,然后将燃烧产物通入上述装置,通入装置的顺序是_____________________________________(装置可以重复选用,也可以不选)。其中选用E装置的目的是________________________________________________________。
【设计与实验】小组同学充分讨论后,决定选用下列药品和装置来验证上述猜想与假设。
BDECD(或BDEC或BDEACD或BDEAC)
除去剩余气体中的CO2,防止对CO的检验产生干扰
(2)待燃烧产物将装置内空气排尽后,再点燃C装置中的酒精灯对固体进行加热。
【现象与结论】实验中所选第一个装置观察到现象是_________________,C中红棕色粉末变成黑色,D中澄清石灰水变浑浊,由此推断猜想三成立。其中C装置内发生反应的化学方程式为____________________________。
【反思与交流】实验结束后,小组同学对实验结论进行了反思:甲同学发现含碳的化合物燃烧时,氧气充足才能避免有毒物质一氧化碳产生;乙同学发现该实验的设计中有一个明显缺陷,该缺陷是____________________________________。
缺少尾气处理装置(其他合理答案均可)
4. (2022沈阳)根据表中信息,请回答下列问题:
部分碱、酸、盐的溶解性表(℃)
说明:“溶”表示那种物质可溶于水,“不”表示不溶于水,“微”表示微溶于水,“挥”表示挥发性,“—”表示那种物质不存在或遇到水就分解了。
(1)CaCO3属于_______(填“可溶物”、“微溶物”或“不溶物”)。
(2)表中可溶于水的硫酸盐有________种。
(3)在溶液中,磷酸钠与氯化钙能否发生复分解反应,若能,写出化学方程式,若不能,说明理由_______________________________________。
2Na3PO4+3CaCl2 === Ca3(PO4)2↓+6NaCl
(4)某同学将盐酸倒入Ba(OH)2溶液中,得到溶液甲。①溶液甲中溶质的组成情况可能有________种。②实验设计,探究溶液甲中可能含有的溶质。a.探究溶液甲中是否含盐酸
b.探究溶液甲中是否含Ba(OH)2
上述三个方案中有一个不合理,请指出不合理的方案编号并说明理由_____________________________________________________________________________。
(或CuCl2,其他合理答案均可)
方案3;溶液中含有BaCl2,不论是否含有Ba(OH)2均会产生白色沉淀(其
③欲从溶液甲中获得纯净的BaCl2固体,应采取的简单操作是__________________________________________________________________________________________________________。
测溶液甲的pH,若pH≤7,蒸发结晶,若pH>7,向溶液甲中加入盐酸至溶液pH≤7,再蒸发结晶(其他合理答案均可)
类型2 数据分析类探究(10年4考)
例 (2022沈阳节选)观察是学习化学的重要方法,我们可以运用自己的感官,也可以借助仪器通过实验,观察物质及其变化的条件、现象和结果。观察与思考二:在密闭容器内,蜡烛燃烧过程中O2体积分数的测定
实验1:一定条件下,蜡烛在一瓶空气中燃烧,某同学利用O2传感器,测定燃烧过程中O2的体积分数(如图所示)。观察实验结果图,初始时O2的体积分数是____%,蜡烛熄灭时O2的体积分数是___%。
实验2:相同实验条件下,某同学另取一瓶混有空气的O2进行测定(初始时O2的体积分数是30%)。结合已有信息,合理猜想:蜡烛熄灭时O2的体积分数(与实验1相比较)。【温馨提示:实验操作合理,蜡烛相同且量足够,忽略仪器误差】请写出两种不同情况并分别说明理由。
猜想1及理由:_________________________________________________________________________。猜想2及理由:__________________________________________________________________________________________________________________________________________。
小于16%,初始时氧气体积分数变
烛着火点以下氧气的体积分数减少值可能大于
等于16%,由图可知,当氧气体积
为16%时蜡烛可能就会熄灭(其他合理答案均可)
大,导致燃烧剧烈,放热多,温度不易降低到蜡
14%(其他合理答案均可)
(1)该方法能否用于测定空气中氧气的体积分数并说明理由___________________________________________。(2)若用CO2气体传感器测定燃烧过程中CO2气体的体积分数,请结合蜡烛燃烧的产物,在下图中画出测定的CO2气体的体积分数变化趋势。
不能,蜡烛燃烧有气体生成,无法形成压强差
误差是导致理论数据与实际数据存在差异的重要因素。
【注意】①不同题目需结合具体情况分析理由;②曲线类试题:猜想主要是曲线的拐点、终点的变化,理由是反应过程中浓度的变化、不同物质反应的曲线差异等。
1. 将二氧化碳气体通入氢氧化钠溶液中,观察不到明显现象。某同学利用传感器测定氢氧化钠溶液加入二氧化碳中的压强变化证明二者确实发生了反应(如图1所示)。 已知:15 ℃、101 kPa下,1体积水约能溶解1体积的二氧化碳。
氢氧化钠与二氧化碳反应,消耗了瓶内二氧化碳,使瓶内压强变小的幅度较大
(1)在圆底烧瓶中充满CO2,通过注射器向瓶中注入液体。图2是测定加入足量同体积水和氢氧化钠溶液的压强变化图像,其中表示氢氧化钠溶液与二氧化碳反应的曲线是__(填“Ⅰ”或 “Ⅱ”),判断的理由是_____________________________________________________________________。
(2)解释曲线Ⅰ刚注入液体时压强略微增大的原因是_________________________________________________________________________________________。
刚注入液体时,液体会占据一定的体积,使圆底烧瓶中的二氧化碳体积减小,导致瓶内压强略微增大
(3)其他条件不变,如果将图1装置中注射器里的氢氧化钠溶液的浓度增大一倍,请结合对上述曲线的分析对容器内压强变化至最低点位置做出猜想并分别说出理由。 ①横坐标猜想及理由:_________________________________________________________;
压强变小至最低值所需时间缩短,因为浓度越大,
②纵坐标猜想及理由:______________________________________________________________。
压强变小至最低值与稀溶液相同,因为圆底烧瓶
2. 化学兴趣小组用下图所示装置进行一氧化碳还原氧化铁的模拟炼铁实验。
当玻璃管内固体粉末由红粽色全部变为黑色时停止加热。亮亮认为该黑色固体全部是铁,但同学小华提出了质疑,她将该黑色固体研磨后用磁铁吸引,发现全部被吸引。
【提供资料】a. Fe2O3是在一定温度下逐步失去其中的氧,依次生成Fe3O4、FeO和Fe;b. c. 酒精灯火焰的温度一般为400 ℃~700 ℃左右。
【大胆猜想】你认为黑色物质的组成可能是:猜想一:____猜想二:____________猜想三:_______________
【提出问题】该反应中生成物黑色物质是什么?
【实验方案】在一定温度下,记录数据如下表:
为了进一步确定生成物的成分,有同学试图通过反应前后固体质量的变化来确定黑色固体的成分,请你结合信息,分别验证其中两个猜想正确并用数据说明理由。①_____________________________________________________________。②_____________________________________________________________________________。
有同学也找到一些铁锈样品进行实验探究,他所用的实验装置如图所示:(1)待反应完成后,将所得黑色固体物质放入足量的稀硫酸中。小明认为该物质中并不含铁,他的依据是:_____________________________。
该物质与稀硫酸反应不产生气泡
(2)为了解释这一反常现象,他查到某炼铁厂对氧化铁和一氧化碳进行的热反应分析,根据相关的数据绘制图像如下。通过分析确定实验没有得到铁的主要原因是_____________________________________________________,你的改进方法是____________________。
使用酒精灯加热时,达不到氧化铁完全转化为铁所需
类型3 定量计算类探究(10年3考)
➡【温馨提示】有关定量计算的方法详见微专题17
1. 为验证氢氧化钠的化学性质,设计了如图1所示实验方案:(1)实验A验证了氢氧化钠的两条化学性质,其中酚酞试液所起的作用是_______________________________________________。
证明氢氧化钠溶液显碱性,证明氢氧化钠能和酸反应
(2)实验B中发生反应的化学方程式为:________________________________________。
CuSO4+2NaOH === Cu(OH)2↓
(3)实验C没有观察到明显现象,于是他们展开了如图2探究:制取纯净、干燥的二氧化碳气体,并验证二氧化碳气体与氢氧化钠溶液可以发生化学反应。
【查阅资料】Ⅰ.碳酸钠、水、二氧化碳可以化合生成碳酸氢钠。Ⅱ.20 ℃,氢氧化钠、碳酸钠和碳酸氢钠的溶解度如表所示。【定性探究】①装置A中发生反应的化学方程式为:______________________________________。
CaCO3+2HCl === CaCl2+H2O+CO2↑
②装置B中盛有NaHCO3溶液,目的是____________________________。
除去二氧化碳中混有的氯化氢
③图中C处装置应该选择__(填“E”或“F”)达到实验目的;④在实验过程中装置D中观察到______________________说明CO2和NaOH溶液能发生反应。
溶液变浑浊(有沉淀产生)
【定量计算】20 ℃时,装置D中盛有210 g NaOH的饱和溶液,经测定,实验过程中装置D的温度保持20 ℃。试计算:⑤装置D中210 g NaOH饱和溶液含有NaOH的质量是____ g。
⑥装置D中NaOH全部转化成Na2CO3时,理论上最多可以生成Na2CO3的质量是______ g。⑦当向装置D中通入足量的CO2时,可以将NaOH全部转化为NaHCO3,实验过程中会析出 NaHCO3的质量为______ g(不考虑结晶水)。
2. 长期放置于空气中的铜表面生成的绿色物质是碱式碳酸铜,碱式碳酸铜受热分解生成氧化铜、水、二氧化碳,可用于制造各种含铜化合物。化学兴趣小组用如图装置测定碱式碳酸铜[mCu(OH)2·nCuCO3]中m、n的数值,取17.3 g绿色物质,充分反应,经过测定,装置乙中质量增加0.9 g,装置丙中质量增加4.4 g。(假设装置气密性良好,实验操作正确,生成物质全部吸收,绿色物质中无其他成分)
(1)装置甲、乙、丙、丁中发生的变化与其他三者本质不同的是___。(2)反应后装置甲中试管残留固体质量为_____。(3)装置丁的作用是_____________________________________________。(4)m值为__,n值为__。
防止空气中的二氧化碳进入装置丙中影响实验结果
(5)据铜锈的元素组成判断,铜锈蚀可能是铜与空气中的氧气、_________________________共同作用的结果。(6)小明发现从不同地点收集到的两个铜器(一个是纯铜做的,一个是青铜做的)中,纯铜器的铜绿比青铜器的少,他据此分析认为青铜比纯铜易锈蚀,小明的分析是否全面并说明理由______________________________________________________。
二氧化碳、 水(或CO2、H2O)
不全面,两个地点收集的两个铜器,
变量因素太多,无法比较
3. (2022沈阳节选)加热碳酸氢铵时闻到了刺激性气味,引起同学们对氨气的兴趣,决定对其进行探究。(二)验证氨气中氮、氢两种元素的质量比【查阅资料】(5)氨气在加热条件下能与氧化铜反应:2NH3+3CuO 3X+N2+3H2O,X的化学式是____。
【设计方案】如图所示:(假定氮气被完全吸收)
【数据处理与误差分析】充分反应后,测得A、B、C三个装置在反应前后的质量变化如下表所示:
(6)甲同学利用A、B、C三组装置所提供的数据,乙同学利用B、C两组装置所提供的数据,计算出的氮、氢元素的质量比都与理论值明显不符,分析产生误差的原因是__________________________________________________________。
硫酸吸收了未反应(或过量)的氨气,导致计算出
(7)若用A、C两组装置所提供的数据计算,与理论值是否相符?写出简单的计算过程证明你的结论____________________________________。
氨气中氮元素和氢元素的质量比是14:3
类型4 性质类探究(10年4考)
1. 高锰酸钾在生产、生活中有广泛应用。实验小组对高锰酸钾的某些性质进行研究。Ⅰ. 不稳定性(1)如图所示进行实验,KMnO4受热分解的化学方程式为__________________________________,3.16 g KMnO4产生O2的质量为____g。(2)用向上排空气法收集O2的原因是_____________________。
2KMnO4 K2MnO4+MnO2+O2↑
Ⅱ. 腐蚀性【查阅资料】KMnO4溶液呈中性、有腐蚀性。【进行实验】实验1:将新鲜鸡皮在不同浓度的KMnO4溶液中浸泡相同时间,现象如下表。
实验2:将铜片分别浸泡在4种溶液中进行实验,所得数据如下表。
(3)实验1的目的是_______________________________________。
探究高锰酸钾溶液浓度与鸡皮被腐蚀的关系
(4)实验2中,通过对比②和④,得出的结论是_______________________________________________________。
其他条件相同时,高锰酸钾溶液浓度越高对铜的腐蚀性越强
(5)实验2中,欲得出“KMnO4和硫酸共同作用对铜才有腐蚀性”的结论,需要对比________(填编号)。
(6)实验2中,铜片被腐蚀的反应如下,补全该反应的化学方程式。5Cu+2KMnO4+8H2SO4=== 5CuSO4+2MnSO4+K2SO4+_______
2. (2023于洪区一模)碘酸钾(KIO3)为白色固体,可溶于水,常作为补碘剂被添加到食盐中。小组同学实验探究其性质。【进行实验1】用下图装置完成实验,探究KIO3的热稳定性。记录如下:
【解释与结论】(1)实验1-1结束时, 应进行的操作是先撤______。(2)1-2中现象说明1-1中收集到的气体是______。
(3)由实验1-1可知,KIO3受热分解生成一种气体和KI,请写出此反应的化学方程式________________________。
2KIO3 2KI+3O2↑
【进行实验2】按下表数据,用下图装置进行实验,探究KIO3与维生素C的反应及其影响因素,记录如下表。资料:淀粉溶液遇碘单质(I2)变为蓝色,遇KIO3、维生素C(化学式为C6H8O6)、醋酸(化学式为C2H4O2)不变色。
【解释与结论】(4)实验2-1中,KIO3溶液与维生素C溶液的溶质质量分数_____(填“相等”或“不相等”)
(5)对比实验2-1、2-2,探究的影响KIO3与维生素C反应速率的因素是反应物的______________________。
溶质的质量分数(或浓度)
(6)由上述实验得到结论“KIO3能与维生素C反应生成碘单质(I2)”,实验证据是实验2-1和实验2-2中溶液由____________。
【反思与评价】(7)甲同学由实验2-3得出结论:醋酸会促进KIO3与维生素C的反应;乙同学认为不严谨,理由是________________________________________
_____。
可能是醋酸与KIO3反应生成了I2,使淀粉溶液
类型1 教材实验拓展探究(10年8考)
1. (2022沈阳)化学小组同学探究“酸的化学性质”,请你参与并完成下列部分实验内容。【进行实验】
【发现问题】碱式碳酸铜与稀硫酸反应形成的CuSO4溶液显蓝色,而与盐酸反应形成的CuCl2溶液显绿色。【提出问题】同样都含有Cu2+,为什么③号试管中的CuSO4溶液显蓝色,而④号试管中CuCl2溶液显绿色?
【猜想与假设】猜想一:若溶液中Cu2+显蓝色,则 对Cu2+显色无影响,而Cl-对Cu2+显色有影响;猜想二:若溶液中Cu2+显绿色,则________________________________________________;猜想三:……
【实验验证】同学们用下列两种不同方案初步验证猜想一,请你补全实验所需试剂。方案一:取少量③号试管中的CuSO4溶液于另一支试管中,向其中加入___________________,观察到预期实验现象,猜想一正确。方案二:取少量④号试管中的CuCl2溶液于另一支试管中,向其中加入_______________________________________,观察到预期实验现象,猜想一正确。
适量BaCl2(合理即可)
适量Ag2SO4(或AgNO3,其他合理答案均可)
【评价与反思】同学们在实验探究的过程中,体会到了溶液颜色成因复杂,相关知识还有待进一步学习。
2. (2023北京)硬水加热时易产生水垢,很多工业用水需要对硬水进行软化处理。小组同学利用1.5%的肥皂水比较水的硬度。【查阅资料】硬水含较多可溶性钙、镁化合物;软水不含或含较少可溶性钙、镁化合物。Ⅰ.探究水的硬度、肥皂水的用量与产生泡沫量的关系【进行实验】向蒸馏水中加入CaCl2和MgCl2的混合溶液,配制两种不同硬度的硬水。用蒸馏水和两种硬水完成三组实验,记录如下:
【解释与结论】(1)对比②和⑧可知,肥皂水能区分软水和硬水,依据的现象是_____________________________。(2) 设计第2组实验时,为控制水的硬度相同,⑤中x应为____。(3)第2组实验的目的是_______________________________________________________。(4)由上述三组实验得到的结论是__________________________________________________________________________________________________________________。
其他条件相同,当水的硬度相同时,肥皂水用量越多,产生泡沫越多;当肥皂水用量相同时,水的硬度越小,产生泡沫越多
Ⅱ.比较不同水样的硬度【进行实验】用四种水样完成实验,记录观察到泡沫产生时所需肥皂水的用量。
【解释与结论】(5)硬度最大的水样是_____。(6)由上述实验可知,能将自来水硬度降低的方法有_____。(7)继续实验,发现山泉水的硬度大于自来水的硬度,其实验方案为______________________________________________________________________________________。
取5mL山泉水样品于试管中,滴加1.5%的肥皂水,观察到泡沫产生时所需肥皂水的滴数大于9滴
3. 经过一年的学习,同学们的化学探究能力得到了明显提升。兴趣小组想深入探究人体呼出气体的成分,进行了如下探究活动:【活动一】探究人体呼出气体中是否含有CO2向装有呼出气体的集气瓶中滴加少量澄清石灰水,振荡后观察到石灰水变浑浊,结论:_______________________。
人体呼出气体中含有CO2
【活动二】探究人体呼出气体中CO2的体积分数兴趣小组同学用图1所示装置进行实验。(锥形瓶内充满人体呼出的气体)实验前注射器内液体体积为50 mL,向锥形瓶内注入少量液体后,注射器内的液体开始被自动吸入锥形瓶,充分反应后,注射器内NaOH溶液的体积为30 mL。
小亮同学提出疑问:锥形瓶内CO2是否反应完?同学们展开了激烈的讨论,设计实验并证明锥形瓶内无色溶液中确实含有NaOH,得出锥形瓶内CO2已反应完。
结论:人体呼出气体中CO2的体积分数为___。
【活动三】探究人体呼出气体中O2的体积分数兴趣小组同学用图2所示装置进行实验。(注射器及玻璃管内充满人体呼出的气体)①实验中若使氧气充分反应,应进行的操作是___________________。②判断装置中的O2是否反应完的现象是__________________________________________________。结论:人体呼出气体中O2的体积分数为16%。
【实验反思】活动三所用方法与教科书上“测定空气里O2的含量”的方法相比,其优点是:_________________________________________(答一点即可)。
环保(或没有五氧化二磷污染环境等合理即可)
4. (2023沈阳三模)某化学小组初步探究氢氧化钠和氢氧化钙的性质、变化和获得方法。查阅相关资料:Ⅰ.部分酸、碱和盐的溶解性表(室温)说明:“溶”表示那种物质可溶于水,“不”表示不溶于水,“微”表示微溶于水,“挥”表示挥发性,“—”表示该物质不存在或遇到水就分解了。
【性质与变化】(1)上表涉及的物质中属于碱的有_______种。(2)NaOH和Ca(OH)2具有相似的化学性质是由于其溶液中含有大量的_____。
(3)请用两种不同的方法鉴别NaOH固体和Ca(OH)2固体。
【实践与应用】(4)某工厂计划利用含碳酸钙80%的石灰石生产22.4t氧化钙,请计算:①氧化钙的相对分子质量是____。②理论上需要石灰石的质量是____。(5)工业上将石灰石煅烧成氧化钙后,经精选与水消化制备氢氧化钙,该反应的化学方程式为________________________。(6)氢氧化钙在生活和生产中有广泛应用,请写出其中一点:__________________________________________。
CaO + H2O === Ca(OH)2
来改良酸性土壤 (其他合理答案均可)
【查阅资料】①铁粉为黑色:常温下,Fe、Fe3O4可被磁铁吸引;②PdCl2溶液可用于检验CO,原理是:PdCl2+CO+H2O === Pd↓+CO2+2HCl;
5. (2023重庆B卷)早在春秋战国时期,我国就开始生产和使用铁器。某实验小组利用焦炭和Fe2O3模拟早期炼铁并检验可能的产物,实验装置如下:
③Fe3O4与硫酸反应:Fe3O4+4H2SO4 === FeSO4+Fe2(SO4)3+4H2O。【实验现象】澄清石灰水变浑浊,PdCl2溶液中产生黑色沉淀,玻璃管内粉末全部变成黑色,冷却后,用磁铁靠近黑色固体,黑色固体被部分吸引。(1)仪器A的名称是_______。(2)为了检验气体产物,装置从左到右的接口连接顺序为a→____→____→____→____。(3)澄清石灰水变浑浊的化学方程式为_______________________________。
CO2+Ca(OH)2 === CaCO3↓+H2O
【实验结论】反应生成CO和CO2,磁铁上的黑色固体可能是Fe、Fe3O4。【提出猜想】磁铁上的黑色固体是什么?猜想一:Fe猜想二:Fe3O4猜想三:Fe和Fe3O4
【归纳总结】根据实验结论和探究结果,C与Fe2O3,反应的化学方程式为___________________________________。
6. (2022沈阳)某化学小组对石灰石灼烧后得到的固体进行相关探究。成分分析(1)检验灼烧过程中产生的新物质①根据已有知识和经验判断:石灰石灼烧后固体中含有CaO,判断的依据是:__________________________(用化学方程式表示)。
(2)检验灼烧后固体中是否含有CaCO3向盛有灼烧后固体的烧杯中滴加稀盐酸,有气泡产生,证明________________________。
CaO+H2O === Ca(OH)2
②设计实验方案进行验证:
数据分析用反应前后质量差计算灼烧后固体中CaCO3的质量分数化学小组设计以下两个实验方案,方案中反应前后质量差分别用m1与m2表示。(两方案中实验操作误差忽略不计,取用的灼烧后固体成分均匀、质量相等,固体中除CaO、CaCO3,其余成分均不发生反应,所用稀盐酸经估算确保足量)
结合信息,比较m1与m2的关系。请写出两种不同猜想并分别说明理由。猜想1及理由 : ______________________________________________________________________________________________________;猜想2及理由:__________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________。经分析选择合理的实验方案,进行计算……
应后生成CO2质量相等,方案一中部分CO2溶于水,m1偏小(其他合理答案均可)
m1>m2,两方案固体中CaCO3质量相等,完全反应后生成CO2质量相等,方案一溶液中水蒸气和氯化氢气体逸出,m1偏大(其他合理答案均可)或m1
相关课件
这是一份2024沈阳中考化学二轮专题突破 微专题 化学用语(课件),共20页。PPT课件主要包含了Na+,Li+,Cu2+,Fe3+,Fe2+,Al3+,NH4+,Cl-,OH-,Al2O3等内容,欢迎下载使用。
这是一份2024山东中考化学二轮重点专题突破 专题七 实验探究题(课件),共60页。PPT课件主要包含了实验猜想潍坊3考,一氧化碳合理即可,CaOH2,猜想四,氯离子或Cl-,有白色沉淀生成,玻璃棒,标准比色卡,水蒸气,装置的评价等内容,欢迎下载使用。
这是一份2024宁夏中考化学二轮重点专题突破 专题六 实验探究题(课件),共60页。PPT课件主要包含了反应物中不含氮元素,氯离子,过氧化氢溶液中含有水,MgCl2,无明显变化,黑色固体变成红色,设计并进行实验,AgNO3溶液,产生白色沉淀,有刺激性气味气体产生等内容,欢迎下载使用。









